
- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •2H2s(газ) o2(газ) 2h2o(жидк.) 2s(тв.);
- •2S(тв.) 3o2(газ) 2h2o(жидк.) 2h2so4(жидк.),
- •4HCl(газ) o2(газ) 2Cl2(газ) 2h2o(жидк.)
- •Вариант №5
- •2Ch3Cl(газ) 3o2(газ) 2co2(газ) 2h2o(жидк.) 2hCl(газ),
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •2H2o(жидк.) o2(газ) 2h2o2(жидк.),
- •Вариант №17
- •3Hno2(водн. Р-р) hno3(жидк.) 2no(газ) h2о(жидк.),
- •Вариант №18*
- •4Nh3(газ) 3o2(газ) 2n2(газ) 6h2o(жидк.)
- •3C2h2(газ) c6h6(жидк.)
- •Скорость химических реакций
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •II закон фотохимии:
- •Фотосинтез
- •6Co2 6h2o c6h12o6 6o2 g0 2861,9 кДж/моль.
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
4) Приготовление раствора аналогично задаче №6.
9. Приготовить
250 мл раствора H2SO4
с C(H2SO4) 0,1 моль/л
из раствора H2SO4
с (H2SO4) 10%.
![]()
1,056 г/моль.
1,056 г/моль.
|
Дано:
C(H2SO4) 0,1 моль/л (H2SO4) 10% 0,1 |
Решение. 1) найдем массу H2SO4 в приготовляемом растворе:
m(H2SO4)
C(H2SO4)·M(H2SO4)· |
|
|
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:
![]()
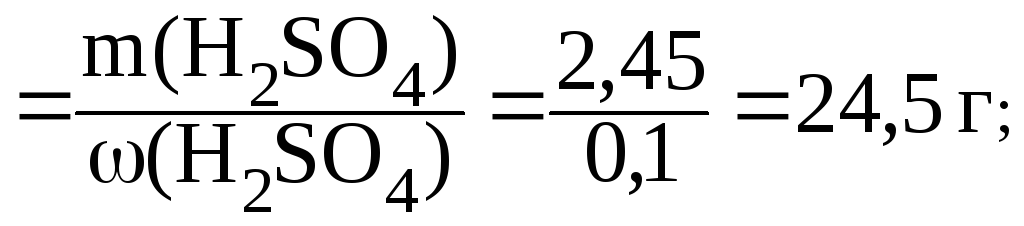
3)
найдем
![]() (H2SO4):
(H2SO4):
![]()

4) приготовление раствора:
а) отмерить мерным цилиндром 23,2 мл 10% р-ра H2SO4;
б) перенести его в мерную колбу вместимостью 250 мл;
в) добавить до метки дистиллированную воду.
10. Приготовить
100 мл раствора НС1 с C(![]() HCl) 0,1 моль/л
из раствора HCl
с (НС1)
5%;
1,02 г/мл.
HCl) 0,1 моль/л
из раствора HCl
с (НС1)
5%;
1,02 г/мл.
|
Дано:
c(
(HCl) 5% 0,05 |
|
|
|
Решение.
1) для
(HCl)
z 11 1,
![]() ,
следовательно:
,
следовательно:
M(![]() HCl) 36,5
г/моль;
HCl) 36,5
г/моль;
2) найдем массу HCl в приготовляемом растворе:
m(HCl)
c(![]() HCl)·M(
HCl)·M(![]() HCl)·
HCl)·
![]()
0,1·36,5·0,1
0,365 г;
0,1·36,5·0,1
0,365 г;
3) найдем массу 5% раствора HCl, который содержит 0,365 г кислоты:
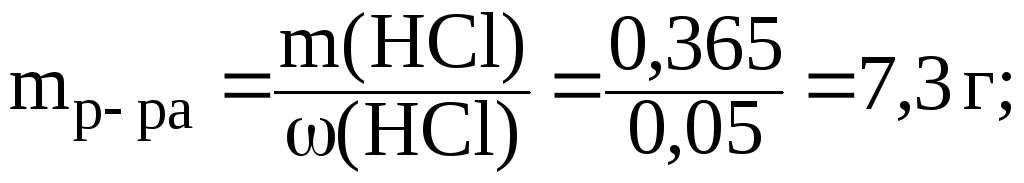
4) найдем
![]() (HCl):
(HCl):
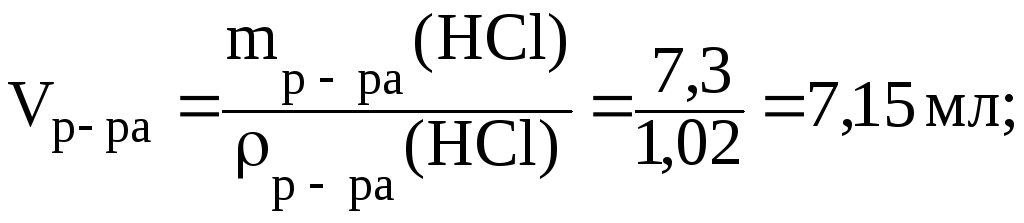
5) приготовление раствора аналогично предыдущей задаче.
11. c(Al2(SO4)3) 0,02
моль/л.
Найти
C(![]() Al2(SO4)3).
Al2(SO4)3).
|
Дано: C(Al2(SO4)3) 0,02 моль/л |
|
Решение. 1) найдем z для Al2(SO4)3: a) число ионов Al3+ 2; б) заряд 3: z 3·2 6
2)
так как C( C( |
|
C( |
||
|
|
12. Приготовить
250 мл раствора CuSO4
с C(![]() CuSO4)
= 0,1 моль/л из кристаллогидрата
CuSO4·5Н2О.
CuSO4)
= 0,1 моль/л из кристаллогидрата
CuSO4·5Н2О.
|
Дано:
C( |
|
|
m(CuSO4·H2O) ? |
Решение.
![]()
2) найдем массу безводного CuSO4 в растворе:
m(CuSO4)
C(![]() CuSO4)·M(
CuSO4)·M(![]() CuSO4)
CuSO4)
![]()
0,1·80·0,25
2 г;
0,1·80·0,25
2 г;
3) найдем массу кристаллогидрата, содержащего 2 г CuSO4:
M(CuSO4·H2O) 160 5·18 250 г/моль;
![]() ;
;
![]() .
.
4) приготовление раствора аналогично предыдущей задаче.
Вопросы для самоконтроля
1. Что такое раствор? Приведите примеры растворов, находящихся в разном агрегатном состоянии.
2. В чем заключается отличие химической теории растворов от физической?
3. Что такое количество вещества?
4. Что называют молярной массой?
5. Что такое химический эквивалент?
6. Что такое фактор эквивалентности?
7. Что называют молярной массой эквивалента?
8. Что такое массовая доля растворенного вещества? Какова ее размерность?
9. Что такое молярная концентрация? Какова ее размерность?
10. Что такое молярная концентрация эквивалента? Какова ее размерность?
11. Что такое моляльная концентрация? Какова ее размерность?
12. Что такое титр раствора? Какова его размерность?
13. Что такое мольная доля? Какова ее размерность?
9. Какими соотношениями связаны между собой выражения концентрации:
а) массовая доля и молярная концентрация;
б) массовая доля и молярная концентрация эквивалента;
в) молярная концентрация и молярная концентрация эквивалента?
Варианты задач для самостоятельного решения
Вариант №1
1. Вычислить массу воды, которую надо добавить к 300 г раствора с (NaCl) 5%, чтобы получить раствор с (NaCl) 1,5%.
2. Приготовить
200 мл раствора Al2(SO4)3
с C(![]() А12(SО4)3) 0,5
моль/л из раствора с C(A12(SO4)3) 0,8 моль/л.
А12(SО4)3) 0,5
моль/л из раствора с C(A12(SO4)3) 0,8 моль/л.
Вариант №2
1. К 500 г раствора NaCl с (NaCl) 0,05 добавили 300 г Н2О. Вычислить (NaС1) в полученном растворе.
2. Приготовить
200 мл
раствора CuSO4
с C(![]() CuSO4) 0,3 моль/л
из раствора с C(CuSO4) 0,2
моль/л.
CuSO4) 0,3 моль/л
из раствора с C(CuSO4) 0,2
моль/л.
Вариант №3
1. В
200 мл
раствора содержится 10 г
H2SO4.
Вычислить C(H2SO4)
и C(![]() H2SO4)
в растворе.
H2SO4)
в растворе.
2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 25 г CuSO45H2O в 200 г Н2О.
Вариант №4
l. (Na2CO3) 10%,
l,05
г/мл.
Вычислить
C(Na2CO3)
и
C(![]() Na2CO3).
Na2CO3).
2. Приготовить 200 мл раствора Na2CO3 с (Na2CO3) 0,5% ( 1 г/мл) из кристаллогидрата Na2CO310H2O.
Вариант №5
1. C(H2SO4) 0,01
моль/л, 1 г/мл.
Вычислить
(H2SO4)
и
C(![]() H2SO4).
H2SO4).
2. Приготовить 200 мл раствора FeSO4 с C(FeSO4) 0,1 моль/л из кристаллогидрата FeSO47Н2О.
Вариант №6
1. Вычислить
C(Na2SO4)
и C(![]() Na2SO4),
если 0,72 г сухого вещества растворили
в мерной колбе, вместимостью 200 мл.
Na2SO4),
если 0,72 г сухого вещества растворили
в мерной колбе, вместимостью 200 мл.
2. Приготовить 500 мл раствора CuSO4 с (CuSO4) 2% ( 1 г/мл) из раствора с C(CuSO4) 2 моль/л.
Вариант №7
1. Приготовить
250 мл раствора NaHCO3
с C(![]() NaHCO3) 0,01 моль/л
из сухого вещества.
NaHCO3) 0,01 моль/л
из сухого вещества.
2. (H2SO4) 3,24%.
Вычислить С(H2SO4)
и C(![]() H2SO4)
в растворе, если его плотность
1,02 г/мл.
H2SO4)
в растворе, если его плотность
1,02 г/мл.
Вариант №8
1. Приготовить 200 мл раствора Na2B4O7 с (Nа2В4О7) 3% и 1 г/мл из кристаллогидрата Na2B4O710Н2О.
2. Рассчитать титр раствора, полученного растворением 4 г КОН в воде в колбе вместимостью 500 мл.
Вариант №9
1. Приготовить
250 мл раствора H2SO4
с C(![]() H2SO4) 0,5 моль/л
из раствора H2SO4
с (H2S04) 12%.
(12% р-ра H2SO4)
1,08 г/мл.
H2SO4) 0,5 моль/л
из раствора H2SO4
с (H2S04) 12%.
(12% р-ра H2SO4)
1,08 г/мл.
2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 25 г CuSO45Н20 в 200 г Н2О.
Вариант №10
1. Приготовить 100 мл раствора NaHCO3 с C(NaHCO3) 0,l моль/л из раствора с (NaHCO3) 2%. 1,01 г/мл.
2. Приготовить
200 мл раствора CuSO4
с C(![]() CuSO4) 0,3 моль/л
из раствора с C(CuSO4) 0,4
моль/л.
CuSO4) 0,3 моль/л
из раствора с C(CuSO4) 0,4
моль/л.
Вариант № 11
1. Вычислить массу воды, которую надо добавить к 300 г раствора NaCl с (NaCl) 5%, чтобы получить раствор с (NaCl) 1,5%.
2. Приготовить 500 мл раствора CuSO4 с (CuSO4) 2% ( 1 г/мл) из раствора с C(CuSO4) 4 моль/л.
Вариант №12
1. К 500 г раствора NaCl с (NaCl) 0,05 добавили 500 г Н2О. Вычислить (NaCl) в полученном растворе.
2. Приготовить
500 мл раствора NaHCO3
с C(![]() NaHCO3) 0,02 моль/л
из сухого вещества.
NaHCO3) 0,02 моль/л
из сухого вещества.
Вариант №13
1. В
200 мл раствора содержится 10 г H2SO4.
Вычислить C(H2SO4)
и с(![]() H2SO4)
в растворе.
H2SO4)
в растворе.
2. Приготовить 400 мл раствора Na2B4O7 с (Na2B4O7) 2% и 1 г/мл из кристаллогидрата Na2B4O7·10Н2О.
Вариант №14
1. (Na2CO3) 5%,
1,03 г/мл.
Вычислить c(Na2CO3)
и с(![]() Na2CO3).
Na2CO3).
2. Приготовить
200 мл раствора Al2(SO4)3
с с(![]() A12(SO4)3) 0,5 моль/л
из раствора с c(Al2(SO4)3) 1,2 моль/л.
A12(SO4)3) 0,5 моль/л
из раствора с c(Al2(SO4)3) 1,2 моль/л.
Вариант №15
1. C(H2SO4) 0,01 моль/л,
1 г/мл.
Вычислить
(H2SO4)
и
C(![]() H2SO4).
H2SO4).
2. Приготовить 400 мл раствора Na2CO3 с (Na2CO3) 1% ( 1 г/мл) из кристаллогидрата Na2CO310Н2О.
Вариант №16
1. Вычислить
C(Na2SO4)
и C(![]() Na2SO4),
если 0,72 г сухого вещества растворили в
мерной колбе, вместимостью 200 мл.
Na2SO4),
если 0,72 г сухого вещества растворили в
мерной колбе, вместимостью 200 мл.
2. (H2SO4) 6,24%.
Вычислить C(H2SO4)
и C(![]() H2SO4)
в растворе плотностью 1,04 г/мл.
H2SO4)
в растворе плотностью 1,04 г/мл.
Вариант №17
-
Рассчитать титр раствора, полученного растворением 4 г КОН в воде в колбе вместимостью 500 мл.
-
Приготовить 500 мл раствора FeSO4 c C(FeSO4) 0,2 моль/л из кристаллогидрата FeSO47Н2О.
Вариант №18
-
Приготовить 100 мл раствора NaHCO3 с C(NaHCO3) 0,05 моль/л из раствора с (NаНСО3) 2% и 1,01 г/мл.
-
Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 50 г CuSO45Н2О в 400 г Н2О.
