
- •Оглавление:
- •Лекция № 10. Тема «ферменты».
- •Ферменты обладают специфичностью действия.
- •Лекция № 11. Тема «ферменты».
- •1. Концентрация субстрата.
- •2. Влияние концентрации фермента.
- •3. Влияние температуры.
- •4. Влияние рН среды.
- •Классификация ингибиторов ферментов
- •Неспецифические
- •Специфические
- •Эффектор
- •Лекция № 12. Тема «ферменты».
- •Энзимопатии, современные представления о наследственных болезнях.
- •Значение ферментов для медицины. Диагностическое значение определения активности ферментов в крови и моче.
- •Иммобилизованные ферменты.
- •Лекция № 13. Тема «витамины».
- •Классификация витаминов. Водорастворимые витамины:
- •Жирорастворимые витамины:
- •Лекция № 14. Тема «витамины».
- •Жирорастворимые витамины.
- •Цепные свободнорадикальные реакции.
- •Лекция № 15. Тема «тканевое дыхание».
- •Состав и значение атф-синтазного комплекса.
- •Лекция № 16. Тема «цикл трикарбоновых кислот».
- •Нарисовать схему «Катаболизм основных пищевых веществ».
- •Реакции цикла Кребса.
- •Функции цитратного цикла.
- •Написать реакцию.
- •Энергетический баланс цтк, его биологическое значение
- •Регуляция цикла Кребса.
- •Лекция № 17.
- •Раздел 2. «обмен веществ». Тема «обмен углеводов».
- •Реакции гликолиза.
- •«Выход атф при аэробном распаде глюкозы» (I этап).
- •«Выход атф при аэробном распаде глюкозы» (II и III этапы).
- •Лекция № 19. Тема «обмен углеводов».
- •Глюкозолактатный цикл – цикл Кори.
- •Методы исследования углеводного обмена
- •Лекция № 20. Тема «обмен углеводов».
Классификация ингибиторов ферментов

Неспецифические
Специфические
Необратимые
Обратимые
Конкурентные
(изостерические)
Неконкурентные
(аллостерические)
Неспецифические ингибиторы вызывают денатурацию ферментов (соли тяжелых металлов, кислоты, щелочи). Их действие не связано с механизмом ферментативного катализа.
Специфические ингибиторы – их действие связано с механизмом ферментативного катализа.
При необратимом ингибировании образуется прочный комплекс фермента и ингибитора, и фермент частично или полностью теряет свою активность. Даже если удалить свободный ингибитор из среды, то часть молекул фермента, которая успела связаться с ингибитором, остается угнетенной длительное время. Например, дыхательные яды – НСN, КСN, СО – они меняют валентность Fе и Сu, входящих в состав ферментов дыхательной цепи, препятствуя переносу электронов на О2.
В случае обратимого действия ингибитор образует с ферментом непрочный комплекс, способный распадаться, в результате чего снова возникает активный фермент. Обратимые ингибиторы бывают конкурентные и неконкурентные.
С позиции ферментативной кинетики следует различать конкурентное и неконкурентное торможение.
В случае конкурентного торможения регуляторы похожи на субстрат, поэтому они пытаются «перехитрить» фермент, связываясь с его активным центром. Возникает неактивный фермент-субстратный комплекс, который блокирует некоторое количество фермента. Торможение можно устранить избытком субстрата. Этот принцип широко используется клеткой, потому что наиболее похожим по структуре на субстрат может быть продукт реакции, а его накопление по конкурентному механизму будет тормозить активность фермента. Многие лекарственные препараты специфически тормозят активность ферментов потому, что они похожи на субстрат. Хороший ингибирующий эффект достигается путем регулярного приема такого вещества (поддержание терапевтической концентрации). Такой способ торможения называют изостерическим.
Тормозящее действие других веществ является неконкурентным, т.е. ингибитор присоединяется к энзиму не в том месте (или не только в том месте), с которым связывается субстрат. В таких случаях при увеличении концентрации субстрата энзим не освобождается от блокирующего действия. О таком торможении говорят как об аллостерическом торможении. Фермент, ингибируемый таким образом, называют аллостерическим. Наряду с центром связывания субстрата фермент имеет дополнительное место для связывания эффектора, которое называется аллостерическим центром. Аллостерический центр пространственно отделен от собственно каталитической единицы, в которой располагается активный центр. В результате изменяется структура всего фермента, и активный центр теряет способность присоединять субстрат.
 Аллостерическое
торможение имеет большое значение для
регуляции обмена веществ.
Аллостерическое
торможение имеет большое значение для
регуляции обмена веществ.
а) конкурентное ингибирование
а
[J]>[S] +
 ЕJ
S
ЕJ
S

+ + [S]>[J] б


 Е
S J ЕS
J
Е
S J ЕS
J
+
Е Р1 Р2
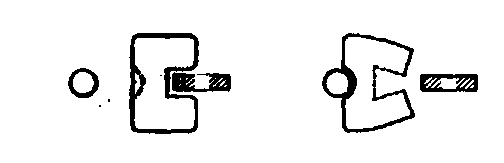 б)
неконкурентное ингибирование
б)
неконкурентное ингибирование
 аллостерический
аллостерический
центр



активный центр
Е – фермент, S – субстрат, J – ингибитор.
Аллостерическая регуляция ферментов основана на принципах связывания аллостерического эффектора. Возможно взаимодействие фермента с положительными и отрицательными эффекторами, не исключается также одновременное связывание нескольких эффекторов. Может быть и обратный эффект. Связывание субстрата в активном центре изменяет конформацию и на регуляторном центре. В результате снижается аффиность (сродство) фермента к эффектору. В этом случае идет своеобразная конкуренция между субстратом и эффектором, в результате которой действие эффектора может быть снять высокими концентрациями субстрата. В этом случае действие эффектора зависит от его же количества. Если, например, конечный продукт ферментативного процесса действует на фермент как естественный аллостерический эффектор, то при повышении концентрации конечного продукта наступает торможение превращения субстрата, а это приводит к накоплению субстрата, что создает неблагоприятные условия для связывания эффектора, и превращение субстрата продолжается. Аллостерическая регуляция протекает чаще всего по принципу обратной связи. Конечный продукт цепи превращений тормозит ключевой фермент в начале цепи, т.е. вся цепь реакций регулируется конечным продуктом (например при синтезе жирных кислот).




Е1 Е2
А

 В С Д
В С Д
Возможны также разнонаправленные влияния одного и того же эффектора на различные цепи химических превращений. Так действует, например, цитрат. Он является негативным эффектором окисления глюкозы до ацетил-КоА. Одновременно он выступает в качестве положительного эффектора при использовании ацетил-КоА для процессов синтеза жирных кислот.
Г
 люкоза
→ А → В → → ацетил-КоА → Х → У → Z →
жирные кислоты
люкоза
→ А → В → → ацетил-КоА → Х → У → Z →
жирные кислоты



Цитрат
Тогда при чрезмерном распаде глюкозы накопление цитрата будет тормозить окисление глюкозы и одновременно усиливать образование жирных кислот, тем самым увеличивается синтез нейтрального жира, который откладывается в депо.
При изменении функционального состояния ферментов возможна быстрая, тонкая регуляция активности.
Химическая модификация ферментов ведет к очень быстрому изменению их функционального состояния. Она заключается в ограниченном химическом изменении молекул фермента, и включает в себя введение или удаление небольшой группы атомов в молекуле фермента. Чаще всего это фосфорилирование или дефосфорилирование ферментов, или окисление SН-группы. Функциональное состояние фермента до реакции отличается от такого после реакции. Чаще всего в одной форме фермент неактивен. Обе формы модифицированного фермента обозначается буквами «а» и «в». химическое изменение фермента в другую форму осуществляется вспомогательным ферментом. Для прямой и обратной реакций необходимы разные вспомогательные ферменты.
вспомогательный
Форма фермента «а»
Форма фермента «в» фермент 1
фермент 1

вспомогательный
фермент 2
Эти вспомогательные ферменты регулируются модифицирующими эффекторами, которые чаще всего появляются в ответ на гормональный сигнал. В качестве такого эффектора чаще выступает цАМФ. Влияние модифицирующих эффекторов сохраняется в противоположность аллостерическому эффектору даже после их исчезновения. В этом случае для возвращения фермента в исходное состояние необходим новый эффектор. Так как регуляция вспомогательных ферментов также является ферментзависимым процессом, в ряде случаев возникают каскадные реакции в качестве тонких механизмов регуляции метаболизма.
