
Распространенные тривиальные названия некоторых неорганических соединений.
Таблица 3
|
Название |
Формула |
|
1 |
2 |
|
Алебастр |
CaSO4 0,5 H2O |
|
Аммиачная вода |
NH3 (водный раствор) |
|
Ангидрит |
CaSO4 |
|
Антихлор |
Na2S2O3 |
|
Барит |
BaSO4 |
|
Баритовая вода |
Ba(OH)2 (водный раствор) |
|
Белая сажа |
SIO2 |
|
Белый мышьяк |
As2O3 |
|
Бура |
Na2B4O7 10H2O |
|
Гипс |
CaSO4 2H2O |
|
1 |
2 |
|
Глауберова соль |
Na2SO4 10 H2O |
|
Глинозем |
Al2O3 |
|
Горькая соль |
MgSO4 7H2O |
|
Известь гашеная |
Ca(OH)2 |
|
Известь негашеная |
CaO |
|
Известь хлорная |
Ca(ClO)2 2H2O |
|
Каломель |
Hg2Cl2 |
|
Карборунд |
SiC |
|
Кварц |
SiO2 |
|
Киноварь |
HgS |
|
Коагулянт железный |
Fe2(SO4)3 |
|
Корунд |
Al2O3 |
|
Крон свинцовый |
PbCrO4 |
|
Купорос медный |
CuSO4 5H2O |
|
Ляпис |
AgNO3 |
|
Магнезит |
MgCO3 |
|
Магнезия жженая |
MgO |
|
Малахит |
CuCО3 Cu(OH)2 |
|
Нашатырный спирт |
NH3 (водный раствор) |
|
Нашатырь |
NH4Cl |
|
Пергидроль |
H2O 2 (30% раствор) |
|
Поташ |
K2CO3 |
|
Известь пушонка |
Ca(OH)2 |
|
Сода каустическая |
NaOH |
|
Соль кальцинированная |
Na2CO3 |
|
Сода питьевая |
NaHCO3 |
|
Сурик железный |
Fe2O3 |
|
Сухой лед |
CO2 (твердый) |
|
Хромпик |
K2Cr2O7 или Na2Cr2O7 2H2O |
|
Цементит |
Fe3C |
Экспериментальная часть
-
Взаимодействие основного оксида с кислотой.
В пробирку поместить небольшое количество (0,5 г) оксида свинца и 3- 4 мл разбавленной соляной кислоты. Смесь нагревать 2-3 минуты и дать отстояться. Слить жидкость в другую пробирку и охладить ее. наблюдать выпадение в осадок белых кристаллов хлорида свинца. Написать уравнение реакции образования этой соли.
-
Взаимодействие металла с кислотой.
В две пробирки налить по 1мл НСl и бросить в первую из них кусочек железа, во вторую – цинка. Какой газ выделяется? Написать уравнение реакции.
-
Взаимодействие кислоты с основанием. (Реакция нейтрализации).
В фарфоровую чашечку налить 5 мл 2Н раствора соляной кислоты, а затем по каплям приливать 4 мл 2н раствора едкого натра (NаОН) до получения при перемешивании нейтрального раствора (проверить лакмусовой бумажкой). Раствор выпарить над пламенем горелки. Написать уравнение реакции получения хлорида натрия.
-
Взаимодействие кислоты с солью:
-
к 1-2 мл раствора силиката натрия (Nа2 Si О3) прилить по каплям 12%-й раствор соляной кислоты, смесь встряхнуть. Что наблюдается? Написать уравнение реакции;
-
в пробирку с 1-2мл разбавленной соляной кислоты прибавить несколько капель раствора азотнокислого серебра (АgNО3). Что выпадет в осадок? Написать уравнение реакции;
-
в две пробирки прилить 1-2 мл раствора серной кислоты (Н2SO4), затем в первую пробирку добавить раствор хлорида бария ВаСl2, во вторую – раствор нитрата свинца Pb(NO3)2. Каков цвет образовавшихся осадков? Написать уравнение реакции.
-
Взаимодействие кислотного оксида с гидроксидом.
Через
раствор гидроксида кальция Са(ОН)2
(известковую воду) пропустить из аппарата
Киппа углекислый газ (СО2),
полученный в процессе реакции СаСО3
+ 2НСl
= СаСl2
+ СО2
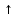 +
Н2О.
Наблюдать выпадение осадка карбоната
кальция, который при дальнейшем
пропускании СО2
растворяется. Почему? Написать уравнения
соответствующих реакций.
+
Н2О.
Наблюдать выпадение осадка карбоната
кальция, который при дальнейшем
пропускании СО2
растворяется. Почему? Написать уравнения
соответствующих реакций.
-
В две пробирки прилить 2-3 мл раствора нитрата свинца, затем в первую из них добавить раствор хромата калия, во вторую – иодида калия. Каков цвет образовавшихся осадков? Составить уравнения реакций.
-
Взаимодействие соли с гидроксидом:
-
к раствору сульфата меди CuSO4 прилить раствор едкого натра. Отметить цвет полученного осадка, написать уравнение реакции;
-
в пробирку с раствором хлорида кобальта (II) CoCl2 прилить по каплям раствор едкого натра. Обратить внимание на изменение цвета осадка. Составить уравнения реакций, учитывая при этом, что вначале образуется основная соль кобальта, а затем уже – гидроксид кобальта (II).
-
Получение двойной соли.
Смешать в небольшом стаканчике равные объемы насыщенных растворов сульфата алюминия и сульфата калия. Полученный раствор выпарить на слабом огне на одну третью часть и дать остыть. Через некоторое время наблюдать выделение мелких кристаллов алюминиевых квасцов. Написать уравнение реакции.
Замечания и меры предосторожности
-
Кислоты и щелочи наливать следует осторожно. Если кислота или щелочь случайно попала на кожу, необходимо быстро смыть ее большим количеством воды из водопроводного крана, а затем нейтрализовать, соответственно, либо 3-5% раствором гидрокарбоната натрия (NaHCO3), либо 3-5% раствором уксусной кислоты.
-
Отработанные кислоты и щелочи слить в специальные склянки.
-
В специально отведенную склянку следует вылить и растворы солей серебра.
-
При работе следует учитывать также токсичность таких веществ, как соли свинца, хрома (VI), меди.
Литература
-
Глинка Н.Л. Общая химия. – Л.:1980
-
Соколовская Е.М., Вовченко Г.Б., Гузея Л.С. Общая химия. – М.: Изд-во Московского университета, 1980
-
Фролов В.В. Химия. Изд.2-е. – М.: Высшая школа, 1979
-
Ахметов Н.С. общая и неорганическая химия. – М.: Высшая школа, 1981
-
Общий практикум по органической химии /под ред. Коста А.Н. – М.: Мир, 1965
-
Руководство к лабораторным работам по общей и неорганической химии /Под ред. Кульба Ф.Я. – Л.: Химия, 1976
-
Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии. – Казань, КИСИ, 1972
-
Хомяков К.Г., Хомченко Г.П., Холлер В.А. и др. практикум по общей химии. – М.: Изд-во МГУ, 1971
