
- •«Неорганическая химия» Часть I
- •Общие методические рекомендации по изучению дисциплины
- •Содержание дисциплины
- •Часть I. Общая химия Тема 1. Основные понятия и теоретические представления в химии
- •Тема 2. Классификация и номенклатура неорганических веществ.
- •Тема 3. Строение вещества: атомы, молекулы, жидкие, твердые вещества.
- •Тема 4. Элементы химической термодинамики. Химическое равновесие
- •Тема 5. Кинетика. Механизмы химических реакций.
- •Тема 6 Растворы. Кислотно-основные равновесия.
- •Тема 7. Основы электрохимии. Окислительно-восстановительные реакции
- •Тема 8. Комплексные соединения
- •1. Основные понятия и теоретические представления в химии
- •1.1. Основные законы атомно-молекулярного учения
- •«Масса веществ, вступивших в химическую реакцию, равна массе продуктов реакции».
- •1.2. Газовые законы химии
- •Нормальные условия
- •Примеры решения задач
- •2. Классификация и номенклатура неорганических соединений
- •2.1. Классификация неорганических соединений
- •1 ‑ Моно 4 ‑ тетра 7 ‑ гепта 10 ‑ дека
- •2 ‑ Ди 5 ‑ пента 8 ‑ окта 11 ‑ ундека
- •3 ‑ Три 6 ‑ гекса 9 ‑ нона 12 ‑ додека
- •2.3. Структурно-графические формулы веществ
- •2.4. Общие химические свойства основных классов неорганических веществ
- •2.5. Генетическая связь между важнейшими классами неорганических соединений
- •3. Строение вещества
- •3.1. Современные представления о строении атома.
- •3.2. Основные характеристики атомов
- •3.3. Химическая связь
- •Метод валентных связей (мвс)
- •Гибридизация атомных орбиталей
- •Ориентационное взаимодействие
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •3.5. Агрегатное состояние вещества
- •Контрольные задания
- •4. Химическая термодинамика
- •Примеры решения задач
- •Контрольные задания
- •5. Химическая кинетика. Скорость химических реакций
- •5.1. Понятие скорости химической реакции
- •5.2. Зависимость скорости реакции от концентрации реагирующих веществ.
- •5.3. Влияние температуры на константу скорости реакции
- •5.4. Кинетика обратимых реакций
- •5.5. Влияние внешних условий на химическое равновесие
- •Примеры решения задач
- •Контрольные задания
- •6. Растворы. Кислотно-основные равновесия
- •6.1. Концентрация растворов
- •6.2. Растворы неэлектролитов
- •6.3. Растворы электролитов. Теория электролитической диссоциации
- •6.4. Ионизация воды. РН растворов
- •6.5. Растворимость малорастворимых электролитов. Произведение растворимости.
- •6.6. Ионные реакции в растворе
- •6.7. Гидролиз солей
- •Примеры решения задач
- •Контрольные задания
- •7. Окислительно-восстановительные реакции. Основы электрохимии
- •7.1. Расчет степени окисления элемента
- •7.3. Классификация окислительно-восстановительных реакций
- •7.4. Критерий протекания окислительно-восстановительных реакций. Электродный потенциал
- •7.5. Факторы, влияющие на значение электродного
- •Если принять стандартными все концентрации, кроме рН, то:
- •7.6. Превращения энергии в электрохимических системах
- •7.7. Электролиз
- •Примеры решения задач
- •Контрольные задания
- •8. Комплексные соединения
- •8.1. Основные понятия
- •8.2. Номенклатура комплексных соединений
- •8.3. Изомерия комплексных соединений
- •8.4. Устойчивость комплексных соединений в растворе
- •Приложение
- •Перечень вопросов, выносимых на экзамен Общая химия (первый семестр)
- •Основные химические понятия: атомная и молекулярная масса, моль, молярная масса, эквивалент, эквивалентная масса, степень окисления элемента, валентность, фаза.
- •Литература
- •Оглавление
5.5. Влияние внешних условий на химическое равновесие
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т.е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях).
Действие внешних факторов (давления, концентрации и температуры), равно как и любых других, на систему, находящуюся в состоянии равновесия, обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то равновесие смещается в сторону противодействия этому воздействию.
Рассмотрим несколько возможных случаев смещения равновесия.
1. В систему добавлено исходное вещество. В этом случае
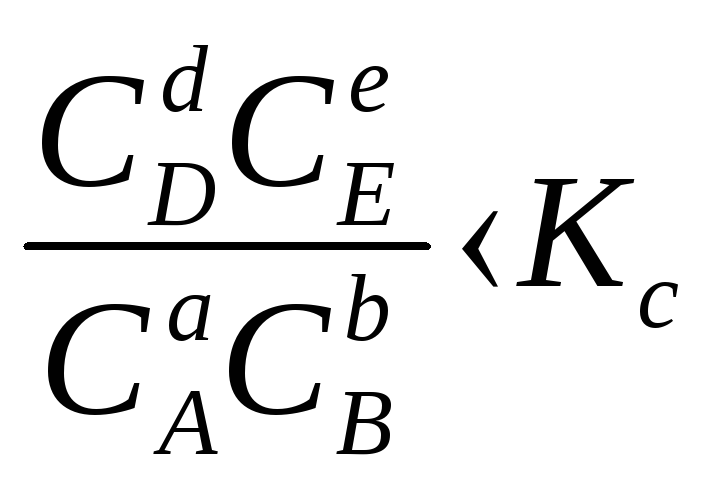 ,
,

В системе возникнет самопроизвольный химический процесс, направленный в сторону расходования исходных веществ и образования продуктов реакции (химическое равновесие смещается вправо).
2. В систему добавлен продукт реакции. В этом случае
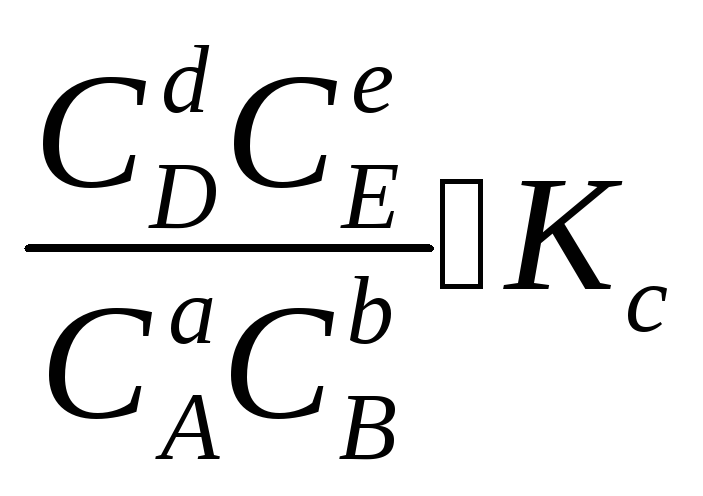 ,
,
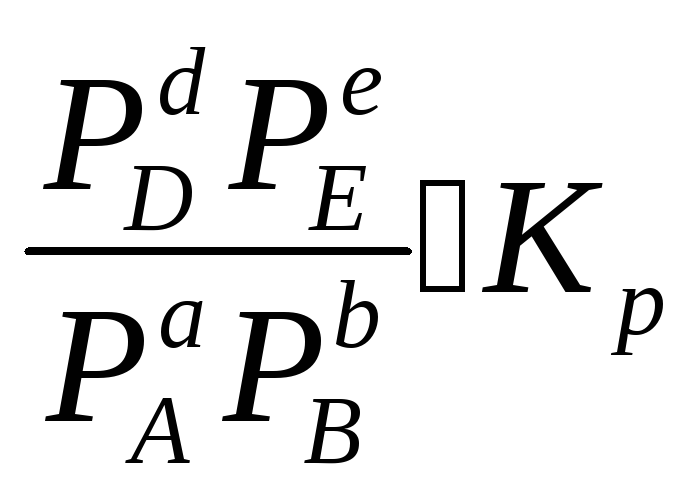
Химическое равновесие будет смещено влево (в сторону расходования продуктов реакции и образования исходных веществ).
3. Изменено общее давление (для реакций в газовой фазе).
Парциальные давления всех компонентов Рi в этом случае изменяются в одинаковой степени; направление смещения равновесия будет определяться суммой стехиометрических коэффициентов Δn. Если Δn > 0 (реакция идет с увеличением числа молей газообразных веществ), то ΔG > 0; равновесие смещается влево. Если реакция идет с уменьшением числа молей газообразных веществ (Δn < 0), то ΔG < 0; равновесие смещается вправо. Иначе говоря, увеличение общего давления смещает равновесие в сторону процесса, идущего с уменьшением числа молей газообразных веществ. Уменьшение общего давления газов в смеси (Р2 < Р1) будет смещать равновесие в сторону реакции, идущей с увеличением числа молей газообразных веществ.
4. Влияние температуры на положение равновесия.
Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия. Действительно: ΔG0 = -RTlnK, или
ΔH – TΔS = -RTlnK
Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции: ΔH° < 0 (ΔU° < 0). В этом случае, температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
Эндотермические реакции: ΔH° > 0 (ΔU° > 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Примеры решения задач
Пример 1. Как изменится скорость реакции
4НС1+О2 →2С12+ 2H2O,
протекающей в газовой фазе, если увеличить в три раза: 1) концентрацию кислорода, 2) концентрацию хлорида водорода, 3) давление?
Решение. Если обозначить концентрации НС1 и О2 соответственно через а и b, то выражение для скорости реакции примет вид:
v=k[HCl] [О2]=kа4b.
После увеличения концентраций O2 в три раза
v1 = kа43b.
Увеличение скорости реакции по отношению к первоначальному определяется отношением
![]()
После увеличения концентраций HCl в три раза
V1= k(3а)4b.
Увеличение скорости реакции по отношению к первоначальному определяется отношением
![]()
Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому в этом случае:
v1= k(3а)4 3b.
Увеличение скорости реакции по отношению к первоначальному определяется отношением
![]()
Пример 2. Чему равна массовая доля Н2 и 12, превращающихся в иодид водорода, если они взяты в реакцию количеством вещества 1 моль каждый, а константа равновесия при температуре опыта равно 4?
Решение. Запишем уравнение реакции: H2 + I2 ↔ 2HI
|
|
H2 |
I2 |
HI |
|
Взято, моль/л |
1 моль |
1 моль |
0 моль |
|
К моменту равновесия прореагировало |
Х моль |
Х моль |
|
|
0сталось |
1-х |
1-х |
|
|
Образовалось |
|
|
2х |
Равновесные концентрации Н2 и I2 составляют 1—х, а HI ‑ 2х моль/л
Запишем значение константы равновесия:
![]()
откуда х=0,5 моль/л.
Таким образом, массовая доля Н2 и 12, превратившихся в HI, составляет 50%
Пример 3. Какими способами в системе
2SO2+O2↔SO3 ΔН<0
можно смещать равновесие в сторону большего выхода SO3 при заданной концентрации SO2?
Решение. Согласно правилу Ле Шателье это достигается:
а) повышением концентрации О2;
б) уменьшением концентрации SO3 (удаление из сферы реакции);
в) повышением давления;
г) понижением температуры до такого ее значения, при котором скорость реакции еще достаточна для относительно быстрого достижения равновесия.
Пример 4. Константа равновесия реакции
CO+H2O↔CO2+Н2
при температуре 727 и 927 °С соответственно равна 1,4 и 0,74. Как найти ΔG этой реакции и определить ее направление при указанных температурах?
Решение. ΔG находится из уравнения
ΔG= - RT InK =-19,1 Т lg К. Температуры 727 и 927 °С соответственно равны 1000 и 1200 К.
Тогда:
a) ΔG1=-19,1-1000lg1,4=-2789 Дж/моль=-2,8 кДж/моль;
б) ΔG2= -19,1-1200lg0,74=+2502 Дж/моль=+2,5 кДж/моль.
Таким образом, в температурном интервале 727—927 °С (при ~800 °С) значение ΔG проходит через нуль и направление реакции меняется с прямого на обратное, поэтому реакцию следует проводить при температурах ниже 800 °С. С понижением температуры выход будет увеличиваться, однако время достижения равновесия будет расти.
Пример 5. При повышении температуры с 300 до 380 К скорость реакции возросла в 3000 раз. Найти температурный коэффициент реакции.
Решение: По уравнению Вант-Гоффа
![]() ,
,
Подставляем
значения параметров задачи в уравнение
 ,
3000 = γ8
,
3000 = γ8
Логарифмируя это выражение, получаем:
8lg γ= lg3000, 8lg γ = 3,48, γ=2,7
