- •«Неорганическая химия» Часть I
- •Общие методические рекомендации по изучению дисциплины
- •Содержание дисциплины
- •Часть I. Общая химия Тема 1. Основные понятия и теоретические представления в химии
- •Тема 2. Классификация и номенклатура неорганических веществ.
- •Тема 3. Строение вещества: атомы, молекулы, жидкие, твердые вещества.
- •Тема 4. Элементы химической термодинамики. Химическое равновесие
- •Тема 5. Кинетика. Механизмы химических реакций.
- •Тема 6 Растворы. Кислотно-основные равновесия.
- •Тема 7. Основы электрохимии. Окислительно-восстановительные реакции
- •Тема 8. Комплексные соединения
- •1. Основные понятия и теоретические представления в химии
- •1.1. Основные законы атомно-молекулярного учения
- •«Масса веществ, вступивших в химическую реакцию, равна массе продуктов реакции».
- •1.2. Газовые законы химии
- •Нормальные условия
- •Примеры решения задач
- •2. Классификация и номенклатура неорганических соединений
- •2.1. Классификация неорганических соединений
- •1 ‑ Моно 4 ‑ тетра 7 ‑ гепта 10 ‑ дека
- •2 ‑ Ди 5 ‑ пента 8 ‑ окта 11 ‑ ундека
- •3 ‑ Три 6 ‑ гекса 9 ‑ нона 12 ‑ додека
- •2.3. Структурно-графические формулы веществ
- •2.4. Общие химические свойства основных классов неорганических веществ
- •2.5. Генетическая связь между важнейшими классами неорганических соединений
- •3. Строение вещества
- •3.1. Современные представления о строении атома.
- •3.2. Основные характеристики атомов
- •3.3. Химическая связь
- •Метод валентных связей (мвс)
- •Гибридизация атомных орбиталей
- •Ориентационное взаимодействие
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •3.5. Агрегатное состояние вещества
- •Контрольные задания
- •4. Химическая термодинамика
- •Примеры решения задач
- •Контрольные задания
- •5. Химическая кинетика. Скорость химических реакций
- •5.1. Понятие скорости химической реакции
- •5.2. Зависимость скорости реакции от концентрации реагирующих веществ.
- •5.3. Влияние температуры на константу скорости реакции
- •5.4. Кинетика обратимых реакций
- •5.5. Влияние внешних условий на химическое равновесие
- •Примеры решения задач
- •Контрольные задания
- •6. Растворы. Кислотно-основные равновесия
- •6.1. Концентрация растворов
- •6.2. Растворы неэлектролитов
- •6.3. Растворы электролитов. Теория электролитической диссоциации
- •6.4. Ионизация воды. РН растворов
- •6.5. Растворимость малорастворимых электролитов. Произведение растворимости.
- •6.6. Ионные реакции в растворе
- •6.7. Гидролиз солей
- •Примеры решения задач
- •Контрольные задания
- •7. Окислительно-восстановительные реакции. Основы электрохимии
- •7.1. Расчет степени окисления элемента
- •7.3. Классификация окислительно-восстановительных реакций
- •7.4. Критерий протекания окислительно-восстановительных реакций. Электродный потенциал
- •7.5. Факторы, влияющие на значение электродного
- •Если принять стандартными все концентрации, кроме рН, то:
- •7.6. Превращения энергии в электрохимических системах
- •7.7. Электролиз
- •Примеры решения задач
- •Контрольные задания
- •8. Комплексные соединения
- •8.1. Основные понятия
- •8.2. Номенклатура комплексных соединений
- •8.3. Изомерия комплексных соединений
- •8.4. Устойчивость комплексных соединений в растворе
- •Приложение
- •Перечень вопросов, выносимых на экзамен Общая химия (первый семестр)
- •Основные химические понятия: атомная и молекулярная масса, моль, молярная масса, эквивалент, эквивалентная масса, степень окисления элемента, валентность, фаза.
- •Литература
- •Оглавление
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение.
![]()
Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.

Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях, или неполярных молекул в полярных растворителях (I2 растворяется в H2О).
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:
Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами. Пример, молекулярный кристалл I2
3.5. Агрегатное состояние вещества
В обычных условиях химические частицы не существуют индивидуально. Они образуют вещества в соответствующем агрегатном состоянии: газовом, жидком или твердом. Переход вещества из одного агрегатного состояния в другое не приводит к изменению его состава, но сопровождается изменением его структуры.
Твердые тела характеризуются устойчивостью формы. Составляющие их атомы, ионы и молекулы совершают малые колебания относительно некоторых фиксированных положений. Связь между атомами в твердых телах может быть ионной, ковалентной, металлической, водородной. Возможно образование межмолекулярных связей. Во многих твердых телах одновременно присутствует несколько типов связей.
Твердые вещества могут находиться в аморфном или кристаллическом состоянии.
Для аморфного состояния характерно наличие только ближнего порядка. Структуры аморфных веществ напоминают жидкости, однако обладают гораздо меньшей текучестью. Аморфное состояние обычно неустойчиво. Под действием механических нагрузок или при изменении температуры аморфные тела могут закристаллизоваться. Реакционная способность веществ в аморфном состоянии значительно выше, чем в кристаллическом.
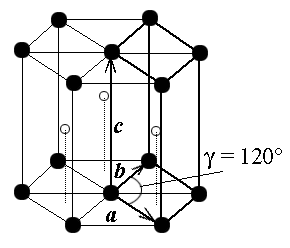
Строение вещества определяется не только взаимным расположением атомов в химических частицах, но и расположением этих химических частиц в пространстве. Наиболее упорядочено размещение атомов, молекул и ионов в кристаллах, где химические частицы (атомы, молекулы, ионы) расположены в определенном порядке, образуя в пространстве кристаллическую решетку. При определенных условиях образования они могут иметь естественную форму правильных симметричных многогранников. Кристаллическое состояние характеризуется наличием дальнего порядка в расположении частиц и симметрией кристаллической решетки. Кристалл можно представить как периодически повторяющиеся в пространстве одинаковые элементарные структурные единицы - элементарные ячейки кристалла, состоящие из одного, в простейшем случае, или нескольких атомов каждая. Пространственную решетку кристалла обычно характеризуют тремя векторами (а, b, c,) задав их длины (a, b, c), называемые периодами кристаллической решетки и углы (α, β, γ) между ними.
|
|
Рисунок 7 ‑ Параметры кристаллической решетки
|
Все многообразие кристаллов может быть описано с помощью 14 типов кристаллических решеток.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов – ионные, ковалентные, металлические, молекулярные.
Ионные кристаллы образованы катионами и анионами (например, NaCl). В них между частицами имеется в основном ионная связь. Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция. В образовании ионных кристаллов многих солей участвуют одноатомные катионы металлов и многоатомные анионы, например, нитрат-ион NO3−, сульфат-ион SO42−, карбонат-ион CO32−.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Металлическая кристаллическая решетка характерна для металлов. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
Жидкости характеризуются сильным взаимным притяжением молекул и наличием ближнего порядка в их расположении. Молекулы жидкости совершают частые столкновения с ближайшими соседями и относительно более редкие перемещения, приводящие к смене окружения. Жидкости характеризуются компактным расположением частиц, что вызывает малую их сжимаемость по сравнению с газами. Частицы в жидкости образуют лабильные упорядоченные агрегаты ("ближний порядок"), разделенные областями беспорядочного расположения частиц. Агрегаты частиц не имеют резких границ: перемещаясь в жидкости, они теряют одни частицы и приобретают другие, могут полностью разрушиться и возникнуть вновь. При понижении температуры агрегаты частиц увеличиваются и размерах, приобретают большую стабильность и упорядоченность в расположении частиц. Вблизи температуры кристаллизации агрегаты превращаются в зародыши кристаллизации твердой фазы.
Жидкости характеризуются подвижностью частиц, текучестью и изотропностью, то есть одинаковостью физических свойств по различным направлениям. Между частицами жидкости существуют равномерно распределенные по объему и перемещающиеся пустоты с размерами, сопоставимыми с размерами частиц.
Жидкости присущ определенный объем. Она стремиться принять такую форму, которая способствовала бы минимальной площади ее поверхности, так как для увеличения поверхности жидкости требуется дополнительная энергия, которая определяется поверхностным натяжением. Поверхностное натяжение возникает из-за неуравновешенности межмолекулярных сил, действующих у поверхности жидкости. Оно минимально, когда жидкость принимает сферическую форму.
Влияние жидкой среды на протекание химических процессов может быть весьма значительным, особенно если молекулы жидкого вещества полярны.
Газовое состояние характеризуется слабым взаимодействием составляющих вещество частиц. В результате свободного движения молекул газы заполняют весь предоставляемый им объем. Газообразные вещества обычно химически более активны, чем жидкие и твердые.
Подавляющее большинство химических реакций происходит в газах или жидкостях (в том числе в растворах), где химические частицы значительно более подвижны. Реакции в твердых телах встречаются реже.