
- •Оглавление
- •Введение
- •Молекулярно-кинетическая теория идеальных газов
- •Которое называется распределением Больцмана. Лабораторная работа 7 Определение постоянной Больцмана
- •Лабораторная работа Определение универсальной газовой постоянной
- •2. Явления переноса в термодинамически неравновесных системах
- •Лабораторная работа 13-1 Определение динамического коэффициента вязкости методом пуазейля
- •Лабораторная работа 13-2 Определение динамического коэффициента вязкости методом Стокса
- •Лабораторная работа Определение средней длины свободного пробега и эффективного диаметра молекул воздуха
- •Лабораторная работа Определение коэффициента теплопроводности твердых тел
- •3. Термодинамика
- •Взаимосвязь между внутренней энергией, работой и теплотой (первый закон термодинамики)
- •Второе начало термодинамики
- •В незамкнутой системе энтропия всегда возрастает. Функция состояния, дифференциалом которой является , называется приведенной теплотой.
- •Основное уравнение термодинамики. Это уравнение объединяет формулы первого и второго начала термодинамики:
- •Подставим уравнение (3.9), выражающее второе начало термодинамики, в равенство (3.10):
- •Лабораторная работа 9 Определение отношения теплоемкостей газов методом клемана - дезорма
- •Лабораторная работа 11 Определение изменения энтропии при изохорическом процессе в газе
- •Лабораторная работа 10 Определение адиабатической постоянной по скорости звука в воздухе
- •4. Свойства жидкостей
- •Лабораторная работа 12 Определение коэффициента поверхностного натяжения жидкости
- •Заключение
- •Библиографический список
- •Фундаментальные физические константы
- •Некоторые внесистемные единицы
- •Постоянные газов (при нормальных условиях)
Основное уравнение термодинамики. Это уравнение объединяет формулы первого и второго начала термодинамики:
Q = dU + р dV, (3.9)
![]() . (3.10)
. (3.10)
Подставим уравнение (3.9), выражающее второе начало термодинамики, в равенство (3.10):
![]() .
.
Это и есть основное уравнение термодинамики.
В заключение еще раз отметим, что если первый закон термодинамики содержит энергетический баланс процесса, то второй закон показывает его возможное направление.
Третье начало термодинамики
Ещё один закон термодинамики был установлен в процессе исследования изменения энтропии химических реакций в 1906 г. В. Нернстом. Он носит название теорема Нернста или третье начало термодинамики и связан с поведением теплоемкости веществ при абсолютном нуле температур.
Теорема Нернста утверждает, что при приближении к абсолютному нулю энтропия системы также стремится к нулю, независимо от того, какие значения принимают все остальные параметры состояния системы:
![]() .
.
Поскольку энтропия
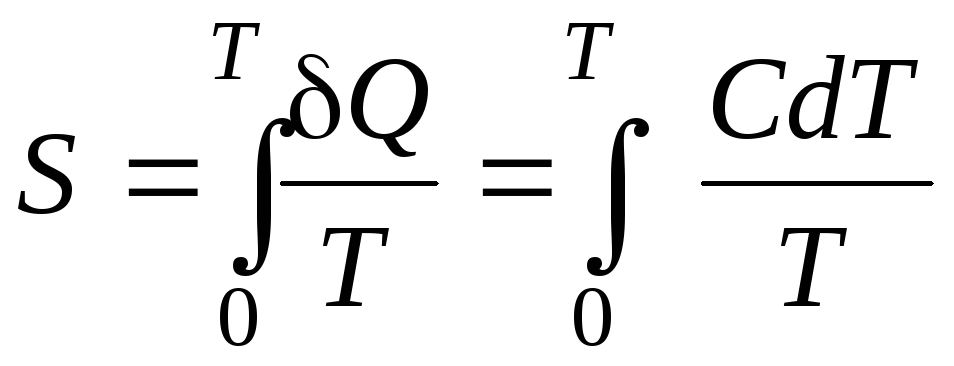 ,
а температура Т
стремится к нулю, теплоемкость вещества
также должна стремиться к нулю, причем
быстрее, чем Т.
Отсюда следует недостижимость
абсолютного нуля температуры
при конечной последовательности
термодинамических процессов, то есть
конечного числа операций – циклов
работы холодильной машины (вторая
формулировка третьего начала
термодинамики).
,
а температура Т
стремится к нулю, теплоемкость вещества
также должна стремиться к нулю, причем
быстрее, чем Т.
Отсюда следует недостижимость
абсолютного нуля температуры
при конечной последовательности
термодинамических процессов, то есть
конечного числа операций – циклов
работы холодильной машины (вторая
формулировка третьего начала
термодинамики).
Реальные газы
Уравнение Ван-дер-Ваальса
Изменение состояния разреженных газов при достаточно высоких температурах и низких давлениях описывается законами идеального газа. Однако при увеличении давления и понижении температуры реального газа наблюдаются значительные отступления от этих законов, обусловленные существенными различиями между поведением реальных газов и поведением, которое приписывается частицам идеального газа.
Уравнение состояния реальных газов должно учитывать:
-
конечное значение собственного объема молекул;
-
взаимное притяжение молекул друг к другу.
Для этого Я. Ван-дер-Ваальс предложил включить в уравнение состояния не объем сосуда, как в уравнении Клапейрона-Менделеева (pV = RT), а объем моля газа, не занятый молекулами, то есть величину (V b), где V – молярный объем. Для учета сил притяжения между молекулами Я. Ван-дер-Ваальс ввел поправку к давлению, входящему в уравнение состояния.
Внося поправки, связанные с учетом собственного объема молекул (сил отталкивания) и сил притяжения в уравнение Клапейрона-Менделеева, получим уравнение состояния моля реального газа в виде:
![]() .
.
Это уравнение Ван-дер-Ваальса, в котором постоянные а и b имеют разное значение для разных газов.
Лабораторная работа 9 Определение отношения теплоемкостей газов методом клемана - дезорма
Цель работы: определить отношение теплоемкостей газов (коэффициент Пуассона) методом Клемана – Дезорма.
Методика эксперимента
Общая схема установки представлена на рис. 3.7. Стеклянный баллон Б соединен с манометром М, измеряющим давление в сосуде. Изменение давления может осуществляться насосом Н, имеющим три рабочих положения, которые задействуются с помощью переключателя П.
У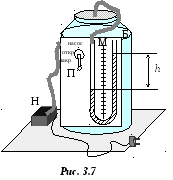 становив
переключатель П в положение насос,
накачиваем воздух до некоторого давления,
превышающего атмосферное. Через 1 – 2
минуты температура воздуха в баллоне
становится равной температуре окружающей
среды. Это состояние газа характеризуется
давлением p1,
температурой Т1
и удельным объёмом
становив
переключатель П в положение насос,
накачиваем воздух до некоторого давления,
превышающего атмосферное. Через 1 – 2
минуты температура воздуха в баллоне
становится равной температуре окружающей
среды. Это состояние газа характеризуется
давлением p1,
температурой Т1
и удельным объёмом
![]() (V
– объём баллона, m1
– масса газа, находящегося в нем).
(V
– объём баллона, m1
– масса газа, находящегося в нем).
Давление p1
определяется по формуле
![]() ,
,
где p0 – атмосферное давление; p1 – добавочное давление, измеряемое разностью уровней в манометре М.
Затем переводим
переключатель в положение Открыто
и как только уровни в манометре сравняются
в положение Закрыто.
Выход воздуха происходит очень быстро
и, пренебрегая в первом приближении
передачей тепла через стенки сосуда,
процесс расширения воздуха можно считать
адиабатическим. В сосуде устанавливается
давление p,
равное атмосферному p0.
Газ имеет удельный объём
![]() (m2
– масса газа, оставшегося в баллоне) и
температуру Т2.
(m2
– масса газа, оставшегося в баллоне) и
температуру Т2.
Для адиабатического процесса справедливо уравнение Пуассона
![]() или
или ![]() . (3.11)
напомним,
что V1
и V2
- объёмы единицы массы газа.
. (3.11)
напомним,
что V1
и V2
- объёмы единицы массы газа.
Через 1 – 2 минуты
газ нагреется до температуры окружающей
среды Т2.
Его давление в баллоне будет
![]() ,
где p2
добавочное давление, измеряемое разностью
уровней в манометре. удельный
объём останется равным V2,
так как масса и объём газа не меняются.
Сравнивая конечное состояние с начальным,
видим, что температура в этих состояниях
одинакова. Запишем для изотермического
процесса закон Бойля-Мариотта
,
где p2
добавочное давление, измеряемое разностью
уровней в манометре. удельный
объём останется равным V2,
так как масса и объём газа не меняются.
Сравнивая конечное состояние с начальным,
видим, что температура в этих состояниях
одинакова. Запишем для изотермического
процесса закон Бойля-Мариотта
![]() или
или ![]() . (3.12)
. (3.12)
Решая 1 систему уравнений (3.11) и (3.12), найдем :
![]() .
.
Добавочные давления р1 и р2 определяются по формулам:
![]() ;
; ![]() ,
где
плотность воды, h1
и h2
– разность уровней воды в коленах
манометра.
,
где
плотность воды, h1
и h2
– разность уровней воды в коленах
манометра.
Окончательно получаем расчетную формулу для нашего опыта
![]() .
(3.13)
.
(3.13)
Таким образом,
измеряя разности уровней воды в коленах
манометра h1
и h2
, можно
найти отношение теплоемкостей
![]() .
.
Примечание. При выполнении работы можно варьировать величину h1, соответственно будет изменяться и h2. Однако слишком большие значения h1 брать нельзя, так как при этом в манометре возникают колебания столбика воды большой амплитуды.
Порядок выполнения работы
-
Включить насос в сеть 220 В.
-
Поставить переключатель П в положение Насос и накачать воздух в баллон Б до разности уровней воды в коленах манометра М приблизительно 8 – 10 см (см. примечание выше).
-
Перекрыть сообщение между баллоном Б и насосом Н, поставив переключатель П в положение Закрыто.
-
Подождать 2 – 3 минуты пока разность уровней воды в коленах манометра не перестанет меняться. Измерить h1 (разность уровней воды в коленах манометра) по шкале линейки. Записать результат измерения в таблицу 3.1.
-
Поставить переключатель П в положение Открыто, как только уровни воды в коленах манометра сравняются, сразу перевести его в положение Закрыто.
-
Выждав 2 – 3 минуты (пока давление в манометре перестанет изменяться), снять отсчет h2 установившейся разности уровней воды в коленах манометра. Записать результат измерения в таблицу 3.1.
-
Повторить пункты 2 – 6 пятикратно.
Таблица 3.1
-
h1
h2
i
теор
эксп
Обработка результатов измерений
-
Рассчитать значения коэффициента Пуассона по формуле (3.13) для всех пяти измерений.
-
Вычислить теоретическое значение коэффициента Пуассона (теор) по формуле
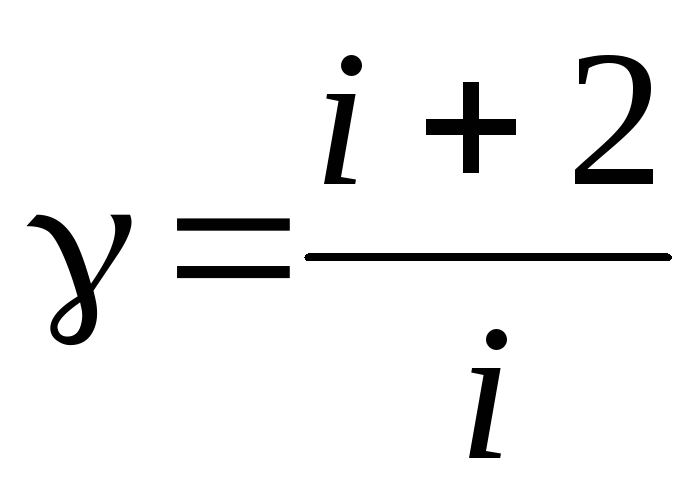 .
. -
В качестве результата эксперимента (эксп) выбрать наиболее близкое к теоретическому значению из пяти, рассчитанных в п. 1.
-
Для эксп рассчитать относительную погрешность по формуле
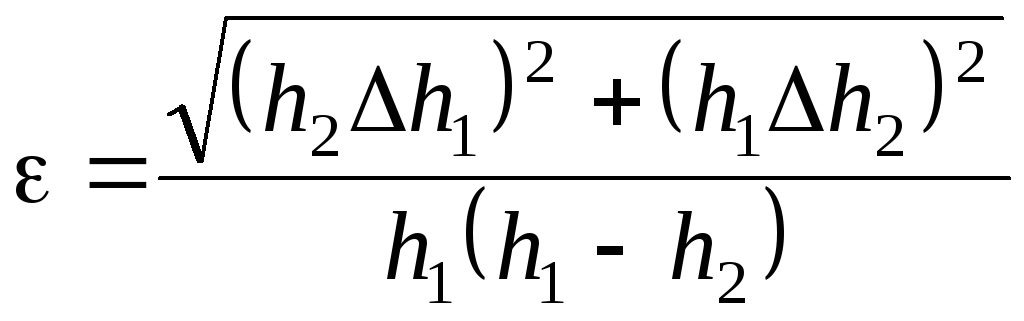 .
. -
Определить абсолютную погрешность по формуле = эксп.
-
Записать результат экспериментального определения коэффициента Пуассона = (эксп )
-
Сделать вывод по проделанной работе.
Контрольные вопросы и задания
-
Сформулируйте первое начало термодинамики.
-
Как определяется внутренняя энергия системы? Запишите выражение для внутренней энергии идеального газа.
-
Что такое число степеней свободы? Как определяется это число для одно-, двух- и трехатомных молекул?
-
Что называется удельной и молярной теплоёмкостями?
-
Какие физические величины обозначаются знаками СР и СV? Каким уравнением описывается связь между ними? Какие законы используются при выводе этого уравнения?
-
Какой процесс называется изотермическим? Изобарическим? Изохорическим? Адиабатическим? Запишите уравнения состояния для этих процессов.
-
Запишите первое начало термодинамики для всех изопроцессов и для адиабатического процесса.
