
- •В. I. Бондар
- •Введение.
- •Глава I. Химическая термодинамика.
- •1. Основные понятия и величины.
- •2. Первое начало термодинамики.
- •3. Применение первого начала к характеристике идеальных термодинамических процессов.
- •4. Вычисление работы идеальных термодинамических процессов.
- •V1 до объема v2 при различных условиях.
- •Глава II. Теплоемкость.
- •Формы выражения теплоемкости.
- •2. Теплоемкость идеального газа.
- •3. Теплоемкость твердых тел.
- •4. Правило Неймана - Коппа.
- •5. Температурная зависимость теплоемкости.
- •6. Квантовая теория теплоемкости
- •Глава III. Применение первого начала к химическим процессам.
- •Термохимия – раздел термодинамики.
- •2. Связь тепловых эффектов химических реакций при постоянном объеме (qv) и давлении (qp).
- •3. Закон Гесса.
- •4. Следствия из закона Гесса.
- •5. Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа).
- •Глава IV. Второе начало термодинамики.
- •Содержание второго начала термодинамики.
- •2. Обратимые и необратимые процессы.
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
- •Глава V. Третий закон термодинамики.
- •Недостаточность I и II законов термодинамики для расчета химического сродства.
- •2. Тепловая теорема Нернста.
- •3. Следствия из тепловой теоремы Нернста.
- •4. Расчет абсолютных значений энтропии.
- •5. Применение таблиц термодинамических функций для расчетов равновесий.
- •Глава VI. Правило фаз.
- •1. Основные понятия и определения.
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
- •VII Растворы.
- •1. Общая характеристика растворов и их классификация.
- •2. Закон Рауля.
- •3. Температура замерзания и кипения разбавленных растворов (следствия из закона Рауля).
- •4. Осмотическое давление растворов.
- •5. Закон Генри.
- •6. Закон распределения.
- •7. Парциальные молярные характеристики компонентов раствора.
- •8. Химический потенциал.
- •9. Термодинамика неидеальных растворов.
- •Глава VIII. Теория электролитов.
- •1. Растворы электролитов.
- •2. Теория электролитической диссоциации.
- •3. Сильные и слабые электролиты.
- •4. Электропроводность растворов электролитов.
- •5. Подвижность и числа переноса ионов.
- •Глава IX. Гальванические элементы.
- •1. Возникновение электродвижущих сил.
- •2. Термодинамика гальванического элемента.
- •3. Электродные потенциалы.
- •4. Классификация электродов и гальванических элементов.
- •Глава X. Кинетика гомогенных химических реакций.
- •1. Скорость химической реакции.
- •2. Молекулярность и порядок химической реакции.
- •3. Методы определения порядка химических реакций.
- •4. Сложные реакции.
- •5. Влияние температуры на скорость химических реакций. Энергия активации.
- •6. Теория активных столкновений.
- •7. Теория переходного состояния.
- •XI. Гетерогенные процессы.
- •Глава XII. Цепные реакции.
- •Глава XIII. Поверхностные явления.
9. Термодинамика неидеальных растворов.
Полученные ранее соотношения непосредственно для описания равновесий с участием реальных растворов не могут быть использованы. Построение общей теории реальных растворов невозможно ввиду их многообразия.
Простое и универсальное решение этой задачи выполнил американский физико-химик Гилберт Ньютон Льюис. Он предложил учесть отклонения в поведении реальных растворов от идеальных заменой концентрации раствора его активностью (аi). После такой замены форма записи законов сохраняется прежней и удовлетворяет опытным данным.
Основная
характеристика, описывающая поведение
любого компонента раствора - его
химический потенциал
![]() .
Для случая реального раствора:
.
Для случая реального раствора:
![]() ,
(7.47)
,
(7.47)
где
![]() - химический потенциал компонента в
стандартном состоянии.
- химический потенциал компонента в
стандартном состоянии.
Очевидно, что стандартное состояние характеризуется значением ai = 1.
Стандартное состояние выбирается в зависимости от концентрации исследуемого реального раствора и удобства измерения давления насыщенного пара в этом состоянии. Существуют следующие варианты стандартных состояний:
а) состояние чистого компонента, достигаемое экстраполяцией закона Рауля до Ni = 1;
б) гипотетическое состояние, достигаемое экстраполяцией закона Генри до Ni = 1;
в) состояние компонента в растворе с его массовым процентом, равном единице.
Расчет ai можно выполнить по нижеследующей схеме.
Если реальный раствор находится в равновесном состоянии, то:
![]() ,
,
где
![]() ,
а
,
а
![]() ,
тогда
,
тогда
![]() .
(7.48)
.
(7.48)
Для стандартного состояния, как и для любого другого, справедливо равенство:
![]() ,
,
где
![]() .
(7.49)
.
(7.49)
Равенство (7.48) с учетом (7.49) принимает вид:
![]() .
(7.50)
.
(7.50)
Для случая
концентрированных растворов (вариант
а) активность растворенного вещества
(![]() )
определяет отклонения от закона Рауля:
)
определяет отклонения от закона Рауля:
![]() ,
(7.51)
,
(7.51)
где Рi - давление насыщенного пара над реальным раствором;
![]() - давление насыщенного
пара над чистым компонентом.
- давление насыщенного
пара над чистым компонентом.
Из закона Рауля следует:
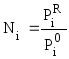 .
(7.52)
.
(7.52)
Совместное решение (7.51) и (7.52) дает:
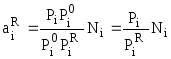 ,
,
где
![]() - коэффициент активности.
- коэффициент активности.
Окончательно:
![]() .
(7.53)
.
(7.53)
Для случая
разбавленных растворов (вариант б)
активность растворенного вещества (![]() )
устраняет отклонения от закона Генри:
)
устраняет отклонения от закона Генри:
![]() ,
(7.54)
,
(7.54)
где Г - постоянная Генри или давление насыщенного пара i-го компонента над раствором в
стандартном состоянии.
Из закона Генри следует, что:
![]() .
(7.55)
.
(7.55)
Совместное решение (7.52) и (7.53) позволяет получить соотношение:
![]() ,
,
где
![]() - коэффициент активности.
- коэффициент активности.
Тогда окончательно:
![]() .
(7.56)
.
(7.56)
Если в растворе имеет место реакция А + 2В = 3С, то закон действующих масс запишется:
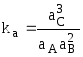 ,
(7.57)
,
(7.57)
где
![]() - константа равновесия;
- константа равновесия;
аА, аВ, аС - активности продуктов химической реакции.
Уравнение изотермы химической реакции с участием растворов приобретает следующую форму записи:
![]() ,
(7.58)
,
(7.58)
где
![]() - алгебраическая сумма логарифмов
начальных активностей реагентов.
- алгебраическая сумма логарифмов
начальных активностей реагентов.
