
- •В. I. Бондар
- •Введение.
- •Глава I. Химическая термодинамика.
- •1. Основные понятия и величины.
- •2. Первое начало термодинамики.
- •3. Применение первого начала к характеристике идеальных термодинамических процессов.
- •4. Вычисление работы идеальных термодинамических процессов.
- •V1 до объема v2 при различных условиях.
- •Глава II. Теплоемкость.
- •Формы выражения теплоемкости.
- •2. Теплоемкость идеального газа.
- •3. Теплоемкость твердых тел.
- •4. Правило Неймана - Коппа.
- •5. Температурная зависимость теплоемкости.
- •6. Квантовая теория теплоемкости
- •Глава III. Применение первого начала к химическим процессам.
- •Термохимия – раздел термодинамики.
- •2. Связь тепловых эффектов химических реакций при постоянном объеме (qv) и давлении (qp).
- •3. Закон Гесса.
- •4. Следствия из закона Гесса.
- •5. Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа).
- •Глава IV. Второе начало термодинамики.
- •Содержание второго начала термодинамики.
- •2. Обратимые и необратимые процессы.
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
- •Глава V. Третий закон термодинамики.
- •Недостаточность I и II законов термодинамики для расчета химического сродства.
- •2. Тепловая теорема Нернста.
- •3. Следствия из тепловой теоремы Нернста.
- •4. Расчет абсолютных значений энтропии.
- •5. Применение таблиц термодинамических функций для расчетов равновесий.
- •Глава VI. Правило фаз.
- •1. Основные понятия и определения.
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
- •VII Растворы.
- •1. Общая характеристика растворов и их классификация.
- •2. Закон Рауля.
- •3. Температура замерзания и кипения разбавленных растворов (следствия из закона Рауля).
- •4. Осмотическое давление растворов.
- •5. Закон Генри.
- •6. Закон распределения.
- •7. Парциальные молярные характеристики компонентов раствора.
- •8. Химический потенциал.
- •9. Термодинамика неидеальных растворов.
- •Глава VIII. Теория электролитов.
- •1. Растворы электролитов.
- •2. Теория электролитической диссоциации.
- •3. Сильные и слабые электролиты.
- •4. Электропроводность растворов электролитов.
- •5. Подвижность и числа переноса ионов.
- •Глава IX. Гальванические элементы.
- •1. Возникновение электродвижущих сил.
- •2. Термодинамика гальванического элемента.
- •3. Электродные потенциалы.
- •4. Классификация электродов и гальванических элементов.
- •Глава X. Кинетика гомогенных химических реакций.
- •1. Скорость химической реакции.
- •2. Молекулярность и порядок химической реакции.
- •3. Методы определения порядка химических реакций.
- •4. Сложные реакции.
- •5. Влияние температуры на скорость химических реакций. Энергия активации.
- •6. Теория активных столкновений.
- •7. Теория переходного состояния.
- •XI. Гетерогенные процессы.
- •Глава XII. Цепные реакции.
- •Глава XIII. Поверхностные явления.
2. Закон Рауля.
Обширные экспериментальные исследования Франсуа Мари Рауля (1886 г.) обнаружили, что в типичных случаях давление насыщенного пара растворителя над раствором (Р) равно его давлению над чистым растворителем (Р0), умноженному на мольную долю растворителя (N0) в растворе:
Р = Р0 N0. (7.1)
Из (7.1) следует, что Р < Р0, так как N0 < 1. Уменьшение давления насыщенного пара над раствором может быть объяснено уменьшением поверхности испарения при добавлении растворяемого вещества.
Закон Рауля часто применяется в другой, более удобной для практического использования форме. Для этого правая и левая часть (7.1) делится на Р0 и из обоих частей вычитается единица:
![]() ,
(7.2)
,
(7.2)
где N - молярная доля растворенного вещества.
Из выражения (7.2) следует, что относительное понижение давления насыщенного пара растворителя над раствором, равно молярной доле растворенного вещества.
На практике большинство растворов обнаруживают более или менее значительные отклонения от закона Рауля, растущие с увеличением концентрации.
Растворы, в которых поведение растворенного вещества и растворителя подчиняются закону Рауля называются абсолютно идеальными или совершенными. Для этих растворов закон Рауля справедлив для любых концентраций растворителя и растворенного вещества. Такие растворы образуют вещества с близкими физическими свойствами и, как следствие, при отсутствии взаимодействия частиц растворителя и растворенного вещества.
Например, если компоненты совершенного раствора А, В, то справедливо соотношение:
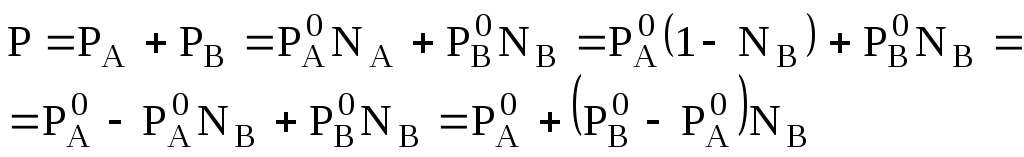 ,
(7.3)
,
(7.3)
где РА, РВ - давления насыщенных паров компонентов над раствором;
![]() ,
,
![]() - давления насыщенных паров компонентов
над чистыми компонентами;
- давления насыщенных паров компонентов
над чистыми компонентами;
NA, NB - мольные доли компонентов.
Из (7.3) следует, что давление паров над раствором (Р) линейно изменяется с изменением состава раствора.
3. Температура замерзания и кипения разбавленных растворов (следствия из закона Рауля).
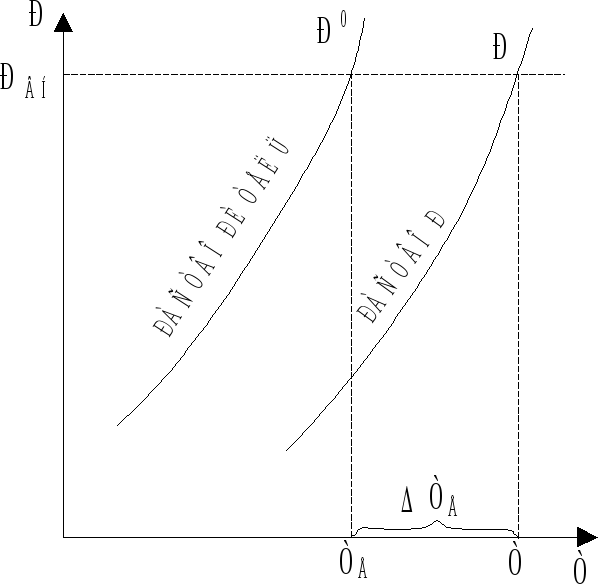
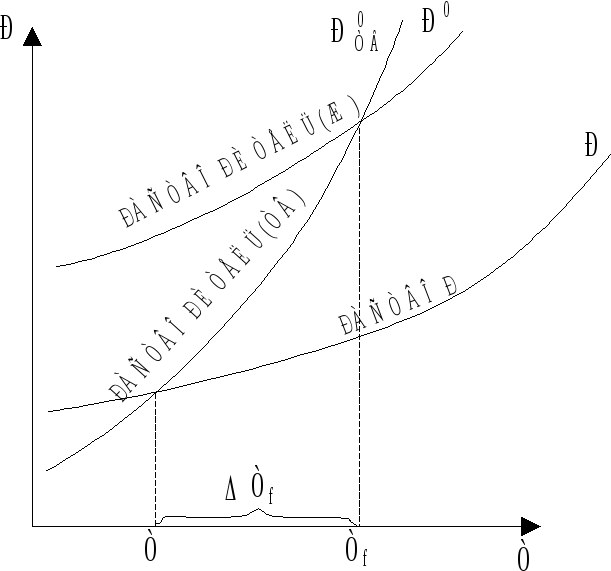
Растворы замерзают при более низкой, а закипают при более высокой температуре, чем чистый растворитель. Эти закономерности относятся только к растворам нелетучих веществ в разбавленных растворах, для которых мольная доля растворенного вещества (N) близка к нулю.
Действительно, если давление пара над раствором понижено (Р < P0), то последний нужно нагреть до более высокой температуры, чтобы достигнуть равенства давления пара над раствором и внешнего давления, обеспечивающего кипение (рис. 7.1). Из рис. 7.1 следует, что внешнее давление (РВН) достигается растворителем при температуре ТЕ, а раствором - при Т > TE, так как Р < P0.
Метод исследования, основанный на измерении повышения температуры кипения растворов, называется эбулиоскопическим [ebulliare (лат.) - выкипать], а сам эффект - эбулиоскопическим эффектом.
Условие кипения раствора:
Р = Р0 N0 = РВН, (7.4)
где РВН = 1 (условная единица).
После логарифмирования (7.4) с учетом РВН = 1:
lnР0 + lnN0 = 0,
![]() .
.
Из уравнения Клазиуса - Клапейрона следует:
![]() ,
,
поэтому
![]() ,
(7.5)
,
(7.5)
где
![]() - молярная теплота испарения растворителя.
- молярная теплота испарения растворителя.
После разделения переменных и интегрирования (7.5):
Рис. 7.1. Повышение
температуры кипения раствора:
ТЕ,
Т - температура кипения чистого
растворителя и раствора соответственно;
РВН
- внешнее давление.
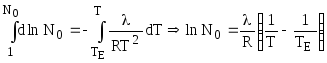
или
![]() ,
,
где
![]() .
.
Для разбавленных
растворов
![]() ,
а N << N0.
,
а N << N0.
Тогда:
![]() ,
причем точность расчета при этом не
хуже 1%, если N < 0,02.
,
причем точность расчета при этом не
хуже 1%, если N < 0,02.
Таким образом:
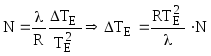 .
(7.6)
.
(7.6)
Из (7.6) очевидно, что повышение температуры кипения раствора не зависит от природы растворенного вещества, а определяется лишь его молярной долей в растворе.
Выражению (7.6) можно придать иную форму записи, если концентрацию раствора выразить в единицах его моляльности (m):
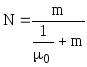 ,
(7.7)
,
(7.7)
где
![]() - молярная масса растворителя.
- молярная масса растворителя.
В разбавленном
растворе
![]() ,
поэтому N = m
,
поэтому N = m![]() и соотношение (7.6) запишется в виде:
и соотношение (7.6) запишется в виде:
![]() ,
(7.8)
,
(7.8)
где
![]() = kЭ
- эбулиоскопическая постоянная
растворителя.
= kЭ
- эбулиоскопическая постоянная
растворителя.
Тогда:
![]() .
(7.9)
.
(7.9)
Эбулиоскопическая постоянная, называемая также молярным повышением температуры кипения, представляет собой величину повышения температуры кипения раствора, содержащего 1 моль растворенного вещества в 1 кг растворителя, по сравнению с температурой кипения чистого растворителя. Каждый растворитель имеет свою эбулиоскопическую постоянную, не зависящую от природы растворенного вещества: kЭ для воды составляет 0,52 К/моль, для бензола 2,57 К/моль.
Эбулиоскопическим методом определяют молярные массы растворенных веществ, однако его используют лишь в тех случаях, когда растворенное вещество нелетучее и растворитель не диссоциирует при температуре кипения раствора.
Совершенно очевидно, что если при замерзании раствора вымораживается чистый растворитель, то условие замерзания раствора имеет вид:
![]() ,
(7.10)
,
(7.10)
где Р - давление пара растворителя над раство-
ром;
![]() - давление пара
растворителя над чис-
- давление пара
растворителя над чис-
тым твердым растворителем.
Условие замерзания чистого растворителя:
![]() .
(7.11)
.
(7.11)
Согласно уравнению Клаузиуса - Клапейрона (4.80):
Рис. 7.2. Понижение
температуры замерзания раствора:
Тf,
T - температуры замерзания растворителя
и раствора соответственно.
![]() и
и
![]()
Совместное решение этих уравнений дает:
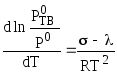 ,
(7.12)
,
(7.12)
где
![]() - молярная теплота плавления.
- молярная теплота плавления.
При температуре
замерзания раствора
![]() ,
поэтому
,
поэтому
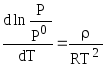 ,
где
,
где
![]() .
.
Тогда окончательно:
![]() .
(7.13)
.
(7.13)
Уравнение (7.13) называется уравнением Шредера. Его решение позволяет рассчитать понижение температуры замерзания раствора:
![]() или
или
![]() ,
(7.14)
,
(7.14)
где
![]() - криоскопическая постоянная
растворителя, зависящая как и kЭ
только от свойств рас-
- криоскопическая постоянная
растворителя, зависящая как и kЭ
только от свойств рас-
творителя.
Из (7.14) следует, что понижение температуры замерзания разбавленных растворов определяется только концентрацией растворенного вещества.
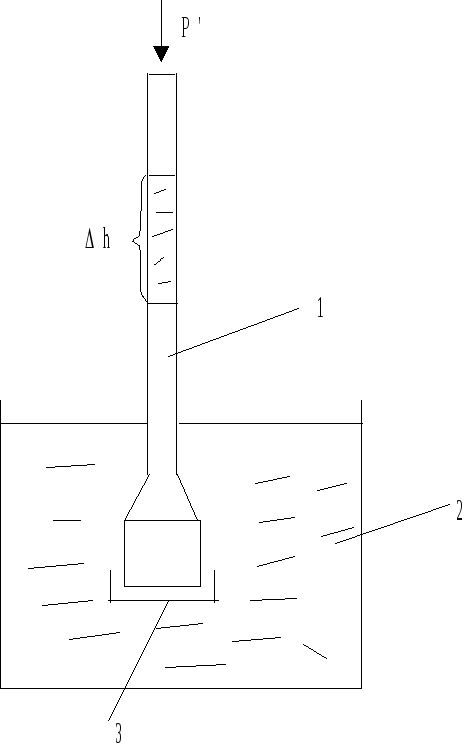 Криоскопический
метод используется как и эбулиоскопический
для определения молярных масс растворенных
веществ, однако им пользоваться удобнее,
так как для водных растворов
Криоскопический
метод используется как и эбулиоскопический
для определения молярных масс растворенных
веществ, однако им пользоваться удобнее,
так как для водных растворов
![]() в несколько раз больше kЭ,
поэтому точность оценок повышается.
Так
в несколько раз больше kЭ,
поэтому точность оценок повышается.
Так
![]() для воды составляет 1,86 К/моль, для бензола
- 5,2 К/моль. Как в том, так и в другом методе
точность опыта зависит от точности
определения
для воды составляет 1,86 К/моль, для бензола
- 5,2 К/моль. Как в том, так и в другом методе
точность опыта зависит от точности
определения
![]() .
Для повышения точности определения в
случае водных растворов пользуются
термометром Бекмана, особенностью
которого является большая длина шкалы
(0,05 м на 1 К). В верхней части термометра
имеется резервуар со ртутью, позволяющей
изменять количество ртути в рабочей
части термометра.
.
Для повышения точности определения в
случае водных растворов пользуются
термометром Бекмана, особенностью
которого является большая длина шкалы
(0,05 м на 1 К). В верхней части термометра
имеется резервуар со ртутью, позволяющей
изменять количество ртути в рабочей
части термометра.
