
- •В. I. Бондар
- •Введение.
- •Глава I. Химическая термодинамика.
- •1. Основные понятия и величины.
- •2. Первое начало термодинамики.
- •3. Применение первого начала к характеристике идеальных термодинамических процессов.
- •4. Вычисление работы идеальных термодинамических процессов.
- •V1 до объема v2 при различных условиях.
- •Глава II. Теплоемкость.
- •Формы выражения теплоемкости.
- •2. Теплоемкость идеального газа.
- •3. Теплоемкость твердых тел.
- •4. Правило Неймана - Коппа.
- •5. Температурная зависимость теплоемкости.
- •6. Квантовая теория теплоемкости
- •Глава III. Применение первого начала к химическим процессам.
- •Термохимия – раздел термодинамики.
- •2. Связь тепловых эффектов химических реакций при постоянном объеме (qv) и давлении (qp).
- •3. Закон Гесса.
- •4. Следствия из закона Гесса.
- •5. Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа).
- •Глава IV. Второе начало термодинамики.
- •Содержание второго начала термодинамики.
- •2. Обратимые и необратимые процессы.
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
- •Глава V. Третий закон термодинамики.
- •Недостаточность I и II законов термодинамики для расчета химического сродства.
- •2. Тепловая теорема Нернста.
- •3. Следствия из тепловой теоремы Нернста.
- •4. Расчет абсолютных значений энтропии.
- •5. Применение таблиц термодинамических функций для расчетов равновесий.
- •Глава VI. Правило фаз.
- •1. Основные понятия и определения.
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
- •VII Растворы.
- •1. Общая характеристика растворов и их классификация.
- •2. Закон Рауля.
- •3. Температура замерзания и кипения разбавленных растворов (следствия из закона Рауля).
- •4. Осмотическое давление растворов.
- •5. Закон Генри.
- •6. Закон распределения.
- •7. Парциальные молярные характеристики компонентов раствора.
- •8. Химический потенциал.
- •9. Термодинамика неидеальных растворов.
- •Глава VIII. Теория электролитов.
- •1. Растворы электролитов.
- •2. Теория электролитической диссоциации.
- •3. Сильные и слабые электролиты.
- •4. Электропроводность растворов электролитов.
- •5. Подвижность и числа переноса ионов.
- •Глава IX. Гальванические элементы.
- •1. Возникновение электродвижущих сил.
- •2. Термодинамика гальванического элемента.
- •3. Электродные потенциалы.
- •4. Классификация электродов и гальванических элементов.
- •Глава X. Кинетика гомогенных химических реакций.
- •1. Скорость химической реакции.
- •2. Молекулярность и порядок химической реакции.
- •3. Методы определения порядка химических реакций.
- •4. Сложные реакции.
- •5. Влияние температуры на скорость химических реакций. Энергия активации.
- •6. Теория активных столкновений.
- •7. Теория переходного состояния.
- •XI. Гетерогенные процессы.
- •Глава XII. Цепные реакции.
- •Глава XIII. Поверхностные явления.
13. Химическое равновесие. Закон действующих масс и константа равновесия.
Химические реакции в обычных условиях их протекания принадлежат к числу необратимых процессов, идущих самопроизвольно лишь в одном направлении до тех пор, пока не будет достигнуто состояние термодинамического равновесия, называемое в данном случае химическим равновесием.
Одна из важнейших задач физической химии - определение этого состояния и выяснение влияния на него внешних условий.
Обычно говорят, что все химические реакции обратимы в том смысле, что в зависимости от условий они могут протекать как в прямом, так и в обратном направлении. Эта обратимость, впервые экспериментально доказанная Сен-Клер-Девилем (1857 г.) и Н. Н. Бекетовым (1862 г.) не идентична термодинамической обратимости и их не стоит смешивать.
Определение термодинамических параметров химического равновесия тесно связано с нахождением максимальной работы реакции. Наиболее наглядный и простой путь был дан Вант-Гоффом (1883 г.).
Для большей конкретизации можно начать с частного случая реакции между газами
3Н2 + N2 = 2NH3,
взятыми с
произвольными начальными концентрациями
продуктов реакции
![]() .
.
Необходимо
заставить реакцию идти в изотермических
условиях и обратимо в термодинамическом
смысле. Это можно сделать с помощью
“ящика Вант-Гоффа”, который представляет
собой большой сосуд, наполненный смесью
трех газов в произвольных количествах,
достигнувшей состояния термодинамического
равновесия
![]() (рис.
4.5).
(рис.
4.5).
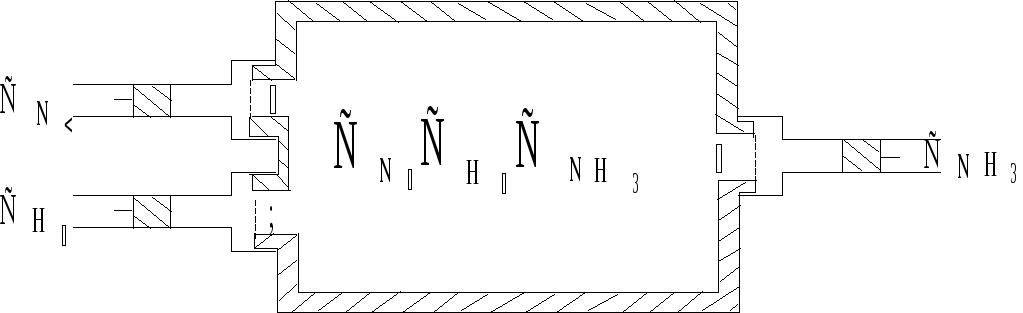
Рис. 4.6. Ящик
Вант-Гоффа.
Ящик снабжен тремя
окошками, затянутыми полупроницаемыми
перегородками 1, 2 и 3, каждая из которых
свободно пропускает только один из трех
газов. Окошки снабжены заслонками. Газы
при произвольных начальных концентрациях
![]() при Т = const находятся в трех больших
резервуарах, каждый из которых тоже
имеет окошко с заслонкой.
при Т = const находятся в трех больших
резервуарах, каждый из которых тоже
имеет окошко с заслонкой.
Рассматриваемый процесс состоит из трех следующих операций:
а) из резервуара
с водородом при его концентрации![]() выводятся
три моля водорода; их концентрация
обратимо изменяется до
выводятся
три моля водорода; их концентрация
обратимо изменяется до
![]() ,
после чего они вводятся через
полупроницаемую перегородку 1 в
равновесный ящик. При этом будет совершена
работа:
,
после чего они вводятся через
полупроницаемую перегородку 1 в
равновесный ящик. При этом будет совершена
работа:
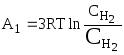 ;
;
б) та же операция
одновременно проделывается с одним
молем азота при переводе его из хранилища
с концентрацией
![]() до
до
![]() :
:
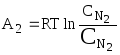 ;
;
в) те же операции,
но в обратном порядке, одновременно
проделываются с двумя молями аммиака,
при переводе их из равновесного ящика
с концентрацией
![]() в
резервуар с концентрацией
в
резервуар с концентрацией
![]() :
:
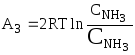 .
.
Поступая в
равновесный сосуд, водород и азот
реагируют с образованием аммиака.
Выведение последнего из равновесного
ящика с той же скоростью, с какой он
образуется, не нарушает равновесия, а
единственный результат всего процесса
(кроме переноса энергии) будет превращение
трех молей Н2
и одного моля N2
при их концентрациях
![]() и
и
![]() в два моля NH3
при концентрации
в два моля NH3
при концентрации
![]() .
Сумма всех работ равна максимальной
работе реакции, т. к. все стадии процесса
были проведены обратимо:
.
Сумма всех работ равна максимальной
работе реакции, т. к. все стадии процесса
были проведены обратимо:
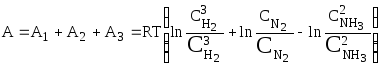
или
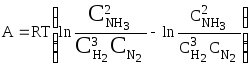 .
.
При изменении
количества газов в равновесном ящике,
состояние химического равновесия
установится вновь, но с новыми равновесными
концентрациями
![]() .
.
Повторение описанного выше процесса дает:
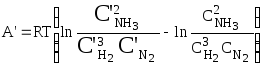 .
.
Так как оба процесса были совершены обратимо и изотермически с теми же начальными концентрациями, то А = А’ = AMAX или
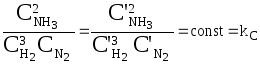 ,
,
где соотношение
равновесных концентраций kC,
называемое константой
равновесия,
есть для данной температуры величина
постоянная, не зависящая от величин
![]() каждой в отдельности. Очевидно, что оно
не зависит также от концентраций
каждой в отдельности. Очевидно, что оно
не зависит также от концентраций
![]() реагирующих
газов, т. к. состояние смеси в равновесном
ящике не связано с состоянием газов в
резервуарах.
реагирующих
газов, т. к. состояние смеси в равновесном
ящике не связано с состоянием газов в
резервуарах.
Выражение для kС, записанное выше - это математическая форма записи закона действующих масс: соотношение равновесных концентраций при Т = const есть величина постоянная и независящая от количеств реагирующих веществ.
