
- •«Влияние утф на сократимость миокарда крыс в постнатальном онтогенезе»
- •Глава 1. Обзор литературы
- •Глава 2. Организация и методы исследований
- •Глава 3. Результаты собственных исследований
- •Глава 4. Физиология сердца в школьной программе
- •Введение
- •Глава 1. Обзор литературы
- •Общие сведения об утф
- •1.1.1. Строение молекулы утф
- •1.1.2. Содержание и источники внеклеточной утф
- •1.2. Классификация пуринорецепторов
- •1.3. Структура и краткая характеристика р2-рецепторов
- •1.4. Характеристика р2у- рецепторов
- •Глава 2. Методика исследований пуринэргической регуляции на кафедре анатомии, физиологии и охраны здоровья человека тггпу 2.1. Объект исследования
- •2.2. Организация и методы экспериментов в условиях in vitro
- •2.3. Методика регистрации сократимости полосок миокарда
- •Глава 3. Результаты собственных исследований
- •3.1. Характеристика используемого блокатора
- •3.2. Результаты исследования
- •4. Физиология сердца в школьной программе
- •4.1. Обзор учебника. Тема, часы
- •4.2. Дополнительный материал по теме квалификационной работы
- •3.3. Использование материалов исследования в школе
- •Список литературы
Глава 1. Обзор литературы
-
Общие сведения об утф
1.1.1. Строение молекулы утф
Уридинтрифосфат (УТФ) - уридинтрифосфорная кислота, молекула которой состоит из азотистого основания урацила, сахара рибозы и трех остатков фосфорной кислоты.
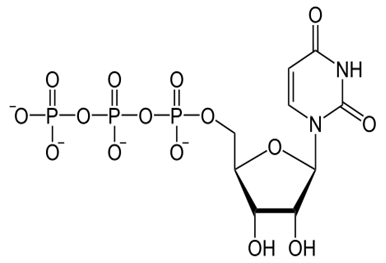
Рис. 1 Химическая структура уридин5’трифосфата
По химической структуре УТФ отличается от АТФ только азотистым основанием, вместо аденина в молекуле УТФ урацил.
УТФ участвует в биосинтезе рибонуклеиновой кислоты.
Урацил - основа пиримидина, который вместе с рибозой формирует нуклеозид уридин в клетках животных. Это - фундаментальная единица или основа нуклеиновых кислот. Когда N1 конец урацила связан с C1 концом рибозы, формируется уридин, который содержит от одной до трех фосфорических кислотных групп (Anderson, Parkinson, 1998)
В настоящее время известно, что УТФ, как и АТФ находится в везикулах вместе с основным медиатором и участвует в передаче нервных импульсов, выполняя функции котрансмиттера (Abbracchio et al., 2006)
1.1.2. Содержание и источники внеклеточной утф
На сегодняшний день метаболизм пиримидиновых нуклеотидов в сердце изучен очень мало. Концентрация этих нуклеотидов в миокарде очень низка (A. Rossi et al., 1998). Известно, что в миокарде концентрация урациловых нуклеотидов ниже по сравнению с адениновыми нуклеотидами, т.е. с АТФ. Соотношение АТФ и УТФ в сердце соответствует 1 к 16 (Vassort, 2001).
Большие затруднения связаны с количественным определением УТФ. В последнее время был найден высокочувствительный метод, позволяющий определить концентрацию УТФ, которая соответствует субнаномолярной концентрации (Lazarowski and Harder, 1999; Huang et al., 2001; Lazarowski et al., 2003a).
Наличие внеклеточной УТФ считается доказанным, так как некоторые подтипы Р2Х - и Р2Y- рецепторов активируются урациловыми нуклеотидами (Vassort, 2001). Основными источниками внеклеточной УТФ являются эпителиальные и гладкомышечные сосудистые клетки (Rossi, 1998).
Известно, что внеклеточная УТФ выделяется из сердца, кардиомиоцитов при различных физиологический условиях, таких как ишемия, гипоксия, инфаркт и аритмия сердца крыс (Yitzhaki et al., 2005, 2006)
1.2. Классификация пуринорецепторов
В 1978 году Дж. Бернсток (Burnstock) предложил первую классификацию пуринорецепторов, согласно которой он выделил Р1-пуринорецепторы, основным эндогенным лигандом которых является аденозин, поэтому Р1-пуринорецептор также называют "аденозиновый рецептор" и Р2-пуринорецепторы - соответственно АТФ (Burnstock G. 1978; Fredholm В. et al., 1996, 1997). В последующем эту классификацию углубили, расширили, дополнили, каждый из типов разделили на несколько подтипов. В настоящее время в соответствии с рекомендациями Номенклатурного Комитета Международного общества фармакологов классификация пуринорецепторов выглядит следующим образом.

Рис 2. Классификация пуринорецепторов
Таким образом, в соответствии с современной классификацией из названия рецепторов для АТФ убрали слово «пурино», поскольку было установлено, что на некоторые подтипы Р2- рецепторов оказывают влияние не только пуриновые, но и пиримидиновые нуклеотиды, например уридинтрифосфат или уридиндифосфат. В каждом из семейств Р2-рецепторов выделяют несколько подтипов, обозначаемых соответствующими цифрами, которые присваиваются лишь после того, как определена молекулярная структура рецептора и проведено его генетическое воспроизводство (клонирование). На сегодняшний день в номенклатуру рецепторов внесено 7 подтипов Р2Х рецепторов и 8 подтипов P2Y рецепторов. Различия подтипов рецепторов в основном отражаются в длине С-концевого фрагмента молекулы белка (Dunn P.M. et al., 2001).

Дж. Бернсток
В 90-х годах прошлого века была расшифрована структура основных подтипов этих рецепторов и проведено их клонирование (Khakh B.S. et al., 2001).
Рецепторы АТФ обозначаются как Р2-рецепторы. Они делятся на два семейства: Р2Х и Р2У-пуриноцепторы (М. Abbracchio; G. Burnstock, 1995). В основе классификации лежат фармакологические доказательства: тип ответа, порядок активности агонистов, разная степень десенситизации, вызываемая АТФ и ее структурными аналогами. Для Р2Х - пуринорецепторов наиболее активным агонистом является АТФ, а для Р2У - 2 - метилтиоАТФ и УТФ (А.У. Зиганшин и др., 1999). Порядок активности агонистов может зависеть от скорости их гидролиза до неактивных соединений, и значительно различаться в зависимости от вида ткани. Более четким доказательством для подразделения Р2 рецепторов на подтипы служит наличие селективных блокаторов. Сейчас известны селективные антагонисты как для Р2Х-, так и Р2У - рецепторов. Для Р2Х - рецепторов - α,β-метилен АТФ, который обладает десенситизирующим действием, пиридоксальфосфат-6-азофенил-2’,4’-дисульфоновая кислота (PPADS) и другие; для Р2У пуринорецепторов - реактив голубой 2 (А. Зиганшин и др., 1999).
В каждом из этих семейств выделяют несколько подтипов рецепторов, обозначаемых соответствующими цифрами. Эти цифры присваиваются только после определения молекулярной структуры рецепторов и их клонирования. В настоящее время описано 7 подтипов Р2Х рецепторов (Р2Х1-Р2Х7), сюда же были отнесены Р2Z рецепторы, а так же 6 подтипов Р2У рецепторов (Р2У1, Р2У2, Р2У3, Р2У4, Р2У6, Р2У11), с включением бывших Р2Т, Р2U и Р2D рецепторов (А. Зиганшин и др., 1999).
В 1986 E. Gordon предложил выделить из класса Р2 пуринорецепторов еще два подтипа Р2Т и Р2Z. Первый рецептор располагается в тромбоцитах и управляет их агрегацией. Он, в отличие от всех остальных подтипов P2 - пуринорецепторов, активируется АДФ и блокируется АТФ. Р2Z - рецепторы расположены в тучных клетках.
В 1991 S. O’Connor предложил так называемый нуклеотидный рецептор одинаково чувствительный как к АТФ, так и к УТФ, но не чувствительный к 2 – метилтиоATP и α,β-метилен АТФ. Этот рецептор получил обозначение Р2U. Возможным антагонистом данного рецептора является сурамин.
Существует еще один подтип Р2-пуринорецепторов - Р2D, преимущественными агонистами для них являются адениновые динуклеотиды. Адениновые динуклеотиды значительно более устойчивы к энзиматическому распаду, чем АТФ и поэтому их действие может проявляться дольше (А. Зиганшин и др., 1999).
В настоящее время Р2-рецепторы клонированы и экспрессированы в различных клеточных системах; известна их структура, которая отличается от аналогичных по функции рецепторов для классических нейромедиаторов.
