
- •Основы термодинамики
- •Внутренняя энергия
- •Внутренняя энергия
- •Внутренняя энергия
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Теплота и работа
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Число степеней свободы молекулы. Закон о равномерном
- •• Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные
- ••Если связь между атомами не жесткая, то добавляются колебательные степени свободы.
- ••Независимо от общего числа степеней свободы молекул 3 степени свободы всегда поступательные.
- ••Больцман установил закон, согласно которому для статистической системы (т. е. для системы у
- •Теплоемкость
- •Теплоемкость
- •Теплоемкость
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Уравнение Майера
- •Коэффициент Пуассона
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Обратимые и необратимые процессы
- •Обратимые и необратимые процессы
- •Необратимый процесс
- •Обратимые и необратимые процессы
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Тепловые двигатели
- •Тепловые двигатели
- •Тепловые двигатели
- •КПД теплового двигателя
- •КПД теплового двигателя
- •КПД теплового двигателя
- •Термодинамические циклы
- •Термодинамические циклы
- •Термодинамические циклы
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Третье начало термодинамики
- ••Нернст Вальтер Фридрих Герман (1864–1941) – немецкий физик и физико-химик, один из основоположников
- ••Согласно Нернсту, изменение энтропии S стремится к нулю при любых обратимых изотермических процессах,
- ••Нернст сформулировал теорему для изолированных систем, а затем М. Планк распространил ее на
- ••Объяснение теоремы Нернста можно дать только на основании квантово-механических представлений.
- ••Следствием третьего начала является то, что

Энтропия
•Функция состояния, дифференциалом которой является
d Q/T, называется энтропией и обозначается S. Из формулы * следует, что для обратимых процессов изменение энтропии
dS = 0 **
•В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
dS >0. ***

Энтропия
•Выражения ** и*** относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом.
•Соотношения ** и *** можно представить в виде
неравенства Клаузиуса
ΔS ≥ 0,
•т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).

Энтропия
• Cоотношение
принято называть законом возрастания энтропии.
•При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо остается неизменной, либо увеличивается.
•Таким образом, энтропия указывает направление самопроизвольно протекающих процессов.
•Рост энтропии указывает на приближение системы к состоянию термодинамического равновесия.
•В состоянии равновесия энтропия принимает максимальное значение.
•Закон возрастания энтропии можно принять в качестве еще одной формулировки второго закона термодинамики.
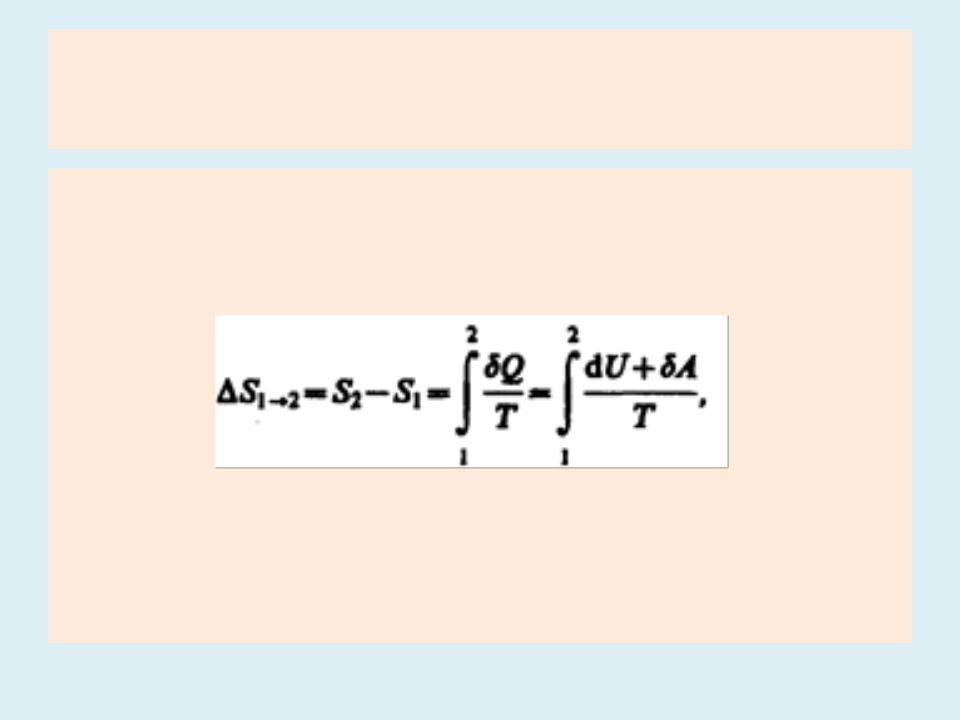
Энтропия
•Если система совершает равновесный переход из состояния 1 в состояние 2, то, изменение энтропии

Энтропия
•Более глубокий смысл энтропии вскрывается в статистической физике, энтропия связывается с термодинамической вероятностью состояния системы.
•Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы, или - число микросостояний, осуществляющих данное макро состояние (по определению, W ≥ 1, т. е. термодинамическая вероятность не есть вероятность в математическом смысле (последняя ≤1 )).
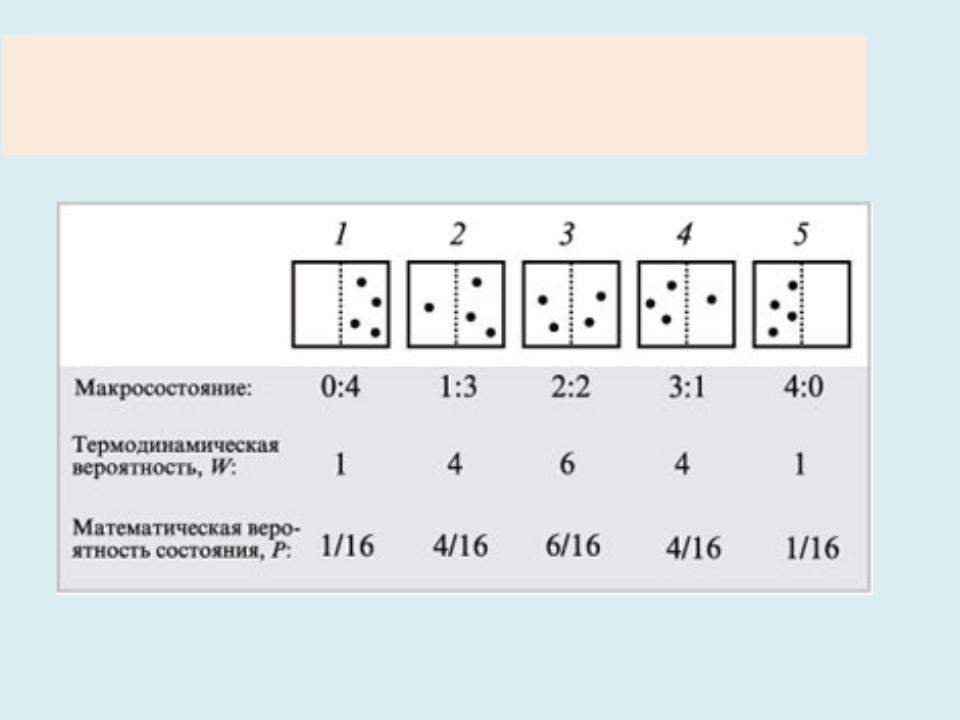
Энтропия

Энтропия
•Согласно Больцману (1872), энтропия S системы и термодинамическая вероятность связаны между собой следующим образом:
S = k lnW,
•где k — постоянная Больцмана. Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние
•. Следовательно, энтропия может рассматриваться как мера вероятности
состояния термодинамической системы.

Энтропия
•Формула Больцмана
•позволяет дать энтропии следующее
статистическое толкование: энтропия является мерой неупорядоченности системы.
•В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия.
•В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.

Энтропия
•Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии.
•При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
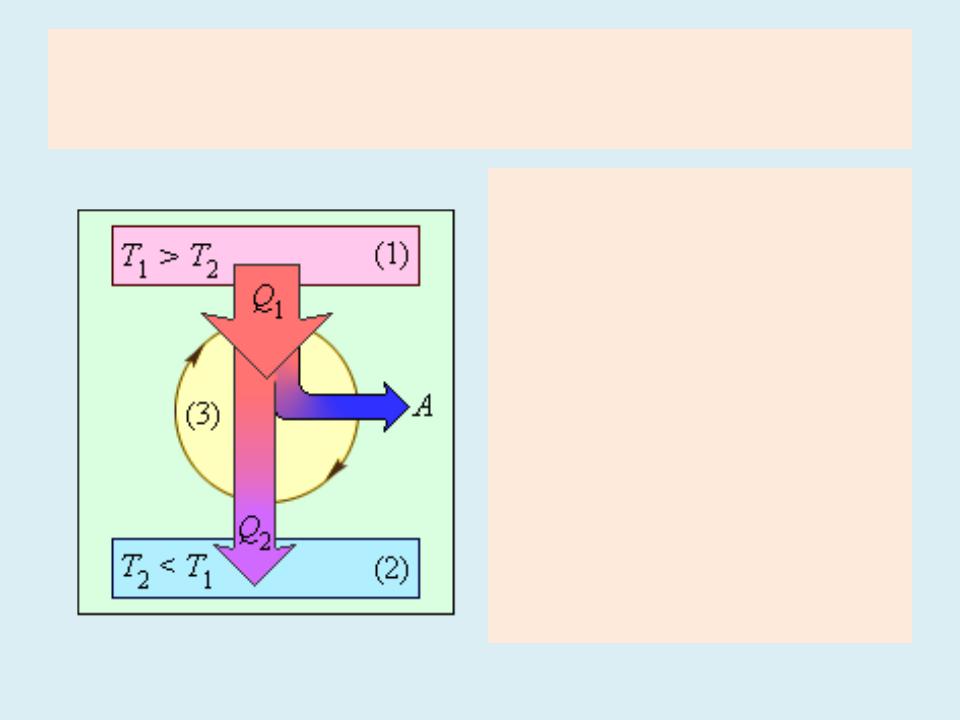
Тепловые двигатели
•Энергетическая схема тепловой машины:
•1 – нагреватель;
•2 – холодильник;
•3 – рабочее тело, совершающее круговой процесс.
•Q0;1 > 0, A > 0, Q2 <
•T1 > T2
