
- •Основы термодинамики
- •Внутренняя энергия
- •Внутренняя энергия
- •Внутренняя энергия
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Теплота и работа
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Число степеней свободы молекулы. Закон о равномерном
- •• Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные
- ••Если связь между атомами не жесткая, то добавляются колебательные степени свободы.
- ••Независимо от общего числа степеней свободы молекул 3 степени свободы всегда поступательные.
- ••Больцман установил закон, согласно которому для статистической системы (т. е. для системы у
- •Теплоемкость
- •Теплоемкость
- •Теплоемкость
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Уравнение Майера
- •Коэффициент Пуассона
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Адиабатический процесс
- •Первое начало термодинамики
- •Первое начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Круговой процесс (цикл)
- •Обратимые и необратимые процессы
- •Обратимые и необратимые процессы
- •Необратимый процесс
- •Обратимые и необратимые процессы
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Второе начало термодинамики
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Энтропия
- •Тепловые двигатели
- •Тепловые двигатели
- •Тепловые двигатели
- •КПД теплового двигателя
- •КПД теплового двигателя
- •КПД теплового двигателя
- •Термодинамические циклы
- •Термодинамические циклы
- •Термодинамические циклы
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Цикл Карно
- •Третье начало термодинамики
- ••Нернст Вальтер Фридрих Герман (1864–1941) – немецкий физик и физико-химик, один из основоположников
- ••Согласно Нернсту, изменение энтропии S стремится к нулю при любых обратимых изотермических процессах,
- ••Нернст сформулировал теорему для изолированных систем, а затем М. Планк распространил ее на
- ••Объяснение теоремы Нернста можно дать только на основании квантово-механических представлений.
- ••Следствием третьего начала является то, что

Адиабатический процесс
•Процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой (характерно для быстропротекающих процессов).
•Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает.
•Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и
сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.

Адиабатический процесс
•Из первого начала термодинамики d Q = dU + dA для адиабатического процесса следует, что
d A = – dU *
•т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
•Используя выражения для элементарной работы и приращения внутренней энергии, для произвольной массы газа перепишем уравнение (*) в виде
**

Адиабатический процесс
•Продифференцировав уравнение состояния для идеального газа , получим
***
• Исключим из (**) и (***) температуру Т:

Адиабатический процесс
•Разделив переменные и учитывая, что Cp/Cv = ϒ , найдем
Интегрируя это уравнение в пределах от р1 до р2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению
или

Адиабатический процесс
•Так как состояния 1 и 2 выбраны произвольно, то можно записать
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V или р, Т исключим из полученного уравнения с помощью уравнения Клапейрона –Менделеева
соответственно давление или объем:

Адиабатический процесс
• Получаем
•Выражения представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина ϒ = Cp/Cv = (i + 2)/ί называется показателем адиабаты (или
коэффициентом Пуассона).

Адиабатический процесс
•Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i = 3, ϒ = 1,67.
•Для двухатомных газов (Н2, N2, О2 и др.) i=5, ϒ =1,4. Значения ϒ , вычисленные по формуле (ϒ = (i + 2)/i), хорошо подтверждаются экспериментом.

Адиабатический процесс
•Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой . На рисунке видно, что адиабата (pVϒ = const) более крутая, чем изотерма (pV=const).
•Это объясняется тем, что при адиабатическом сжатии 1 - 3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры в адиабатическом процессе.

Адиабатический процесс
•Запишем уравнение первое начало термодинамик для адиабатического процесса d A = – dU в виде
•Если газ адиабатически расширяется от объема Vl до V2, то его температура уменьшается от Т1 до Т2 и работа расширения идеального газа равна
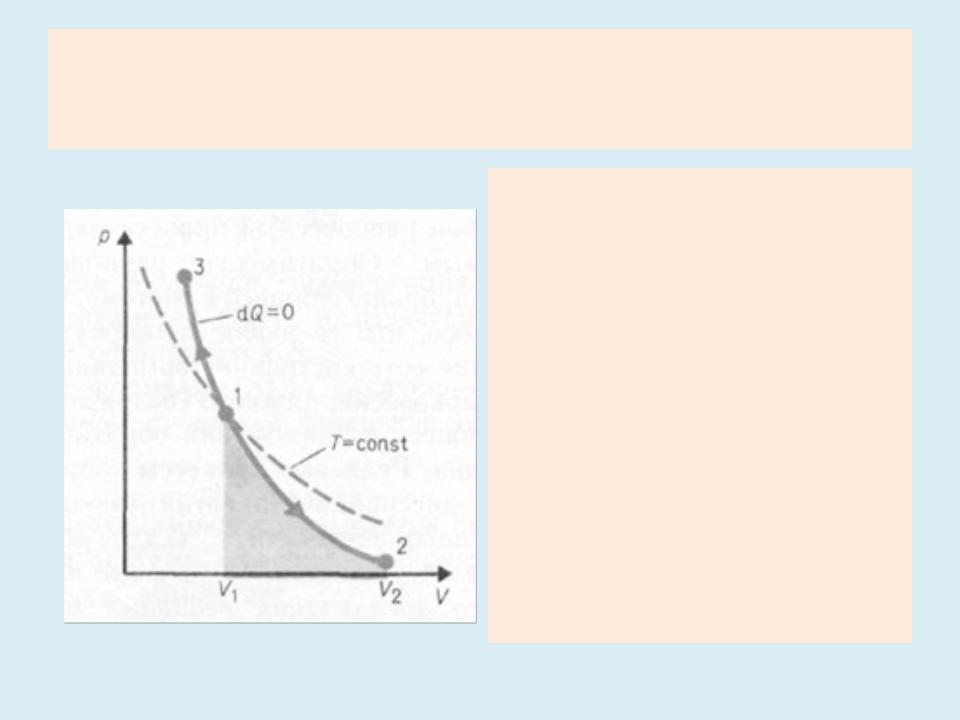
Адиабатический процесс
•Работа, совершаемая газом при адиабатическом расширении 1 – 2 (численно равная площади под кривой), меньше, чем при изотермическом процессе. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
