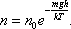- •Физические основы механики и элементы специальной теории относительности.
- •Второй закон Ньютона. Масса и сила. Импульс (количество движения) материальной точки. Импульс силы.
- •Молекулярная физика и основы термодинамики.
- •Электричество и магнетизм
- •Тема 1. Предмет классической электростатики.
- •Тема 2. Проводники в электростатическом поле.
- •Тема 3. Поляризации диэлектриков.
- •Тема 4. Энергия взаимодействия электрических зарядов.
- •Тема 5. Постоянный электрический ток.
- •Тема 8. Виток с током в магнитном ноле.
- •Тема 9. Явление электромагнитной индукции.
- •Тема 10. Уравнения Максвелла. Электромагнитные колебания и волны.
Молекулярная физика и основы термодинамики.
Опытные газовые законы. Уравнение состояния идеального газа. Абсолютная температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева – Клапейрона для изопроцессов:
а) закон Бойля – Мариотта (изотермический процесс: T=const, m=const) рV = const , или для двух состояний газаp1V1 = p2V2;
б)
закон Гей-Люссака (изобарный процесс: p
= const, m= const )
![]() , или для двух состояний
, или для двух состояний![]() ;
;
в)
закон Шарля (изохорный процесс: V=const, т
= const)
![]() , или для двух состояний
, или для двух состояний![]() ;
;
г)
объединенный газовый закон (m=const)
![]() или
или![]() , где p1, V1, T1-
давление, объем и температура газа в
начальном состоянии; p2, V2, T2-
те же величины в конечном состоянии.
, где p1, V1, T1-
давление, объем и температура газа в
начальном состоянии; p2, V2, T2-
те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов, p = p1 + p2 + .. + pп , где pi- парциальные давления компонентов смеси; n - число компонентов смеси. Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Уравнение
состояния идеального газа. Соотношение
![]() называетсяуравнением
состояния идеального газа.
Для одного моля любого
газа это соотношение принимает вид:
pV=RT.
называетсяуравнением
состояния идеального газа.
Для одного моля любого
газа это соотношение принимает вид:
pV=RT.
Абсолютная температура.Температуру, отсчитываемую по абсолютной шкале, называют абсолютной. Температуру, равную 0 К, называют абсолютным нулем.
Основное уравнение молекулярно-кинетической теории идеальных газов.
Основное
уравнение МКТ выражает
связь давления газа со средней кинетической
энергией поступательного движения
молекул.
![]()
Средняя кинетическая энергия поступательного движения молекул газа. Молекулярнокинетическое толкование температуры и давления.
Средняя кинетическая энергия поступательного движения молекулы идеального газа

Молекулярно-кинетическое толкование температуры и давления:Температура является характеристикой степени нагретости тел и определяет интенсивность хаотического теплового движения его молекул. При контакте двух тел с разной температурой происходит выравнивание температур, т.е. установление теплового равновесия. Физическое определение температуры должно основываться на физической величине, которая должна:
- характеризовать интенсивность теплового движения молекул;
- быть одинаковой у всех тел, находящихся в тепловом равновесии. При тепловом равновесии одинаковы средние кинетические энергии поступательного движения молекул газов.
Давление– это средний импульс, ежесекундно передаваемый поверхности единичной площади в результате соударений с ней молекул газа.
основное уравнение молекулярно- кинетической теории для давления газа: p = nkT .
Закон Дальтона для смеси идеальных газов.
Закон
Дальтона.Давление смеси идеальных
газов равно сумме парциальных давлений
Р, входящих в неё газов:![]()
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
Степени свободы молекул газа. Принцип равномерного распределения энергии по степеням свободы.
Степени свободы: это число независимых переменных (координат), которые полностью определяют положение системы в пространстве. В некоторых задачах молекулу одноатомного газа рассматривают как материальную точку, которой задают три степени свободы поступательного движения. При этом не учитывается энергия вращательного движения.
Закон
равномерного распределения энергии по
степеням свободы молекул:
статистически в среднем на каждую
степень свободы молекул приходится
одинаковая энергия. Поступательное
движение молекул характеризуется
средней кинетической энергией, равной ![]() .
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
.
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия![]() . В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
. В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
![]() .
.
Внутренняя энергия идеального газа.
Внутренняя
энергия идеального газа зависит только
от его температуры и не зависит от объема
![]() .
.
|
|
Молекулярно-кинетическая теория теплоёмкости газов. Уравнение МеЙера.Элементы квантовой теории теплоёмкости.
Теплоемкость газа. Теплоемкостью вещества называется количество тепла, необходимое для повышения температуры некоторого количества вещества на один градус. Из первого закона термодинамики следует , что если передача тепла какому либо телу происходит при сохранении его объема, то все передаваемое тепло идет на повышение внутренней энергии тела. В случае идеального газа, образованного из одноатомных молекул, внутренняя энергия газа соответствует средней кинетической энергии поступательного движения молекул.
Величина ![]() и
есть теплоемкость одного моля газа (при
постоянном объеме).
и
есть теплоемкость одного моля газа (при
постоянном объеме).
Теплоемкость газов не зависит от температуры.
В молекулярно-кинетической
теориигазов показывается, что
молярная теплоёмкость идеального газа
сiстепенями свободы при
постоянном объёме (для одного моля
идеального газа) равна:![]() , где μ - молярная масса. А при постоянном
давлении:
, где μ - молярная масса. А при постоянном
давлении:![]() .
.
Уравнение
Мейера.
![]() Это уравнение
Майера для
одного моля газа. Уравнение
Майера показывает, что различие
теплоёмкостей газа равно работе,
совершаемой одним молем идеального
газа при изменении его температуры на
1 K,
и разъясняет смысл универсальной газовой
постоянной R—
механический эквивалент теплоты.
Это уравнение
Майера для
одного моля газа. Уравнение
Майера показывает, что различие
теплоёмкостей газа равно работе,
совершаемой одним молем идеального
газа при изменении его температуры на
1 K,
и разъясняет смысл универсальной газовой
постоянной R—
механический эквивалент теплоты.
|
Элементы квантовой теории теплоемкости. Краткая квантовая теория теплоемкости тел Эйнштейна Эйнштейн рассматривал твердые тела как совокупность Nнезависимых частиц (гармонических осцилляторов), совершающих колебания около положений равновесия с одной и той же частотой. Средняя энергия квантового осциллятора, приходящаяся на одну степень свободы, в квантовой теории теплоемкости Эйнштейна выражается формулой
где
Молярная внутренняя энергия кристалла по Эйнштейну
где Uμ0= 3RΘE/2 - молярная нулевая энергия;R- универсальная газовая постоянная,
характеристическая температура Эйнштейна.
Тогда
молярная теплоемкость кристалла по
Эйнштейну
|
Распределение молекул газа по скоростям. Закон Максвелла, его содержание и запись. Функция распределения молекул по скоростям, смысл и графическое изображение.
Распределение молекул газа по величине скоростей называетсяраспределением Максвелла.
![]()
Бывают три скорости:
1) наиболее вероятная ,
2) средняя ,
3) средняя квадратичная .
Наименьшей из них является наиболее вероятная, а наибольшей – средняя квадратичная
Закон Максвелла, его содержание и запись:
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом определяет, какое число dNмолекул однородного (p= const) одноатомного идеального газа из общего числаNего молекул в единице объёма имеет при данной температуреТскорости, заключенные в интервале отvдоv+dv.
Функция распределения молекул по скоростям, смысл и графическое изображение:


Эта функция обозначает долю молекул единицы объёма газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость.
Характерные скорости теплового движения молекул газа: наиболее вероятная, средняя и среднеквадратичная.
С
помощью максвелловского распределения
можно вычислить такие важные характеристики
газа как средняя, среднеквадратичная
и наиболее вероятная скорость теплового
движения молекул. Средняя тепловая
скорость молекул, например, которая
представляет собой фактически
средне-арифметическую скорость,
определяется при этом формулой  .
.
Наиболее
вероятная скорость молекул, соответствующая
максимуму кривых, определена как
 .
.
Газ в силовом поле. Барометрическая формула.
Газ в силовом поле- газ, который находится под действием силы тяжести.
Барометрическая формула определяет зависимость давления или плотности газа от высоты в поле тяжести, гдер0 – давление на высоте.
Для идеального газа, имеющего постоянную температуру Tи находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного паденияgодинаково), барометрическая формула имеет следующий вид:

Закон распределения молекул в силовом поле (распределение Больцмана).
Исходя
из основного уравнения молекулярно-кинетической
теории: P = nkT, заменимPиP0в
барометрической формуле
на nиn0и получимраспределение Больцманадля молярной массы газа:
|
|
|
где n0 и n - число молекул в единичном объёме на высоте h = 0 и h.
Так
как ![]() а
а![]() ,
то можно представить в виде
,
то можно представить в виде
|
|
|
С уменьшением температуры число молекул на высотах, отличных от нуля, убывает. При T = 0 тепловое движение прекращается, все молекулы расположились бы на земной поверхности. При высоких температурах, наоборот, молекулы оказываются распределёнными по высоте почти равномерно, а плотность молекул медленно убывает с высотой. Так как mgh– это потенциальная энергия U, то на разных высотах U = mgh – различна. Следовательно, характеризует распределение частиц по значениям потенциальной энергии:
|
|
|
– это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0.
Распределение Больцманна-Максвелла.
Распределения Максвелла и Больцмана можно объединить в общее распределение Максвелла-Больцмана:
где А – нормировочная константа
Закон
Максвелла даёт распределение частиц
по значениям кинетической энергии, а
закон Больцмана – распределение частиц
по значениям потенциальной энергии.
Оба распределения можно объединить в
единый закон
Максвелла – Больцмана:
![]() .
.
|
|
. |
Число столкновений и средняя длина свободного пробега молекул газа. Эффективный диаметр молекул и его зависимость от температуры.
Число
столкновениймолекул газа:
![]()
Средняя
длина свободного пробегаравна![]() или
или![]()
средняя
длина свободного пробега![]() не
зависит от температуры газа, т.к. с ростом
температуры одновременно возрастают
и
не
зависит от температуры газа, т.к. с ростом
температуры одновременно возрастают
и![]() ,
и
,
и![]()
Эффективный диаметр молекулы определяется ее размерами и углом между направлением ее движения и осью вращения. При наложении магнитного поля на парамагнитный газ его молекулы стремятся ориентироваться своими магнитными моментами по направлению поля; при этом возникает прецессия.
Эффективный диаметр молекулы довольно трудно определить, так как он зависит от типа столкновения.
Эффективный диаметр молекулы воды примерно равен 0 27 нм
Эффективный диаметр молекул уменьшается с повышением температуры. В соответствии с этим при повышении температуры длина свободного пробега увеличивается.
Явления переноса в газах. Диффузия, внутреннее трение (вязкость) и теплопроводность.
В неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос массы, энергии, импульса.
Диффузияобусловлена переносом массы,теплопроводность– переносом энергии, авязкость– переносом импульса.
Для
характеристики необратимых процессов
переноса вводятся параметры теплового
движения молекул: среднее число соударений
молекулы в единицу времени ![]() и
средняя длина свободного пробега
молекул
и
средняя длина свободного пробега
молекул![]() .
.
1. Диффузия.Явление диффузии заключается в том, что происходит самопроизвольное взаимопроникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел. Диффузия сводится к переносу массы, возникает и продолжается до тех пор, пока на границе соприкосновения двух сред градиент плотности отличен от нуля.
Согласно
молекулярно-кинетической теории
идеального газа, коэффициент диффузии D: ,
,
где ![]() –
средняя скорость теплового движения
молекул,
–
средняя скорость теплового движения
молекул,
![]() –средняя
длина свободного пробега молекул.
–средняя
длина свободного пробега молекул.
2. Теплопроводность.Если в одной области газа температура больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, то есть процесс выравнивания температуры. Этот процесс переноса энергии, называемыйтеплопроводностью, возникает и продолжается до тех пор, пока на границе соприкосновения двух частей газа градиент температуры отличен от нуля.
Согласно
молекулярно-кинетической теории
идеального газа, коэффициент
теплопроводности![]() :
: ,
,
где ![]() –
удельная теплоемкость газа при изохорном
процессе (количество теплоты, необходимое
для изохорного нагревания 1кггаза
на 1К),
–
удельная теплоемкость газа при изохорном
процессе (количество теплоты, необходимое
для изохорного нагревания 1кггаза
на 1К),
![]() –плотность
газа,
–плотность
газа,
![]() –средняя
скорость теплового движения молекул,
–средняя
скорость теплового движения молекул,
![]() –средняя
длина свободного пробега молекул.
–средняя
длина свободного пробега молекул.
3. Вязкость. Вязкость это свойство жидкости или газа, обусловленноевнутренним трениеммежду соприкасающимися параллельными слоями жидкости или газа, движущимися с различными скоростями.
Согласно молекулярно-кинетической теории идеального газа, коэффициент динамической вязкости идеального газа hопределяется следующим образом:
 ,
,
где ![]() –
плотность газа,
–
плотность газа,
![]() –средняя
скорость теплового движения молекул,
–средняя
скорость теплового движения молекул,
![]() –средняя
длина свободного пробега молекул.
–средняя
длина свободного пробега молекул.
Зависимость коэффициентов переноса от давления и температуры.
Так
как скорость теплового движения
молекул ![]() и
не зависит от давленияР, а
коэффициент диффузииD ~ λ, то и
зависимостьDотРдолжна
быть подобна зависимости λ(Р). При
обычных давлениях и в разряженных
газах
и
не зависит от давленияР, а
коэффициент диффузииD ~ λ, то и
зависимостьDотРдолжна
быть подобна зависимости λ(Р). При
обычных давлениях и в разряженных
газах![]() ;
в высоком вакуумеD= const.
;
в высоком вакуумеD= const.
С
ростом давления λ уменьшается и
затрудняется диффузия (![]() ).
).
В
вакууме и при обычных давлениях ![]() ,
отсюда
,
отсюда![]() и
и![]() .
.
С увеличением Ри ρ, повышается число молекул, переносящих импульс из слоя в слой, но зато уменьшается расстояние свободного пробега λ. Поэтому вязкость η и теплопроводность χ, при высоких давлениях, не зависят отР(η и χ – const).
Первое начало термодинамики и его применение к изопроцессам в газе.Первое начало термодинамики : энергия неуничтожаема и несотворяема, она может только переходить из одной формы в другую в эквивалентных соотношениях.
![]()
Применение первого начала термодинамики к изопроцессам:
1. Изохорый процесс (V = const). Работа в этом процессе равна нулю. Процесс сводится к теплообмену системы с окружающей средой. Первый закон термодинамики при этом условии принимает вид:
|
Q= ΔU. |
|
Кол-во теплоты, полученное системой, если она представляет собой один моль идеального газа, равно
|
|
|
.
Если в состав системы входит ν молей идеального газа, то равенство представляется в виде:
|
|
где m – масса газа, μ – его молекулярная масса.
2. Изобарный процесс (Р = const). На основании определения теплоемкости количество теплоты Q, подведенное к системе в изобарном процессе, для одного моля идеального газа равно:
|
|
|
|
|
|
3. Изотермический процесс. При изотермическом процессе температура системы не изменяется (ΔТ = 0), а, следовательно, ее внутренняя энергия остается постоянной, то есть ее изменение ΔU = 0. Это значит, что сообщаемое системе количество теплоты идет на совершение работы.
Пользуясь уравнением изотермического процесса (PV = const), можно представить через другие параметры состояния системы:
|
|
|
где Р1 и Р2 – давление газа в начальном и конечном состояниях.
Работа расширения газа в изопроцессах (изохорном, изобарном и изотермическом).
При расширении работа, совершаемая газом, положительна.
|
|
В изохорном процессе(V = const) газ работы не совершает, A = 0.
В изобарном процессе(p = const) работа, совершаемая газом, выражается соотношением:
|
A = p (V2– V1) = pΔV. |
В изотермическом процессетемпература газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Адиабатический процесс. Формула Пуассона.
Адиабатический Процесс- процесс, происходящий без подвода и отвода тепла.
Первый закон термодинамики для адиабатического процесса принимает вид
|
|
A = –ΔU, |
|
В адиабатическом процессе газ совершает работу за счет изменения внутренней энергии. Внутренняя энергия идеального газа изменяется пропорционально его температуре. Для 1 моля одноатомного газа
|
|
|
|
Здесь ![]() –
молярная теплоемкость одноатомного
газа при постоянном объеме.
–
молярная теплоемкость одноатомного
газа при постоянном объеме.
Молярная
теплоемкость одноатомного газа при
постоянном давлении - ![]() .
.
Это
соотношение
![]() - этоуравнением
Пуассона.
- этоуравнением
Пуассона.
Работа расширения газа при адиабатическом процессе.
В адиабатическом процессе Q= 0; поэтому первый закон термодинамики принимает видA= –ΔU,
т. е. газ совершает работу за счет убыли его внутренней энергии.
Реальный газ. Потенциальная энергия системы двух взаимодействующих молекул. Потенциал Леннарда-Джонса.
Реальный газ— газ, в котором учитывается взаимодействие между молекулами..
Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
Потенциальная энергия системы двух взаимодействующих молекул зависит лишь от расстояния между ними, т.е. от абсолютной величины разности их радиус-векторов.
Если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r), то потенциал = 0.
Потенциал Леннарда-Джонсаприближенно описывает потенциал взаимодействия между двумя частицами — отталкивания на малых расстояниях и притяжения на больших. Он записывается в следующем виде:
![]()
где ![]() —
расстояние между центрами частиц,
—
расстояние между центрами частиц,![]() —
глубина потенциальной ямы,
—
глубина потенциальной ямы,![]() —
расстояние, на котором энергия
взаимодействия становится равна нулю.
Параметры
—
расстояние, на котором энергия
взаимодействия становится равна нулю.
Параметры![]() и
и![]() являются
характеристиками данного вещества.
являются
характеристиками данного вещества.
Уравнение Ван-дер-Ваальса. Физический смысл поправок Ван-дер-Ваальса.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
Где
![]() —объём,
—объём,![]() —давление,
—давление,![]() —
абсолютнаятемпература,
—
абсолютнаятемпература,![]() —универсальная
газовая постоянная.aиbпоправки.
—универсальная
газовая постоянная.aиbпоправки.
Физ. смысл поправок.
1)Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, а Vm — b, где b — объем, занимаемый самими молекулами.
2)Учет притяжения молекул.
Действие сил притяжения газа приводит
к появлению дополнительного давления
на газ, называемого внутренним давлением.
По вычислениям Ван-дер-Ваальса,
внутреннее давление обратно пропорционально
квадрату молярного объема, т. е.![]() где а
— постоянная
Ван-дер-Ваальса, характеризующая силы
межмолекулярного притяжения, Vm — молярный
объем.
где а
— постоянная
Ван-дер-Ваальса, характеризующая силы
межмолекулярного притяжения, Vm — молярный
объем.
Анализ уравнений Ван-дер-Ваальса. Изотерма Ван-дер-Ваальса. Критическое состояние вещества.
Анализ
уравнений Ван-дер-Ваальса: главное
значение уравнения Ван-дер-Ваальса
состоит, во-первых, в простоте и физической
понятности его аналитической структуры:
поправка a учитывает притяжение молекул
на больших расстояниях, поправка b – их
отталкивание на малых расстояниях.
Уравнение состояния идеального газа
получается из![]() путем предельного перехода a → 0, b → 0.
путем предельного перехода a → 0, b → 0.
Во-вторых, уравнение Ван-дер-Ваальса обладает широким спектром качественных, а в ряде случаев и полуколичественных предсказаний о поведении реального вещества.
Они следуют из анализа уравнения и вида соответствующих ему изотерм и касаются поведения вещества не только в достаточно разреженном газообразном состоянии, но и в жидком и двухфазном состояниях, т.е. в состояниях, далеких от априорной области применимости модели Ван-дер-Ваальса.
Изотерма Ван-дер-Ваальса
Это кривые зависимости р от Vm при заданных Т, определяемые уравнением
PV 3 – (RT + bP) vV 2 + av2V - abv3 = 0.
Эти кривые имеют довольно своеобразный характер.
При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой.
Критическое состояние вещества:При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление рк называются также критическими. Состояние с критическими параметрами (pк, Vк, Tк)называется критическим состоянием.
Внутренняя энергия реального газа. Эффект Джоуля-Томсона. Связь между эффектом Джоуля-Томсона и поправками уравнения Ван-дер-Ваальса.
Внутренняя энергия реального газаопределяется суммой потенциальной энергии взаимодействия молекул и кинетической энергии их движенияU=Eк+Eп.
Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие последних приводит к возникновению внутреннего давления p' на газ. Работа, затрачиваемая на преодоления сил притяжения, равна приращению энергии. Следовательно, можно записать: δA=dEп=p'dV=(a/Vm2)dVm
Проинтегрировав это уравнение, получим: Eп=-a/Vm
(постоянная интегрирования принята равной нулю). Знак минус означает, что молекулярные силы, создающие дополнительное давление, являются силами притяжения. Окончательно внутренняя энергия моля реального газа: Um=CvT-(a/Vm)
Эффект
Джоуля-Томсона:
если
сначала слева от перегородки газ под
первым поршнем
находится
под давлением р1, занимает
объем V1
при температуре Т1, а
справа газ . После прохождения газа
через пористую перегородку в правой
части газ характеризуется
параметрами р2, V2, T2. Давления p1 и p2 поддерживаются
постоянными (p1>p2).
Внешняя
работа, совершаемая газом, состоит из
положительной работы при движении
второго поршня (А2=р2V2)
и отрицательной при движении
первого (A1=p1V1), т.
е. dA=A2—A1.
Подставляя выражения для работ в формулу
![]() ,
получаем
,
получаем![]()
Таким образом, в опыте Джоуля — Томсона остается неизменной величина U+pV. Она является функцией состояния и называется энтальпией.
Ожижение газов и методы получения низких температур.
Превращение любого газа в жидкость — сжижение газа — возможно лишь при температуре ниже критической. Для сжижения газов чаще применяются два промышленных метода, в основе которых используется либо эффект Джоуля—Томсона, либо охлаждение газа при совершении им работы.
Основные способы получения низких температур:
Фазовый переход наблюдается при плавлении, кипении, испарении, сублимации.
Адиабатическое дросселирование осуществляется при прохождении вещества (жидкости или газа) через отверстие малого сечения. При этом происходит переход с высокого давления на низкое.
Адиабатическое расширение газа обеспечивает получение низких температур при любом состоянии газа, при этом выполняется полезная внешняя работа.
Вихревой эффект (эффект Ранка) достигается в вихревых трубах при подаче в них по тангенциальному вводу сжатого воздуха, имеющего температуру окружающей среды.
Термоэлектрический эффект (эффект Пельтье) наблюдается при прохождении постоянного электрического тока через цепь, состоящую из спаянных между собой двух разнородных материалов.

 ,
,