
01.Лечебное дело / Общая химия / Лекции / Лекция 05 Второе начала термодинамики и его применимость к биосистемам.
.pptx
ALMA MATER
ТРЕБУЕТ!!!
Устав ВГМУ
...
присутствие
на лекциях и
занятиях в
халате!!
!

Второе начала термодинамики и его применимость к биосистемам. Химическое равновесие
Лекция №5  Лектор:
Лектор:
кандидат химических наук, доцент
Иванова Надежда Семёновна

3




I закон термодинамики позволяет определить реакции, но не даёт ответа на вопрос о её направлении. Ответ на этот вопрос даёт II закон термодинамики, который выделяет теплоту в особый вид энергии и вводит понятие

4
Второе начало
термодинамики
Энтропия (S) мера рассеянной или обесцененной энергии.
“Теплота сама по себе не может
перейти |
от |
более холодного |
||||
тела |
к |
более |
теплому” |
|||
[Р.Клаузиус (1850)] |
|
|
|
|
||
“В природе невозможен |
||||||
процесс, единственным |
|
|
|
|
||
результатом которого была бы |
||||||
механическая работа, |
|
|
|
|
||
|
|
Рудольф Юлиус |
||||
совершенная за счет |
|
|
||||
|
|
Эмануэль Клаузиус |
||||
охлаждения теплового |
(1822-1888) |
|
||||
резервуара” [У.Томсон (1851)]

Второе начало |
5 |
||
|
|||
термодинамики |
|
||
S Q |
|
|
|
T |
S Q |
|
|
|
|
||
В самопроизвольном процессе |
T |
|
|
|
|
|
|
В равновесном процессе |
|
Q |
|
|
S T |
|
|
Для изолированной системы, где Q = 0: |
|
||
В самопроизвольном процессе |
S > 0 |
|
|
В равновесном процессе |
|
S = 0 |
|
В общем случае в изолированной системе |
|
||
S 0 |
|
|
|

6
Статистическая природа S
S = kБ
W – числоlnWразличных состояний системы, доступное ей при данных условиях, или термодинамическая вероятность макросостояния системы.
kБ = R/NА = 1,38 10-16 [эрг/град] постоянная Больцмана
В 1872 г. Л.Больцман предложил
статистическую формулировку второго закона термодинамики:
«Изолированная система эволюционирует преимущественно в направлении большей термодинамическоой вероятности»

7




Приложение 2-го начала к
биосистемам
Катаболизм в лизосоме
Лизосома
8
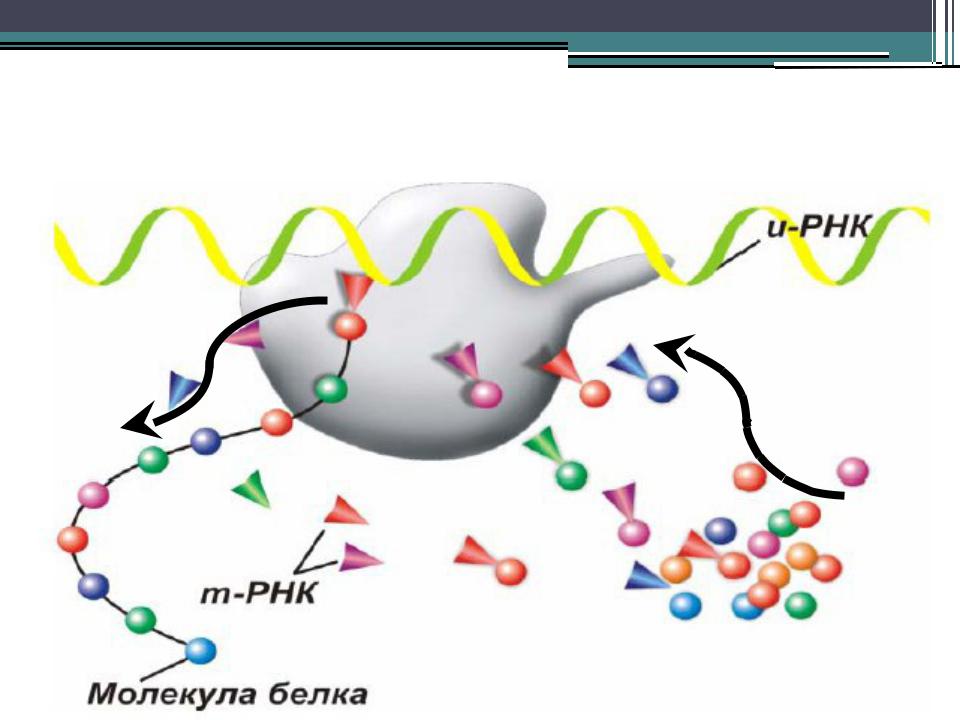
Приложение 2-го начала к биосистемам
Анаболизм на рибосоме

9
Уравнение Гиббса…
… является объединённым выражением I и II начал термодинамики.
Для данной температуры
G = H T S
При G < 0 реакция возможна; При G > 0 реакция невозможна;
Джозайя Уиллард Гиббс
При G = 0 система находится в (1839-1903) равновесии

10
Соотношение энтальпийного и энтропийного факторов
|
|
|
Возмож-ть |
Знак H |
Знак S |
Знак G |
самопроиз |
|
|
|
в. |
|
|
|
реакции |
+ |
|
+ |
|
+ |
|
|
|
|
Нет
Да
Зависит от соотношен
ия H и T S
