
Краткое содержание лекционного материала.
1.Рассмотрены основные понятия химической термодинамики: система, ее состояние, параметры и функции состояния, виды систем.


2.Предметом классической термодинамики является изучение законов о взаимных превращениях различных видов энергии, связанных с ее переходами в форме теплоты и работы. Дано определение теплоты и работы, их значения в зависимости от поглощения или выделения системой энергии.
3. Одна из формулировок первого закона термодинамики вытекает из закона сохранения энергии: энергия не исчезает бесследно и не возникает из ничего, переход ее из одного вида в другой происходит в строго эквивалентных количествах. Даны математические выражения первого закона термодинамики применительно к изолированным, закрытым и открытым системам.


4.Дано определение термохимии и термохимических уравнений. Приведено математическое выражение первого закона термодинамики применительно к изобарно-изотермическим условиям. Дано определение стандартных условий, стандартной энтальпии образования и стандартной энтальпии сгорания вещества.
5. Рассмотрены закон Гесса: «тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от промежуточных стадий процесса» …… и его следствия:
«Тепловой эффект реакции (энтальпия реaкции) равен алгебраической сумме энтальпий образования продуктов реакции за вычетом алгебраической суммы энтальпий образования исходных веществ, с учетом их стехиометрических коэффициентов» (1-е следствие),
«Тепловой эффект реакции (энтальпия реакции) равен алгебраической сумме энтальпий сгорания исходных веществ за вычетом алгебраической суммы энталъпий сгорания продуктов реакции, с учетом их стехиометрических коэффициентов» (2-еу следствие).


6. Дано понятие самопроизвольности процесса. Указаны два фактора, соответствующие самопроизвольности процесса: стремление энергии системы к минимуму и стремление системы к неупорядоченности состояния. Протекание самопроизвольных процессов сопровождается рассеиванием тепловой энергии. Указана функция состояния – энтропия, необходимая для количественной характеристики рассеивания энергии
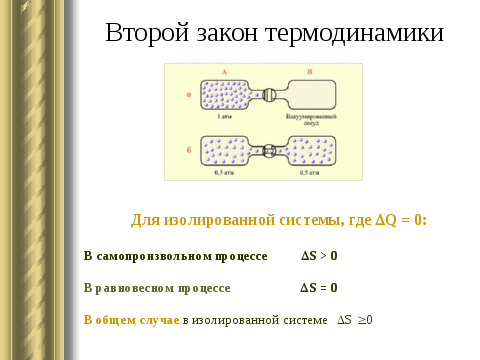
7. Дано определение энтропии – термодинамической функции, характеризующей меру неупорядоченности системы, т.е. неоднородности расположения и движения ее частиц:
S = kInW,
где k – постоянная Больцмана (k = R/NA = 1,38 . 10-23 Дж/моль . К).
Для обратимых процессов: S = Q/T. Для необратимых процессов: S Q/T. Представлена формулировка второго закона термодинамики применительно к изолированным системам: любой самопроизвольный процесс может протекать в изолированной системе лишь в том случае, когда он характеризуется увеличением энтропии: S > 0..
8. Для неизолированных систем рассмотрена термодинамическая функция, одновременно характеризующая и энергетику, и неупорядоченность системы – энергия Гиббса G или изобарно-изотермический потенциал: G = Н - ТS, где Н (энтальпийный фактор) характеризующий полное изменение энергии системы при р,Т –const и отражающий стремление системы к минимуму энергии; ТS (энтропийный фактор) – характеризующий ту часть энергии, которую нельзя превратить в работу и отражающий стремление системы к хаосу; G – часть энергии, превращающаяся в работу. На основе энергии Гиббса дана формулировка второго начала термодинамики для закрытых и открытых систем: в изобарно-изотермических условиях (p,T=const) в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы уменьшается (G < О).

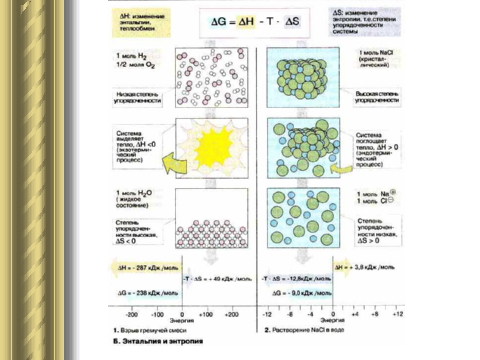
9.В соответствии со вторым законом термодинамики самопроизвольно протекают все экзэргонические реакции, для которых Gпроцесса< 0. Эндэргонические реакции (Gпроцесса> 0), сопровождающиеся увеличением энергии Гиббса, невозможны без внешнего подвода энергии. В живых системах эндэргонические реакции происходят за счет их сопряжения с экзэргоническими реакциями.


Учебные наглядные пособия
1. Электронная презентация лекции.
СТРУКТУРА
конспекта лекций
Лекция № 5
ТЕМА: Направление химических реакций. Химическое равновесие.
Основные вопросы, рассматриваемые на лекции:
1. Обратимые и необратимые химические реакции и состояние химического равновесия.
2. Закон действующих масс. Способы выражения константы химического равновесия. Взаимосвязь между константами химического равновесия: Кс, Ка, Кр.
3.Связь константы химического равновесия со стандартным изменением энергии Гиббса. Термодинамическое обоснование принципа Ле Шателье путем анализа уравнения изотермы реакции.
4. Уравнение изобары реакции. Термодинамическое обоснование принципа Ле Шателье- Брауна.
Краткое содержание лекционного материала.
-
Даны понятия обратимых и необратимых процессов, состояния химического равновесия. Указано, что химическое и биохимическое равновесное состояние системы характеризуется отсутствием изменений концентраций реагентов, постоянством энергии Гиббса (G = 0), энтальпии (Н = 0) и энтропии (S = 0).


-
Дана формулировка закона действующих масс: ”при данной температуре отношение произведения равновесных молярных концентраций (парциальных давлений) продуктов реакции к произведению равновесных молярных концентраций (парциальных давлений) исходных веществ, в степенях их стехиометрических коэффициентов, есть величина постоянная, называемая константой химического равновесия” и указаны способы выражения констант химического равновесия.


Показана взаимосвязь между константами:
Кр = Кс (RT) (c+d- а -b) = Kсn и Ка = Кс f (c+d- а -b) = Kсn , где n = c+d –а-b.
-
Показана взаимосвязь энергией Гиббса реакции и константы равновесия. Для стендартных условий: Goр-ции = -RTℓnK; для условий, отличных от стандартных:
-
Gр-ции = -RTInKс + RTInПс , (уравнение изотермы реакции), где Пс – отношение концентраций продуктов прямой реакции и реагентов (в степенях, равных стехиометрическим коэффициентам) для системы, не находящейся в состоянии равновесия. Дано термодинамическое обоснование принципа Ле Шателье путем анализа уравнения изотермы на примере реакции: FеСl3 + 3КSCN = Fе(SСN)з + 3КCl (при изменении концентраций веществ).


4. Дано термодинамическое обоснование принципа Ле Шателье путем анализа интегральной формы изобары реакции:
![]() .
.
Сделан вывод о том, при изменении температуры в системе стимулируется смещение равновесия, способствующее восстановлению первоначальной температуры, согласно общему принципу Ле Шателье: увеличение температуры вызывает смещение равновесия эндотермической реакции вправо, а экзотермической реакции – влево.

Учебные наглядные пособия
1. Электронная презентация лекции.
СТРУКТУРА
конспекта лекций
Лекция № 6
ТЕМА: Термодинамика окислительно-восстановительных реакций.
Основные вопросы, рассматриваемые на лекции:
1.Электронная теория окислительно-восстановительных реакций (Л.В.Писаржевский).
2. Окислительно-восстановительные свойства элементов и их соединений в зависимости от степени окисления элементов в соединениях. Окислительно-восстановительная двойственность.
3. Сопряженные пары окислитель – восстановитель. Стандартные окислительно-восстановительные потенциалы. Определение направления протекания ОВ реакций по разности ОВ потенциалов.
4. Влияние среды и внешних условий на направление окислительно-восстановительных реакций и характер образующихся.
5. Стандартное изменение энергии Гиббса и константа равновесия в определении направления окислительно-восстановительного процесса.
6.Роль окислительно-восстановительных процессов в фармацевтической практике.
