
Краткое содержание лекционного материала.
1. Рассмотрены: теория электролитической диссоциакции кислот и оснований Аррениуса, электронная теория Льюиса и протолитическая теория Бренстеда-Лоури.


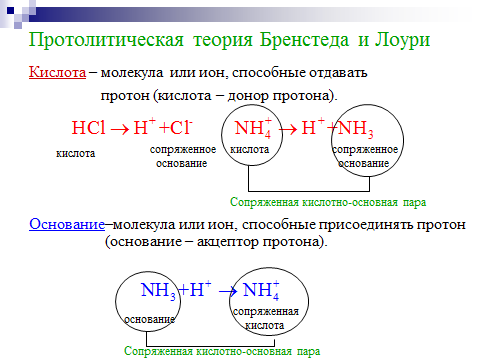

2. Приведены примеры процессов ионизации, гидролиза по катиону и аниону, нейтрализации с точки зрения теории электролитической диссоциации и протолитической теории. Показаны уравнения реакций в ионной форме. Приведены формулы для констант кислотности (Ка) и основности (Кв), являющихся количественной мерой веществ отдавать и присоединять протон. Дано понятие ионного произведения воды. Для оценки среды используется водородный показатель рН. Приведены формулы рН растворов слабых кислот, оснований, гидролизующихся солей



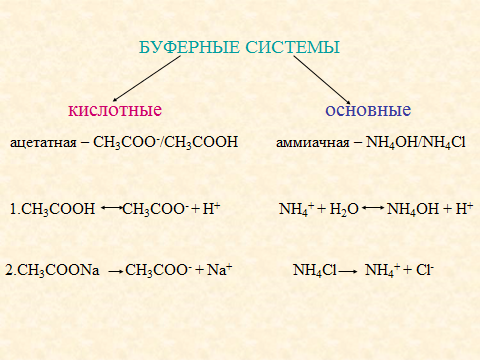
3. Дано определение протолитической буферной системы, как одной из самых распространённых, и на основании этого показана классификация буферных систем. Расчет pH буферных систем проведён по уравнению Гендерсона-Гассельбаха, которое приведено и для кислого, и для основного буфера.

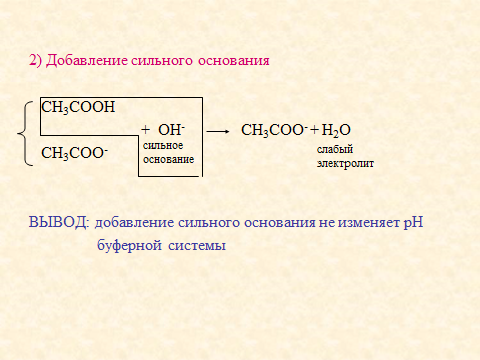
6. Дан подробный анализ уравнения, который связан с механизмом действия буферной системы: добавлением сильных протолитов и разбавлением.

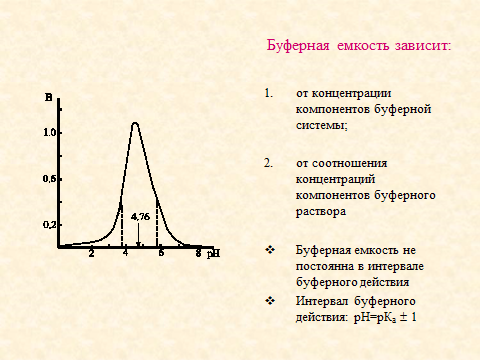
7. Обращено внимание на основные характеристики буферной системы: буферную ёмкость и зону буферного действия. Приведено уравнения для расчета буферной ёмкости и основные факторы, влияющие на неё.



8. Даны понятия: кислотно-основного равновесия; активной, потенциальной и титруемой кислотности (щелочности) биожидкостей; видов ацидозов. Приведены примеры, показывающие роль кислотно-основных взаимодействий при анализе лекарственных препаратов и приготовлении лекарственных смесей.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 9
ТЕМА: Гетерогенные равновесия в растворах слабых электролитов.
Основные вопросы, рассматриваемые на лекции:
-
Гетерогенное равновесие. Константа растворимости.
2. Условия растворения и образования осадков.
3.Гетерогенные процессы в организме. Понятие об изоморфизме.
4.Роль ионных взаимодействий в анализе лекарственных препаратов и приготовлении лекарственных смесей.
Краткое содержание лекционного материала.
1. Дано понятие гетерогенных процессов, гетерогенных равновесий, константы растворимости (или произведения растворимости). Указаны термодинамическое и кинетическое условия наступления гетерогенного равновесия. Показана взаимосвязь растворимости малорастворимого электролита и константы растворимости




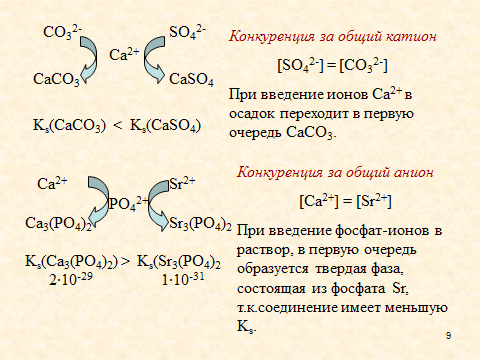
2. Рассмотрены условия смещения гетерогенного равновесия, при которых происходит образование или растворение осадка. Указаны факторы, влияющие на растворимость малорастворимых солей: введение в раствор одноименных или разноименных ионов (в том числе комплексообразующих агентов), кислотности среды.


3. Рассмотрены гетерогенные процессы в организме, связанные с образованием костной ткани, конкрементов. Приведены примеры изоморфного замещения в костной ткани ионов кальция на катионы других металлов.


4. Приведены примеры роли ионных взаимодействий в анализе лекарственных препаратов и приготовлении лекарственных смесей.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 10
ТЕМА: «Химия s- элементов».
Основные вопросы, рассматриваемые на лекции:
-
Характеристика водорода и его соединений. Химические основы применения воды и пероксида водорода в фармации.
-
Кислотно-основные и окислительно-восстановительные свойства S-элементов и их соединений.
-
Роль S-элементов в минеральном балансе организма. Жесткость воды ее влияние на живые организмы.
4. Химические основы токсического и фармакологического действия s-элементов
Краткое содержание лекционного материала.
1. Рассмотрены изотопы водорода и области их применения в медицине. Рассмотрены особенности строения и свойств атома водорода, обусловливающие его специфические свойства (окислительно-восстановительную двойственность атома, акцепторную способность протона, способность обеспечивать кислотные свойства групп Э-Н). Дана оценка кислотно-основных и окислительно-восстановительных свойств кислородных соединений водорода: воды и пероксида водорода. Приведены примеры аквакомплексов и кристаллогидратов. Рассмотрены виды воды, их получение и применение в фармации.
2. Отмечены восстановительные свойства s-элементов-металлов и основные свойства их кислородных соединений. Приведены уравнения реакций щелочных и щелочно-земельных металлов с водой и кислотами. Рассмотрены наиболее распространенные соли металлов: сульфаты, галогениды, карбонаты, фосфаты.
3. Показана биологическая роль s-элементов в минеральном балансе организма. Особую роль в минеральном балансе организма играют натрий, калий, магний и кальций. Указано их содержание в организме, физиологическая роль, способность к взаимозамещению. Дано понятие синергизма и антагонизма ионов., изоморфизма. Указано, что соединения магния и кальция обусловливают временную (гидрокарбонатную) и постоянную ( не разлагающиеся при нагревании растворимые соли магния и кальция) жесткость. Постоянное употребление жесткой воды м ожет привести к отложению солей в организме человека. Жесткость воды не только мешает дезинфекции тканей, медицинского оборудования, различным аналитическим определениям, но с ней связаны некоторые заболевания.
4. Указаны причины токсического действия s-элементов. Это, прежде всего ингибирование ферментов и способность к взаимозамещаемости. Установлено, что ингибирование уменьшается в ряду: Li+ Na+K+Cs+. Доказано, что на уровне клеточных мембран ионы лития конкурируют с ионами натрия при проникновении в клетки. Соединения бериллия токсичны из-за его способности образовывать прочные связи с биолигандами, что приводит к дезактивации ферментов. Кроме того, бериллий способен вытеснять ионы кальция из костной ткани, а поскольку фосфаты бериллия более растворимы, происходит размягчение костных тканей. Использование некоторых препаратов s-элементов в медицинской практике и фармации основано на антацидных свойствах и способности к образованию малорастворимых соединений.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 11
ТЕМА: Химия d- элементов III и IV подгрупп.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика d- элементов.
2. Общая характеристика d-элементов III группы.
3. Общая характеристика d-элементов IV группы.
Краткое содержание лекционного материала.
1. Указаны особенности свойств d-элементов: зависимость кислотно-основных свойств оксидов и гидроксидов от степени окисления; переменная степень окисления, обеспечивающая окислительно-восстановительные взаимодействия; склонность к комплексообразованию, обусловленная наличием свободных орбиталей; отсутствие резкого отличия свойств d-элементов разных периодов из-за близости радиусов атомов.
2.Отмечено, что наличие у элементов III группы лишь одного электрона в d-состоянии обусловливает малую устойчивость d1s2 конфигурации. Поэтому, в отличие от других d-элементов скандий и его аналоги проявляют постоянную степень окисления +3. Координационное число элементов подгруппы скандия равно 6, 8 и 9. Скандий по свойствам напоминает алюминий, а его аналоги по свойствам приближаются к щелочно-земельным металлам. К подгруппе скандия относят, кроме того, лантаноиды и актиноиды, которые являются аналогами d-элементов Ш группы. В частности у церия энергия двух электронов 4f –подуровня сближена с энергией 5d- подуровня, что обусловливает его сходство степеней окислений (+3) с элементами Ш группы. В отличие от названных элементов у церия есть степень окисления +4. Наличие переменных степеней окисления церия обусловливает его окислительно-восстановительные свойства, лежащие в основе цериметрического титрования для определения As3+, Fe2+, Sb3+, Sn2+, органических кислот, фенолов, аминов, аминокислот.
3. К IVв группе относятся титан, цирконий, гафний и курчатовий. Для титана и его аналогов наиболее характерна степень окисления +4, но известны также соединения Ti (III) и реже TiII). Для титана типично координационное число 56 и реже 4; для циркония и гафния более характерны высокие координационные числа 7 и 8. Титан и его аналоги относятся к тугоплавким металлам. При обычной температуре они коррозионно устойчивы на воздухе, что объясняется наличием на их поверхности защитной пленки ЭО2. Для титана и его аналогов известны галиды ЭГ4, диоксиды, дисульфаты. При взаимодействии диоксидов и гидроксидов (IV) с кислотами образуются не средние соли, а оксопроизводные. Из элементов IVв группы в медицине широко применяется титан для изготовления искусственных клапанов сердца. Соединения Ti (IV) используют в фармации для качественного определения пероксида водорода и количественного определения восстановителей.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 12
ТЕМА: Химия d- элементов V и VI подгрупп.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика d-элементов V группы.
2.Общая характеристика d-элементов VI группы.
Краткое содержание лекционного материала.
1. К Vв группе относятся ванадий, ниобий и тантал. Ванадий имеет степень окисления +2, +3, +4, +5. Для ниобия и тантала наиболее устойчива высшая степень окисления. Ванадий и его аналоги – серые тугоплавкие металлы, отличающиеся высокой стойкостью. При увеличении степени окисления ванадия и его аналогов в оксидах возрастают кислотные свойства. Из d-элементов v группы в медицине применяется тантал для крепления костей при переломах. Метаванадаты применяют в фармации для титриметрического определения лекарственных веществ (аскорбиновой и ацетилсалициловой кислот).
2. d- элементам VI гр. относятся хром, молибден, вольфрам. Характерные степени окисления +3, +6, хотя возможны и степени окисления: 0, +1, +2, +4 и +5. Для хрома более устойчивы соединения со степенью окисления +3, для молибдена и вольфрама +6. Типичные координационные числа для элементов подгруппы хрома 4 и 6. С увеличением степени окисления возрастают кислотные свойства оксидов. При переходе от хрома к молибдену уменьшается химическая активность металлов(если хром растворяется в соляной кислоте, то молибден и вольфрам только в смеси HF и HNO3. Оксид хрома (III) – химически инертен, не растворяется в воде, кислотах и щелочах. Его амфотерные свойства проявляются при сплавлении со щелочью. Cr(OH)3 растворяется в щелочах до образования [Cr(OH)6]3- и кислотах. Ионы Cr3+ образуют многочисленные комплексные соединения, свойства и цвет которых зависят от ориентации и распределения лигандов во внешней и внутренней сфере (гидратная изомерия). Ионы Cr3+ окисляются перекисью водорода до хроматов в щелочной среде (качественная реакция на ион Cr3+). Соединения Cr+6 являются сильными окислителями. В количественном анализе дихроматографическое титротвание применяют для стандартизации титрантов окислительно-восстановительных реакций.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 13
ТЕМА: Химия d- элементов VII и VIII подгрупп. Семейство железа. Семейство платины.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика d-элементов VII группы.
2. Общая характеристика d-элементов VIII группы.
Краткое содержание лекционного материала.
1. К d- элементам VII гр. относятся марганец, технеций и рений. Для марганца характерны степени окисления +2, +4, +6, +7 и координационные числа 6 и 4. Существуют соединения, в которых он проявляет степени окисления +3 и +5. С ростом степени окисления марганец усиливает кислотный характер его соединений и их окислительные свойства. MnO2 является амфотерным соединением и проявляет окислительно-восстановительную двойственность. KMnO4 используется в медицинской практике в виде 5%-ного раствора для смазывания обоженных мест и как кровеостанавливающее средство. Более слабые растворы его употребляются для полоскания рта и горла, для спринцеваний при гинекологических и урологических заболеваниях. Дезинфицирующие свойства растворов KMnO4 обусловлены его высокими окислительными свойствами, зависящими от рН среды. MnSO4 применяется для лечения атеросклероза.
2.Из d- элементов VIII гр. наибольшее значение для организма имеют элементы 4-го периода (Fe, Co, Ni). Для железа наиболее характерны степени окисления +2, +3. Встречаются также соединения со степенью окисления железа 0, +4, +6. Высшие степени окисления кобальта и никеля оказались ниже. Для кобальта наиболее типичны степени окисления +2, +3, а для никеля +2. Для всех элементов семейства железа характерны координационные числа 6 и 4. Соли железа (II) легко окисляются любыми окислителями в железо (Ш). Железо (II) легко образует различные устойчивые комплексы, например:K4[Fe(CN)6]. FeSO4. 7Н2О используется при лечении анемии, зависящей от дефицита железа в организме, а также при слабости и истощении организма. FeС13. 6Н2О (окислитель) применяется как дезинфицирующее и кровоостанавливающее средство. Железо (Ш) легко образует комплексы. Из анионных комплексов железо (Ш) особо устойчив гексацианоферрат (Ш)-ион, который является реактивом на Fe2+ ( получение турнбулевой сини).
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 14
ТЕМА: Химия d- элементов I –II подгрупп.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика d-элементов I группы.
2. Общая характеристика d-элементов II группы.
Краткое содержание лекционного материала.
1. d-элементы Iв группы (Cu, Ag, Au) являются предпоследними d-элементами, соответственно в 4, 5 и 6 периодах. Вследствие устойчивости d10 – конфигурации энергетически более выгодным оказывается переход одного из s-электронов в (n-1) d состояние. Поэтому у элементов подгруппы меди на внешнем слое 1s- электрон, а в предпоследнем слое – 10 d-электронов. Элементы подгруппы меди могут иметь координационные числа 2,4,6. Характерные степени окисления для серебра +1, для меди +2, для золота +3. Серебро и медь растворяются азотной кислоте и концентрированной серной кислоте, золото – в царской водке. Как и другие d-элементы медь и его аналоги образуют различные комплексные соединения. Кристаллогидрат CuSO4 .5H2O обладает вяжущим и прижигающим действием. Применяется в виде глазных капель при конъюктивите, а также в виде карандашей для лечения трахомы. Раствор CuSO4 употребляется как рвотное, при ожогах фосфором и как противоядие при отравлении белым фосфором. Все соли меди ядовиты.. Металлическое серебро в мелко раздробленном виде применяют в санитарной технике и медицине. Ионы серебра обладают бактерицидными свойствами и используются для дезинфекции воды. Перевязочный материал, покрытый частицами металлического серебра, применяется при лечении различных кожных заболеваний. Ляпис используется как вяжущее и прижигающее средство, применяется при лечении коньюктивитов, а также для профилактики гонореи у новорожденных. Белковые препараты коллоидного раствора (колларгол, протаргол) применяют в медицине для тех же целей, что и нитрат серебра. Коллоидное золото, ряд солей и органических соединений золота обладают бактерицидным действием. Коллоидное золото применяется для идентификации белковых веществ и выделения вирусов.
2.У атомов элементов II группы: Zn, Cd, Hg завершена d-орбиталь, поэтому они отличаются от остальных d-элементов и проявляют некоторое сходство с р-элементами. Zn, Cd, Hg - полные электронные аналоги и являются последними d-элементами (каждый в своем периоде). У элементов этой подгруппы высшая степень окисления +2. В то же время ионы цинка и его аналоги благодаря наличию d- орбиталей способны образовывать комплексные соединения. Цинк растворяется и в кислотах, и в щелочах. Кадмий в щелочах практически не растворяется, а в кислотах растворяется хуже цинка. Ртуть растворяется только в кислотах – сильных окислителях (азотной). Ртуть широко применяется в термометрах, различных барометрах, лампах дневного света. Оксид цинка в виде мазей, паст, присыпок и суспензий употребляется в качестве противовоспалительного средства при заболеваниях кожи. Препараты цинка применяются в медицине как вяжущие и дезинфицирующие средства. Йодид ртути применяется при лечении некоторых венерических заболеваний, а также в мазях для лечения заболеваний кожи. Желтый оксид ртути используют как антисептик в виде мази при лечении кожных заболеваний.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 15
ТЕМА: «Химия p- элементов III - IV подгрупп.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика р-элементов III группы.
2. Общая характеристика Р-элементов IV группы.
Краткое содержание лекционного материала.
1. В Ша группу ПСЭ входят бор, алюминий, галлий, индий и таллий. За исключением таллия для всех указанных элементов характерна степень окисления +3. С ростом порядкового номера металлические свойства элементов усиливаются (особенно резкий скачок от бора – неметалла к алюминию). От алюминия к галлию радиус атома уменьшается (d- сжатие), а энергия ионизации увеличивается. При переходе от индия к таллию происходит лишь незначительное увеличение радиуса атома (лантаноидное сжатие) и некоторое возрастание энергии ионизации. В результате таллий резко отличается от свойств других элементов группы. Наличие свободных орбиталей во внешней оболочке атомов алюминия, галлия, индия и таллия сказывается на способности этих элементов проявлять более высокие координационные числа по сравнению с бором. Из соединений IIIа группы наибольший интерес в биологии и медицине представляют соединения бора и алюминия. Ионы алюминия снижают стабильность синтеза ДНК, оказывают токсическое действие на тубулярный аппарат клеток в процессе митоза. Помимо остеоартропатия у гемодиализных больных, алюминий может вызывать нейродегенеративное поражение головного мозга. В медицине используют алюмогель и фосфалюгель как антацидные средства. Из соединений бора в медицине используется бура при начальных стадиях развития эпилепсии.
2. К р-элементам 4-й группы относятся: углерод, кремний, германий, олово и свинец. В подгруппе сверху вниз закономерно увеличивается радиус атома элемента, снижается энергия ионизации и электроотрицательность. Оксиды GeO, SnO, PbO – амфотерные. Оксиды СО2, SiO2 – кислотные, а GeO2, SnO2, PbO2 – амфотерные. В живом организме углерод, кремний, германий находятся в степени окисления +4, для олова и свинца характерна степень окисления +2. р-элементы 4-й группы могут проявлять и степень окисления -4, например в летучих гидридах ЭН4. Из наиболее известных препаратов углерода, используемых в медицине, отмечают активированный уголь, питьевая сода и все лекарственные средства органического происхождения. К токсическим веществам, кроме угарного газа, относят хлорангидрид угольной кислоты – фосген (СОС12) – отравляющее вещество удушающего действия. Никаких сведений о генотоксичных свойствах соединений кремния нет. Наоборот, частицы SiO2 in vitro и in vivo повышают противотуберкулезный иммунитет. Однако, накоплены наблюдения о том, что избыточное поступление кремния с пищей и водой отрицательно сказывается на функционировании организма (может возникнуть мочекаменная болезнь). Соединения свинца поражают в основном кроветворные органы, подавляя синтез глобина и гема, а также снижая продолжительность жизни эритроцитов. Свинец относится к тиоловым ядам, т.к. образует очень прочные комплексы с группами S-H, входящими в состав активных центров многих ферментов.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 16
ТЕМА: Химия p- элементов V- VI подгрупп.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика р-элементов V группы.
2. Общая характеристика Р-элементов VI группы.
Краткое содержание лекционного материала.
1 В группу элементов VA входят: азот, фосфор, мышьяк, сурьма, висмут. Электронная конфигурация атомов: ns2np3. Высшая степень окисления = +5. Для мышьяка одинаково характерны степени окисления +3, +5. Для сурьмы- в основном +3. Для висмута известно много соединений со степенью окисления +3. Следует отметить, что висмутсодержащие вещества немногочисленны и являются сильными окислителями. В подгруппах сверху вниз с увеличением радиуса атома происходит уменьшение энергии ионизации: Соответственно, снижается и электроотрицательность. Азот и фосфор – неметаллы. Они являются органогенами. У мышьяка и сурьмы появляются металлические свойства. Висмут – металл, хотя и с невысокой электропроводностью. Соединения мышьяка, сурьмы, висмута являются токсичными. В течение продолжительного времени применяются в фармации. Биологическая активность и токсичность этих элементов снижается в ряду: AsSb Bi. Азот – эссенциальный (жизненно необходимый) элемент для всех форм жизни. В медицине используют N2O как средство для ингаляционного наркоза и анестезии. Некоторые органические нитраты (нитроглицерин) улучшают коронарное кровообращение и применяются для профилактики ишемической болезни сердца и снятия приступов стенокардии. Фосфор в организме входит в состав фосфолипидов, ферментов. Целый ряд соединений фосфора (АТФ) используют в качестве лекарственных препаратов. Мышьяк по содержанию в организме человека (1. 10-6%) относится к микроэлементам. Он широко распространен в окружающей среде, согласно эпидемиологическим исследованиям, является канцерогеном, индуцирующим эпидермоидную карциному кожи, рак легких, печени. Токсическое действие мышьяка обусловлено блокированием сульфгидрильных групп ферментов и других биологически активных веществ. В степени окисления +5 мышьяк токсичен.
2. К р-элементам 6-й группы относятся: кислород, сера, селен, теллур и полоний. Все элементы, кроме полония, проявляют неметаллические свойства. Теллур по внешнему виду напоминает металл, но очень хрупкий. Как окислители кислород, сера, селен, теллур образуют водородные соединения, в ряду которых сверху вниз увеличивается температура кипения, снижается растворимость в воде и термическая устойчивость. Кислотные и восстановительные свойства Н2Э сверху вниз усиливаются. Кислород окисляет практически все органические вещества с выделением большого количества теплоты. Эти процессы поддерживают жизнедеятельность организма. В медицине применяют кислород 40-60% в смеси с воздухом для устранения кислородной недостаточности, которая может быть вызвана заболеваниями органов дыхания, сердечной недостаточностью, отравлением угарным газом и другими причинами. Сера – преимущественно окислитель, хотя может проявлять и восстановительные свойства. Потребление низких доз селена с пищей (150мкг/кг) снижает канцерогенные и токсические свойства мышьяка, кадмия, свинца, ртути.
Учебные наглядные пособия
1. Электронная презентация лекции
СТРУКТУРА
конспекта лекций
Лекция № 17
ТЕМА: Химия p- элементов VII и VIII подгрупп.
Основные вопросы, рассматриваемые на лекции:
1. Общая характеристика р-элементов VII группы.
2. Общая характеристика Р-элементов VIII группы.
Краткое содержание лекционного материала.
-
В группу элементов VIIA входят: фтор, хлор, бром, йод и астат (галогены). Электронная конфигурация атомов: ns2np5. Характерная валентность равна 1, в возбужденном состоянии 3, 5, 7 (кроме фтора). Степени окисления: -1, 0 (для фтора), -1, 0, +1, +3, +5, +7 (хлор, бром и йод). Положительные степени окисления хлор, бром и йод проявляют в соединения с более электроотрицательным элементом – кислородом (НХО, НХО2, НХО3, НХО4, а также более активным галогеном (СIF). В ряду HFHCIHBrHI последовательно возрастает радиус атома галогенов, уменьшается энергия связи Н-Х и прочность молекулы. В этом же направлении возрастает сила кислот и их восстановительные свойства, поэтому HI – самая сильная кислота, а I- - самый сильный восстановитель. Плавиковая кислота HF намного слабее других галогеноводородных кислот за счет водородных связей. В ряду: НCIOHCIO2HCIO3HCIO4 увеличение количества атомов более электроотрицательного кислорода приводит к ослаблению связи Н-О в кислоте и к усилению диссоциации кислот и, следовательно, к возрастанию ее силы. Окислительная активность этих кислот связана с неустойчивостью, которая возрастает к НCIО. Чем более неустойчивая кислота, тем более сильны ее окислительные свойства. В отличие от других галогенов, вступающих в реакцию диспропорционирования с водой и щелочами, фтор реагирует согласно схемам:
F2+ H2O 2HF + O(O2, O3, F2O, H2O2); 2F2 +2NaOH = F2O + 2NaF + H2O
В составе комплексных соединений галогены выполняют роль лигандов. В организме галогены взаимозамещаемы, при этом наблюдаются как случаи синергизма, так и антагонизма. Все галогены необходимы для нормального функционирования живых организмов. Фторид-ионы используют для предотвращения разрушений зубной эмали. Хлорид-ионы участвуют в поддержании осмотического гомеостаза, создают благоприятную среду для действия и активации протолитических форментов желудочного сока. Бромид-ионы усиливают тормозные процессы в нейронах головного мозга, в связи с чем бромиды калия и натрия и бромкамфора применяются в фармакологии. Йод и его соединения влияют на синтез белков, жиров и гормонов.
2. Двухэлектронное строение внешнего энергетического слоя у гелия и восьмиэлектронное строение у криптона, ксенона и радона характеризует наиболее устойчивые состояния, поэтому элементы подгруппы VIIIА – инертны при обычных условиях. Полученные соединения ксенона, криптона и радона с фтором и кислородом неустойчивы (разлагаются при комнатной температуре или гидролизуются). Инертность газов позволяет использовать их в медицине (например, для разбавления кислорода), так они не раздражают дыхательные пути, не подвергаются биотрансформации в организме и быстро выводятся в неизменном виде через легкие.
