
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тихоокеанский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
Кафедра химии
-
УТВЕРЖДЕНО
на заседании кафедры
протокол №_ от «_»________20__г
Заведующий кафедрой _____________
Иванова Н.С.
ЛЕКЦИИ
учебной дисциплины «Общая и неорганическая имия»
для специальности 060301 «Фармация»
курс ____I___семестр _I_
Составитель: Задорожная А.Н., доцент, к.х.н.
Владивосток 2012
СТРУКТУРА
конспекта лекций
Лекция № 1
ТЕМА: Предмет общей и неорганической химии, его место в программе подготовки провизора, значение для медицины и фармации. Строение вещества. Строение атома и периодический закон Д. И. Менделеева.
Основные вопросы, рассматриваемые на лекции:
1. Предмет общей и неорганической химии, его место в программе подготовки провизора, значение для медицины и фармации.
2. Основные этапы развития представлений о существовании и строении атомов. Спектры атомов как источник информации об их строении.
3. Квантово-механическая модель строения атомов.
4. Электронные формулы и электронно-структурные схемы атомов.
5.Структура периодической системы. Варианты ПСЭ.
6. Семейства s- , p-, d-, f- элементов.
7. Периодический характер изменения свойств элементов и их соединений.
8. Физический смысл периодического закона Д.И. Менделеева.
Краткое содержание лекционного материала.
1. Показана роль химии в современной медицине и фармации. Отмечено, что достижения химии активно внедряются в теорию и практику исследования функций живого организма. Поэтому особую роль приобретают знания основ по общей и неорганической химии, которые служат фундаментом при последующем изучении физиологии, аналитической и физколлоидной химии, микробиологии, фармацевтической химии.
2. Рассмотрена планетарная модель строения атома Резерфорда, базировавшаяся на открытиях самопроизвольного распада атомов, открытии ядер атомов и определении заряда электрона. Рассмотрена теория Бора, согласно которой излучение или поглощение энергии определяется переходом электрона с одной стационарной орбиты на другую Показано, что рассчитанные Бором частоты линий спектра атома водорода хорошо согласовывались с экспериментальными значениями. Отмечены недостатки теорий Резерфорда и Бора.

3
Рассмотрены основные положения
современной теории строения атома
согласно которым электрон
имеет двойственную корпускулярно-волновую
природу (уравнение де-Бройля
![]() ,
где
,
где
![]() - длина волны;
- длина волны;
![]() и
и
![]() - масса и скорость частицы;
- масса и скорость частицы;
![]() - постоянная Планка.),
для электрона невозможно одновременно
определить координату и скорость,
электрон в атоме не движется по
определенным траекториям и может
находиться в любой части околоядерного
пространства. Дано
понятие орбитали и энергетического
(электронного) уровня. Рассмотрено
уравнение Шредингера
- постоянная Планка.),
для электрона невозможно одновременно
определить координату и скорость,
электрон в атоме не движется по
определенным траекториям и может
находиться в любой части околоядерного
пространства. Дано
понятие орбитали и энергетического
(электронного) уровня. Рассмотрено
уравнение Шредингера
![]()
где
первые три члена – это сумма вторых
производных волновой функции по
координатам Х, У и Z;
![]() - масса электрона,
- масса электрона,
![]() - постоянная Планка. Указано, что три
серии решения уравнения объединяются
значениями связанных между собой
квантовых чисел:
- постоянная Планка. Указано, что три
серии решения уравнения объединяются
значениями связанных между собой
квантовых чисел:
Дана характеристика квантовых чисел: главного квантового числа (n), побочного (орбитального) квантового числа (l), магнитного квантового числа (ml), спинового квантового числа (ms).
4. Показаны правила составления электронных конфигураций атомов разных элементов с учетом принципа Паули, принципа наименьшей энергии, правил Клечковского. Показаны электронно-структурные формулы с учетом правила Гунда, позволяющие определять валентные состояния в естественном и возбужденном состоянии атомов.



5. Рассмотерна структура периодической системы элементов (группы, подгруппы, периоды). Показаны длиннопериодный и короткопериодный варианты ПСЭ. Указана информация, которую дают номера порядкового номера элементов, номера периода, группы.
6. Отмечено, что в зависимости от характера заполнения электронных уровней все элементы в периодической системе Д. И. Менделеева разделяются на четыре семейства. Элементы, у которых застраиваeтся s – орбиталь внешнего уровня, составляют s – семейство. Эти элементы входят в главные подгруппы первой и второй групп. У p-элементов застраиваются p-орбитали внешнего уровня. Р – семейство составляют элементы главных подгрупп III-VIII групп. Заполнение d – орбиталей предвнешнего уровня приводит к появлению d – семейства элементов. Это элементы побочных подгрупп всех групп. Элементы с застраивающимися f – орбиталями (лантаноиды и актиноиды) вынесены за пределы периодической системы.


7. Отмечен периодический характер изменения свойств элементов по мере увеличения заряда ядра атома. Элементы одного и того же семейства сходны по физическим и химическим свойствам. Так, для s - элементов (исключая водород, гелий, бериллий) характерны металлические свойства; для всех р – элементов, расположенных по правую сторону от диагонали бор-астат – неметаллические. Свойства d - элементов и р - элементов по левую сторону диагонали зависят от степени окисления: при 0,+1, +2 элементы проявляют металлические , при +3, +4 – металлические и неметаллические, при +5, +6, +7 – неметаллические свойства.




8. Указан физический смысл периодического закона, который заключается в том, что периодическая повторяемость химических свойств элементов обусловлена периодической повторяемостью электронных структур их атомов. Так, например, для всех щелочных металлов характерно сходное строение внешней оболочки (ns1), для группы галогенов – ns2np5.
Учебные наглядные пособия
1. Электронная презентация лекции.
2. Видеофильм «Правила техники безопасности при работе в химической лаборатории».
СТРУКТУРА
конспекта лекций
Лекция № 2
ТЕМА: Природа химической связи и строение химических соединений
Основные вопросы, рассматриваемые на лекции:
1. Типы химических связей. Физико-химические свойства соединений с ковалентной, ионной и металлической связью.
2. Особенности ковалентной связи. Описание молекулы методом валентных связей (МВС).
3. Описание молекул методом молекулярных орбиталей (ММО).
4. Межмолекулярные взаимодействия и их природа. Энергия межмолекулярного взаимодействия.
5. Водородная связь и ее разновидности. Биологическая роль водородной связи.
Краткое содержание лекционного материала.
1. Рассмотрены типы химической связи в зависимости от электроотрицательности взаимодействующих атомов. Указаны экспериментальные характеристики связей: энергия связи, длина, направленность. Рассмотрены механизмы образования и дана сравнительная характеристика ионной и ковалентной связей. Показаны физико-химические свойства соединений с ковалентной, ионной и металлической связью.
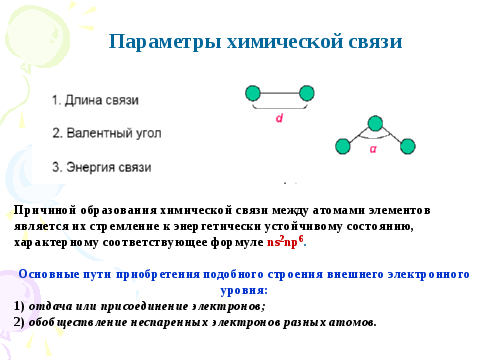

2. Указаны такие особенности ковалентной связи как насыщаемость, направленность, кратность, поляризуемость и полярность. Показана сущность метода валентных связей, согласно которому условием образования молекулы из атомов является уменьшение энергии системы. Энергия, которой будет обладать молекула, должна быть меньше суммы энергий атомов, образующих молекулу. Это условие выполняется при перекрывании валентных орбиталей, содержащих неспаренные электроны с антипараллельными спинами. При этом зона максимальной электронной плотности располагается между ядрами, что приводит к усиленному кулоновскому взаимодействию, обеспечивающему связь между атомами. Направленность ковалентной связи очень часто определяется типом гибридизации разных орбиталей одного и того атома (при sp –гибридизации - линейная, sp2 – тригональная, плоскостная, sp3-тетраэдрическая и т.д.),




3. Показано описание молекул, образованных атомами и ионами элементов 1-го и 2-го периодов методом молекулярных орбиталей. Даны энергетические диаграммы связывающих, разрыхляющих и несвязывающих молекулярных орбиталей, представлено заполнение молекулярных орбиталей электронами согласно принципу Паули и правилу Гунда. Дан расчет кратности связи в образующихся частицах..


4. Дана характеристика межмолекулярных взаимодействий: ориентационного, индукционного и дисперсионного. Указана энергия межмолекулярных взаимодействий, приведены примеры веществ с разными типами взаимодействий.
5. Проведена классификация водородной связи, показаны механизмы ее образования. На примере нуклеиновых кислот показана внутри- и межмолекулярная водородная связь, ее биологическая роль, заключающаяся в обеспечении комплементарности нуклеиновых оснований. Показано значение внутримолекулярной водородной связи для обеспечения вторичной структуры белка.


Учебные наглядные пособия
1. Электронная презентация лекции.
СТРУКТУРА
конспекта лекций
Лекция № 3
ТЕМА: Комплексные соединения. Способность к комплексообразованию.
Основные вопросы, рассматриваемые на лекции:
1.Структура комплексных соединений.
2. Природа химической связи в комплексных соединениях (теория Вернера, метод валентных связей).
3. Способность атомов различных элементов к комплексообразованию.
4. Классификация и номенклатура комплексных соединений.
5. Биологическая роль комплексных соединений.
6. Химические основы применения комплексных соединений в фармации и медицине.
Краткое содержание лекционного материала.
1. Дано определение комплексных соединений как веществ, содержащих центральный атом – комплексообразователь, с которым в неионогенной связи находится определенное количество атомов или молекул – лигандов. В таких соединениях образуются сложные частицы, способные к свободному существованию как в кристаллической решетке, так и в растворе. В состав комплексных ионов входит центральный атом – комплексообразователь (в данном случае – Fe+3 и Co+3) и лиганды (CN- и NH3).

2. Указано, что согласно методу валентных связей химические связи, возникающие между комплексообразователем и лигандами, имеют донорно-акцепторное происхождение, т.е. образуются за счет неподеленной пары электронов одного из атомов (чаще, лигандов) и свободных орбиталей другого атома (чаще, комплексообразователя).


3. Сделан вывод о том, что типичными комплексообразователями являются d- элементы, у которых орбитали внешнего и предвнешнего слоя заполнены не полностью. Гораздо слабее выражена склонность к комплексообразованию у s- элементов. Особенностью р- элементов является участие в образовании комплексных соединений как в качестве лигандов, за счет неподеленных пар электронов, так и в качестве комплексообразователей за счет свободных орбиталей атомов некоторых элементов.
4. Указано, что классификация комплексных соединений проводится:
- в зависимости от знака заряда комплексного иона;

- в зависимости от природы лиганда;

- в зависимости от внутренней структуры.

Представлены основы номенклатуры комплексных соединений, разработанные А. Вернером.
5. Приведены примеры высокопрочных биологических комплексов (гемоглобин, хлорофилл, некоторые металлоферменты) и биокомплексов с невысокими значениями констант устойчивости (металлополинуклеотидные комплексы, стабилизирующие двойную спираль ДНК).
6. Приведены примеры комплексных соединений, используемых в фармацевтической практике при испытании на подлинность препаратов.
Учебные наглядные пособия
1. Электронная презентация лекции.
СТРУКТУРА
конспекта лекций
Лекция № 4
ТЕМА: Энергетика химических реакций. Закон Гесса.
Основные вопросы, рассматриваемые на лекции:
-
Основные понятия химической термодинамики.
-
Изменение энергии при химических превращениях. Теплота и работа.
-
Формулировки и математические выражения первого начала термодинамики для изолированных, закрытых и открытых систем.
-
Теплоты химических реакций при постоянной температуре и давлении. Термохимические уравнения. Стандартные энтальпии образования и сгорания веществ.
-
Закон Гесса и его следствия.
-
Понятие о самопроизвольности процесса.
7. Энтропия – мера неупорядоченности расположения и движения частиц. Уравнение Больцмана. Формулировка и математическое выражение второго начала термодинамики для изолированных систем.
8.Энергия Гиббса как критерий самопроизвольного протекания процесса и термодинамической устойчивости соединений.
9. Экзо- и эндоэргонические реакции. Энергетическое сопряжение биохимических реакций.
