
- •Растворы. Термодинамика процесса растворения.
- •Раствор – однофазная система переменного состава, состоящая из двух и более компонентов.
- •Истинные растворы
- •Процесс растворения
- •Процесс растворения
- •1. Тепловые явления
- •Процесс растворения
- •Разрушение структуры исходного вещества
- •Термодинамика процесса растворения
- •Растворимость
- ••Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при данной температуре, к
- •Влияние температуры
- •Растворимость газов
- •Растворимость газов
- •Растворимость газов
- •Свойства растворов
- •Осмотическое давление -
- •Уравнение Вант-Гоффа для реальных растворов:
- •Значение осмоса
- •Гемолиз – явление набухания и разрыва клеток эритроцитов в гипотоническом растворе. Идет осмос
- •Спасибо за внимание !

•Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя.
Ks=m(в-ва)/m(р-ра)
S=(m(в-ва)/m(р-ля))∙1000
Растворимость зависит:
1.Природы растворяемого вещества и растворителя
2.Температуры
3.Давления
4.Присутствия в растворе других веществ
11
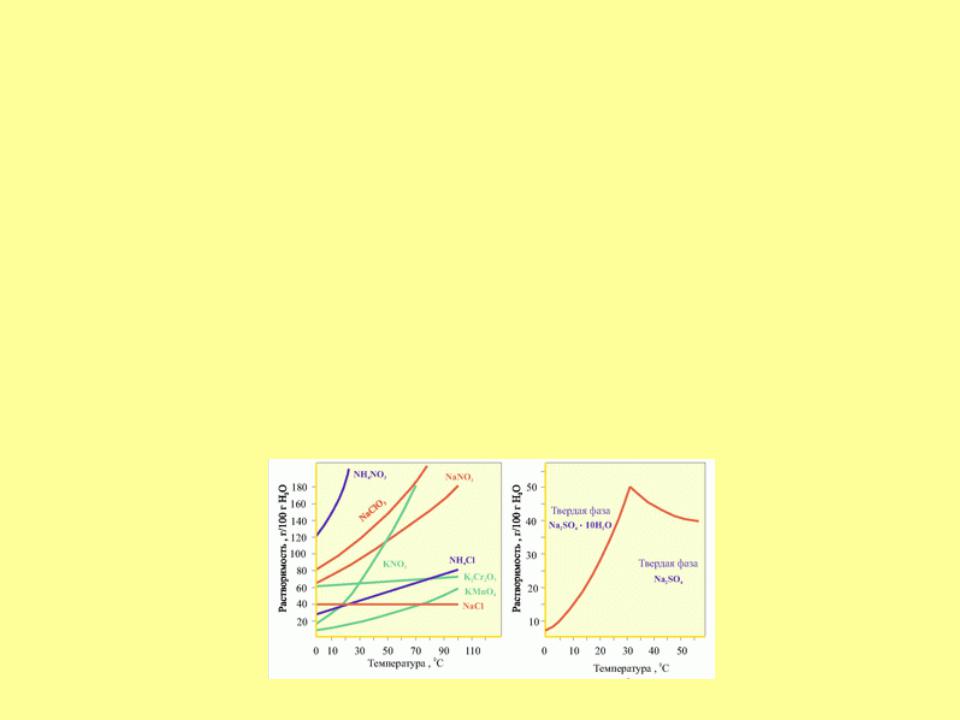
Влияние температуры
•∆H>0, повышение температуры приводит к увеличению растворимости – эндотермический процесс.
(∆Hразр.кр.реш>∆Hгидр);
•∆H<0, с ростом температуры растворимость понижается – экзотермический процесс.
(∆Hразр.кр.реш<∆Hгидр).
12

Растворимость газов
Влияние давления
Закон Генри:
«При постоянной температуре растворимость газов в жидкости прямо-пропорциональна его давлению над жидкостью»
C(x)=Kг(x)·Р(x)
C(x) – концентрация газа в насыщенном растворе, моль/л;
Kг(x) – постоянная Генри для газа Х, моль∙л-1∙Па-1;
Р(х) – давление газа над раствором, Па.
13

Растворимость газов
Закон Дальтона:
«растворимость каждого компонента газовой смеси при постоянной температуре пропорциональна постоянному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов»
Pi=Pобщ.·X(Xi)
Pi - парциальное давление компонента i;
Pобщ. – общее давление над раствором;
X(Xi) – молярная доля i компонента.
14

Растворимость газов
Закон Сеченова:
«Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание газов»
15

Свойства растворов
Коллигативные свойства растворов – свойства, не зависящие от природы частиц растворенного вещества, а зависящие только от концентрации частиц в растворе.
Осмос – преимущественно одностороннее проникновение молекул растворителя (диффузию) через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией.
16

Осмотическое давление -
….величина, измеряемая минимальным гидравлическим давлением, которое можно приложить к раствору, чтобы осмос прекратился.
Уравнение Вант-Гоффа для идеальных растворов:
π =cRT
c – молярная концентрация вещества в растворе, моль/л. 17

Уравнение Вант-Гоффа для реальных растворов:
π=icRT
i > 1, для электролитов;
i = 1, для неэлектролитов;
i < 1, для веществ склонных к ассоциации;
i = 1+α(m-1)
m – число ионов, на которые распадается молекула электролита.
18

Значение осмоса
•упругость, тургор клеток
•эластичность тканей, форма органов
•усвоение пищи, образование лимфы, мочи, кала
•действие лекарств
•За счет осмоса вода в организме распределяется между кровью, тканями, клетками.
19

20
