
- •Курсовая работа
- •Оглавление
- •Введение
- •1.Механизм реакции Хека.
- •2. Синтетические возможности реакции Хека.
- •3. Модификации реакции Хека.
- •3.1. Катализаторы фазового переноса в реакции Хека
- •3.2. Использование трифлатов (псевдогалогенидов) в реакции Хека
- •4.Экспериментальная часть
- •4.1.Синтез Коричной кислоты (реакция Хека)
- •4.1.2. Реактивы:
- •4.1.2.1.Лабораторная посуда и оборудование
- •4.1.3.1.Примечания
- •4.1.3.2.Утилизация отходов
- •4.2.Обсуждение
- •5.Список литературы
3. Модификации реакции Хека.
3.1. Катализаторы фазового переноса в реакции Хека
Довольно неожиданно оказалось, что относительно жесткие условия реакции Хека, которые требовались первоначально, удается значительно смягчить, если проводить реакцию в присутствии тетрабутиламмониевых солей. В такой модификации в некоторых случаях сочетание проходит даже при комнатной температуре (уравнение 1, схема 5.9). Предполагается, что наблюдаемое ускорение реакции обусловлено тем, что тетрабутиламмониевые соли существенно облегчают протекание завершающей стадии каталитического цикла, т. е. регенерацию нуль- валентного палладия.
Использование
модифицированных условий проведения
реакции Хека позволило, в частности, с
хорошим выходом реализовать конденсацию
винильного циклофанового тетрабромида
с четырьмя молекулами стирола (схема
5.9, уравнение 2). Интересно, что полученный
аддукт далее может претерпевать
6л-электроциклизацию, сопровождаемую
окислительной ароматизацией, что
приводит к образованию бензо-аннелированного
аддукта, содержащего восемь бензольных
циклов.

3.2. Использование трифлатов (псевдогалогенидов) в реакции Хека
Границы применимости рассматриваемой реакции кросс-соне та ни я удалось существенно расширить благодаря обнаруженной возможности использования винилтрифлатов в качестве реагентов винилирования вместо традиционных винилгалогенидов. Поскольку винилтрифлаты достаточно легко могут быть получены из различных кетонов, последние могут рассматриваться как почти универсальные эквиваленты реагентов винилирования алкенов или аренов по Хеку. При этом особенно важно, что, благодаря наличию хорошо разработанных методов получения ено - лятов, из одного и того же кетона несимметричного строения можно получать оба региоизомерных енолтрифлата, а из них — изомерные диены, как это показано в уравнениях I и 2 (схема 5.10).
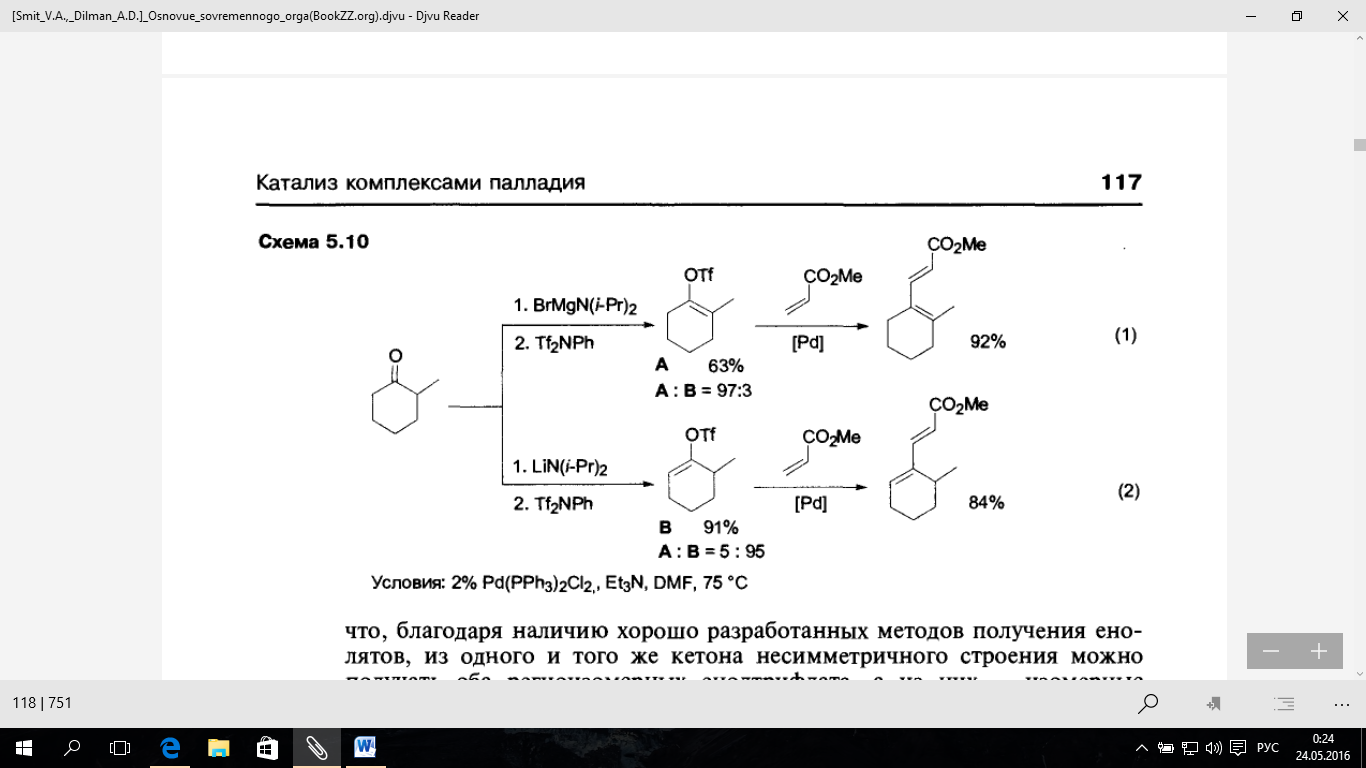
Высокая активность винилтрифлатов позволяет вводить их в конденсацию даже с полифункциональными субстратами. Показательный пример приведем на схеме 5.11 — в этом случае в к росс-сочетай и используется N-защищённый винилглицин, и результатом реакции является образование диеновой аминокислоты с высоким выходом и с полным сохранением оптической чистоты.

4.Экспериментальная часть
4.1.Синтез Коричной кислоты (реакция Хека)

4.1.2. Реактивы:
|
1.0г (5ммоль) |
|
0.5 г (7ммоль) |
|
1.5 г (15ммоль) |
|
10 мг (0.05ммоль) |
|
2.0 мл |
|
0.3 г (5.7ммоль) |
|
5.0 мл |
(25% водный раствор)
| |
4.1.2.1.Лабораторная посуда и оборудование
Синтез: круглодонная колба объемом 10 мл (примечание 2), обратный холодильник, магнитная или механическая мешалка.
Выделение и очистка: колба Бунзена, воронка Хирша, комплект посуды для перекристаллизации.
4.1.2.2.Методика синтеза и выделения (примечание 3)
В круглодонную колбу помещают йодбензол (1 г), диметилформамид (2 мл), триэтиламин (1.5 г), акриловую кислоту (0.5 г). При перемешивании к полученному раствору прибавляют ацетат палладия (10 мг), присоединяют к колбе обратный холодильник и выдерживают реакционную смесь при интенсивном перемешивании 1 ч в слабо кипящей водяной бане (примечания 4, 5). Смесь выливают в раствор карбоната натрия (0.3 г) в воде (10 мл). Раствор фильтруют на воронке Хирша, промывают осадок водой (2-3 мл). Фильтрат подкисляют до слабокислой реакции (универсальная индикаторная бумага) 25% раствором серной или соляной кислоты. Выпавший осадок отфильтровывают на воронке Хирша, промывают водой (дважды порциями по 2-3 мл) и петролейным эфиром (5 мл). Продукт очищают перекристаллизацией из воды и сушат на воздухе. Выход — около 0.51 г (70%) коричной кислоты с т. пл. 131-132 °С.
ИК-спектр (КВr): 3100 (ОН), 1700 (С=O), 1650 см-1(С=С).
1Н ЯМР-спектр (CDCl3): δ 13.21 (уш. с, 1Н, ОН),
7.90 (д, J = 15.8 Гц, 1Н, =СН), 7.7-7.2 (м, 5Н, аром. СН),
6.43 м. д. (д, J = 15.8 Гц, 1Н, =СН) [3].
