
- •Курсовая работа
- •Оглавление
- •Введение
- •1.Механизм реакции Хека.
- •2. Синтетические возможности реакции Хека.
- •3. Модификации реакции Хека.
- •3.1. Катализаторы фазового переноса в реакции Хека
- •3.2. Использование трифлатов (псевдогалогенидов) в реакции Хека
- •4.Экспериментальная часть
- •4.1.Синтез Коричной кислоты (реакция Хека)
- •4.1.2. Реактивы:
- •4.1.2.1.Лабораторная посуда и оборудование
- •4.1.3.1.Примечания
- •4.1.3.2.Утилизация отходов
- •4.2.Обсуждение
- •5.Список литературы
2. Синтетические возможности реакции Хека.
Характеризуя общность реакции, необходимо подчеркнуть два важнейших обстоятельства. Во-первых, нельзя использовать органилгалогениды, содержащие атом водорода при β-углеродном центре, так как в подобных случаях продукт окислительного присоединения будет немедленно претерпевать «син-элиминирование. Во-вторых, из механизма реакции следует, что природа алкена не должна оказывать решающего влияния на ход реакции, и, действительно, реакция Хека применима к широкому кругу алкенов.
Как в молекуле алкена, так и в составе органилгалогенидов могут находиться самые разнообразные функциональные группы. Безусловно, к достоинствам реакции Хека относится также то, что ее проведение не требует полного исключения влаги и кислорода воздуха, что обычно необходимо в реакциях с использованием карбанионных реагентов.
Некоторое
представление о возможностях использования
кросс-сочетания по Хеку дают конкретные
примеры превращений, приведенные на
схеме 5.6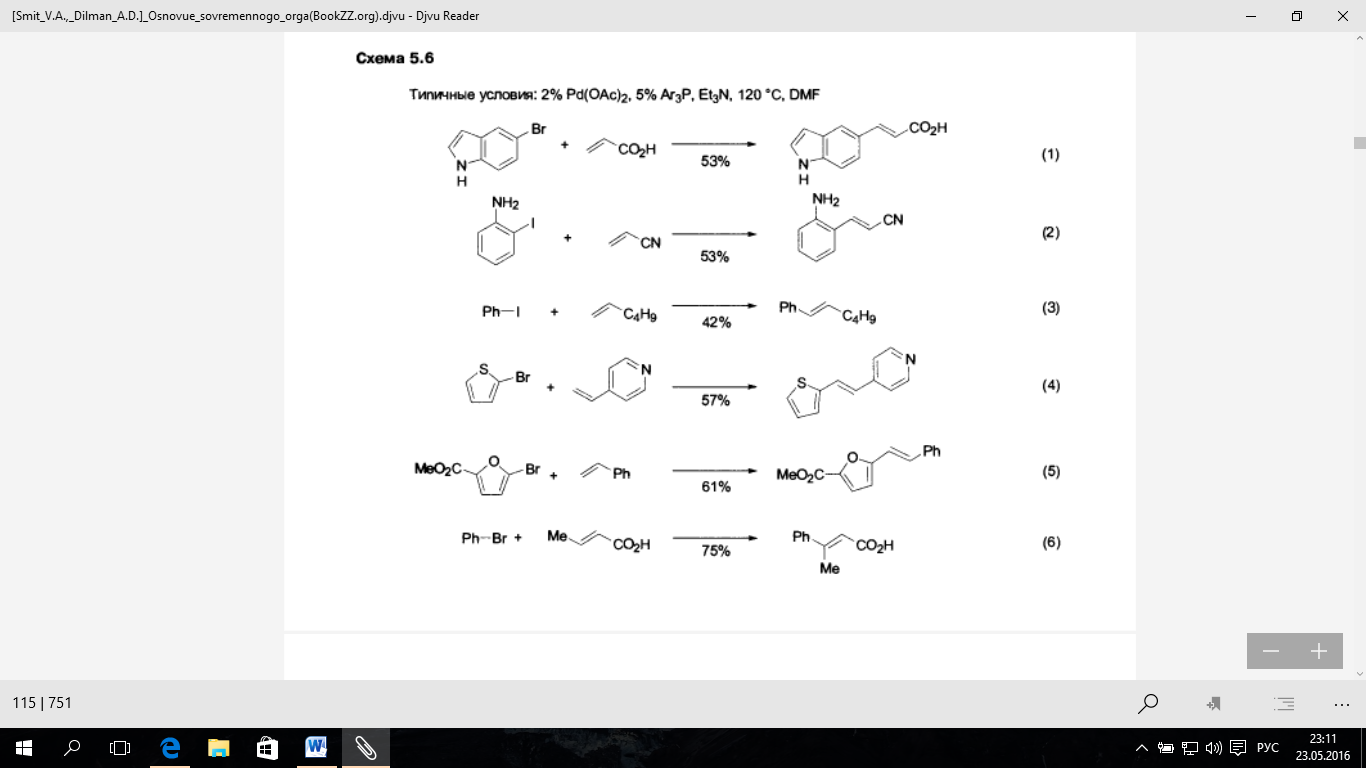
Эти примеры, прежде всего, свидетельствуют об универсальности рассматриваемого сочетания как метода образования связи С-С между sр2 центрами реагирующих молекул (уравнения 1-6). Действительно, в качестве органилгалогенида можно использовать производные как бензола. так и разнообразных гетаренов. Не менее широки пределы вариаций алкенового компонента — от гексена-1 до 4-винилпиридина или кротоновой кислоты. Во всех случаях наблюдается практически латная стереоселективность образования продуктов сочетания, так что из терминальных алкенов образуются продукты с β-конфигурацией двойной связи (уравнения 1-5). а для 1.2-дизамешенных алкенов реакция протекает с обращением относительной конфигурации заместителей (уравнение 6).
В случаях, когда алкеновый компонент содержит в алкильном положении гидрокс и группу, характер образующихся аддуктов может зависеть от природы применяемого основания. Действительно, как показано в приведенных ниже примерах, проведение сочетания с поташом в качестве основания приводит к образованию ожидаемого аддукта (уравнение I, схема 5.7). В то же время в стандартных условиях, с использованием триэтиламина. образуется изомерный кетон (уравнение 2),по-видимому. как результат либо катализируемой изомеризации первичного аддукта, либо элиминирования палладий-гидрида в сторону гидроксильной группы.
Типичные примеры, характеризующие возможности использования кросс-сочетания по Хеку для создания центральной С-С-связи 1.3- диенового фрагмента, приведены на схеме 5.8. Как видно, реакция
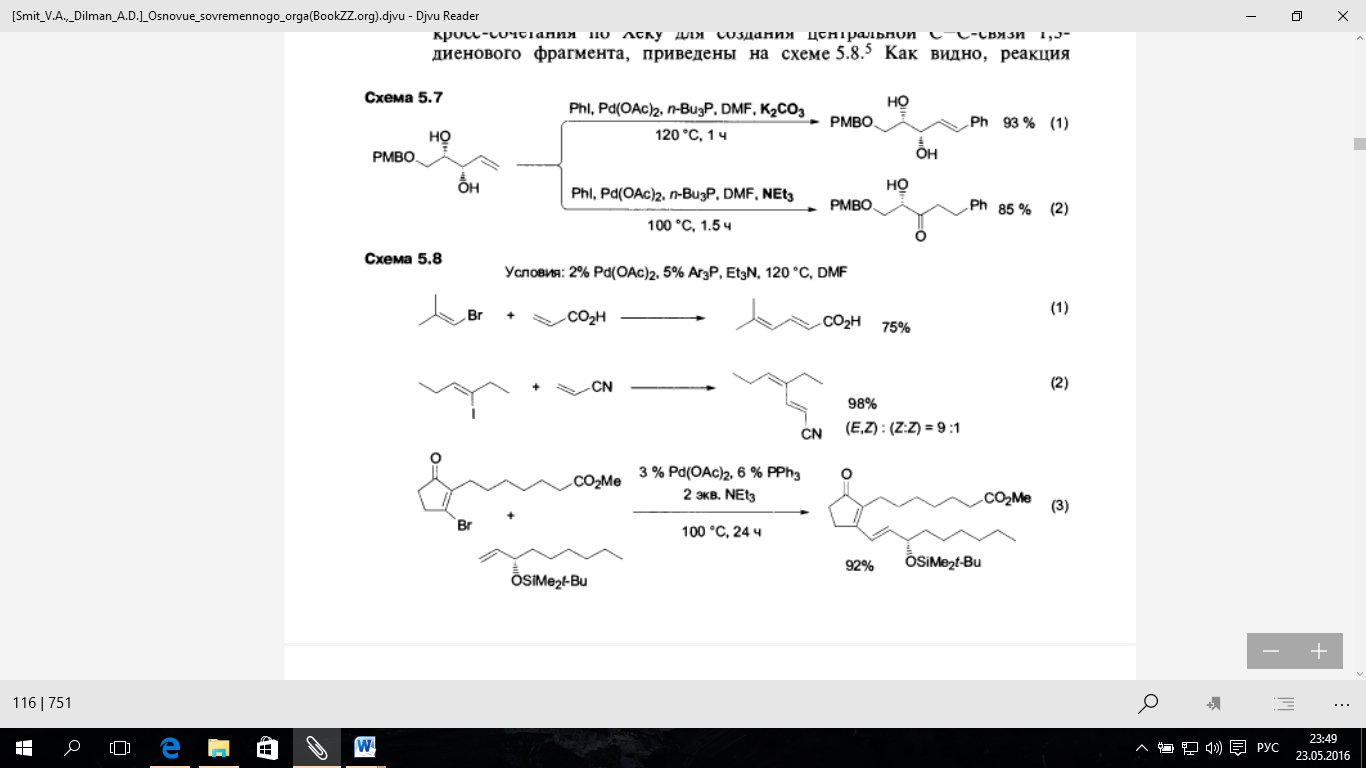
винилирования алкенов протекает с высокой эффективностью, и наличие в составе алкеновой компоненты таких заместителей, как карбоксильная и нитрильная группы (уравнения 1 и 2) или аллильный силоксид-фрагмент (уравнение 3), равно как и наличие различных функциональных заместителей в молекуле вин ил галогенида, не оказывают существенного влияния на итог реакции. Благодаря этим характеристикам, описываемая реакции может использоваться в качестве удобного метода для получения природных полифункциональных соединений, содержащих 1,3-диеновый фрагмент, примером чего может служить синтез производного простагландина (уравнение 3).
