
2 модуль / Lekcija_5_Ruseckaja_Obshie_Svojstva_Fermentov
.pdf
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Лекция № 5.
Тема «Ферменты (энзимы). Общие свойства ферментов»
План.
1.Понятие о ферментах.
2.Отличие действия биологических катализаторов от действия неорганических.
3.Строение ферментов.
4.Активный центр ферментов.
5.Аллостерический центр.
6.Механизм действия ферментов.
7.Кинетика действия ферментов.
8.Общие свойства ферментов.
1. Понятие о ферментах.
Ферменты – биологические катализаторы белковой природы, образуемые живой клеткой, действующие с высокой активностью и специфичностью.
Термин «фермент» происходит от лат. fermentatio - брожение или «fermentum» - закваска. Ферменты еще называют «энзимами» от греч. еn zyme - в дрожжах, т.к. первые представления об этих веществах были связаны со способностью дрожжей сбраживать сахар в вино.
Жизнедеятельность любого живого организма связана с многочисленными химическими превращениями различных соединений. В организме происходят многочисленные реакции окисления, восстановления, переноса различных групп, гидролиза, изомеризации, синтеза и распада веществ. При этом синтезы самых сложных соединений (белков, нуклеиновых кислот, липидов, гликопротеинов) проходят с необычайной точностью. Все эти реакции, от которых зависит жизнь клетки, катализируются ферментами.
2.Отличие действия биологических катализаторов от действия неорганических.
1.Ферменты чрезвычайно эффективны и проявляют высокую каталитическую активность
2.Ферменты активны в условиях температуры тела, нормального давления и оптимальных значениях рН среды.
3.Ферменты отличаются высокой специфичностью.
4.Активность ферментов контролируется как на генетическом уровне, так и посредством эффекторов.
3. Строение ферментов.
По строению ферменты могут быть:
1.простые белки,
2.сложные белки.
Кферментам - простым белкам – относятся пищеварительные ферменты (пепсин, трипсин). К ферментам – сложным белкам – можно отнести ферменты, катализирующие окислительновосстановительные реакции. Для каталитической активности сложных ферментов необходим дополнительный химический компонент, который называется кофактор. Роль кофактора могут играть как неорганические вещества (ионы железа, магния, цинка, меди и др.), так и органические вещества – коферменты. Для работы ряда ферментов необходимы и кофермент, и ион металла (кофактор). Коферменты – низкомолекулярные органические вещества небелковой природы, связанные с белковой частью фермента временно и непрочно. В случае, когда небелковая часть фермента связана с белковой прочно и постоянно, то такую небелковую часть называют простетической группой. Белковая часть сложного белка-фермента называют апоферментом. Вместе апофермент и кофактор образуют холофермент (от англ. whole – весь, целый). Характерной особенностью сложных ферментов является то, что ни апофермент, ни кофактор по отдельности не обладают каталитической активностью, активность проявляет холофермент. Причем добавочная группа стабилизирует белковую часть и делает ее менее уязвимой к действию денатурирующих агентов. В исполнении каталитической функции непосредственно участвует простетическая группа, т.к. она входит в состав каталитического центра фермента.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
4. Активный центр ферментов.
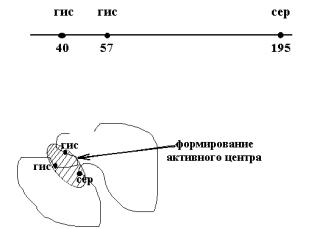
Биологическая функция фермента обусловлена наличием в его структуре активного центра. Активный центр фермента представляет ту часть молекулы фермента, к которой присоединяется субстрат (химическое вещество, которое подвергается катализу) и от которой зависят каталитические свойства молекулы фермента. В формировании активного центра фермента принимают участие аминокислотные остатки, удаленные друг от друга на уровне первичной структуры, но сближающиеся на уровне третичной структуры.
Так, например, выяснено, что в активный центр фермента химотрипсина входит гидроксильная группа серина, стоящего в положении 195 и два остатка гистидина в положении 57 и 40.
Таким образом, пространственное расположение молекулы фермента (конформация) имеет очень большое значение в создании активного центра фермента, а, следовательно, играет важную роль в
проявлении каталитических свойств данным ферментом. Нарушения пространственной структуры фермента ведут к изменениям в активном центре, а, следовательно, к изменениям каталитической функции (чаще всего – к снижению каталитической
функции).
В активном центре фермента выделяют «контактный, якорный, субстратный» участок – участок, притягивающий и удерживающий субстрат на ферменте благодаря своим функциональным группам и
«каталитический» участок, функциональные группы которого непосредственно участвуют в каталитической реакции. К контактному участку присоединяется субстрат, а в каталитическом участке происходит ферментативное превращение субстрата.
Упростых ферментов функцию контакта с субстратом выполняет часть белковой молекулы, которая может быть представлена уникальным сочетанием нескольких аминокислотных остатков, которые располагаются в определенной части белковой молекулы фермента и непосредственно участвует в акте катализа (cульфгидрильная группа цистеина, гидроксильная группа серина, имидазольное кольцо гистидина, аминогруппа лизина и аргинина, карбоксильная группа аспартата и глутамата). Субстрат присоединяется к активному центру фермента слабыми связями (ионными или водородными).
Усложных ферментов в состав активного центра входит кофактор, который принимает непосредственное участие в катализе. Субстрат подходит к активному центру фермента, как «ключ к замку».
Таким образом, активный центр фермента определяется первичной структурой, а формируется на третичном уровне организации молекулы белка-фермента.
5. Аллостерический центр У некоторых ферментов, кроме активного центра, имеется еще «другой» центр – аллостерический
(от греч. allos – другой и stereos – пространственный, структурный). С аллостерическим центром взаимодействуют различные вещества (эффекторы), чаще всего различные метаболиты. Соединение этих веществ с аллостерическим центром приводит к изменению конформации фермента, а, следовательно, и его активного центра, что влечет за собой изменение активности фермента. Поэтому аллостерический центр называют регуляторным центром фермента. Ферменты, имеющие в своей структуре аллостерический центр, называются регуляторными или аллостерическими.
6. Механизм действия ферментов В основу теории механизма действия ферментов положено образование фермент-субстратного
комплекса. Механизм действия фермента, исходя из работ Брауна, Михаэлиса и Ментен можно представить поэтапно:
1.образование фермент-субстратного комплекса (субстрат прикрепляется к активному центру фермента). На 1 стадии ферментативного процесса может меняться не только конформация фермента, изменению подвергается и субстрат. В субстрате возникают дополнительные связи.
2.На второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (En) и субстрат (S)
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
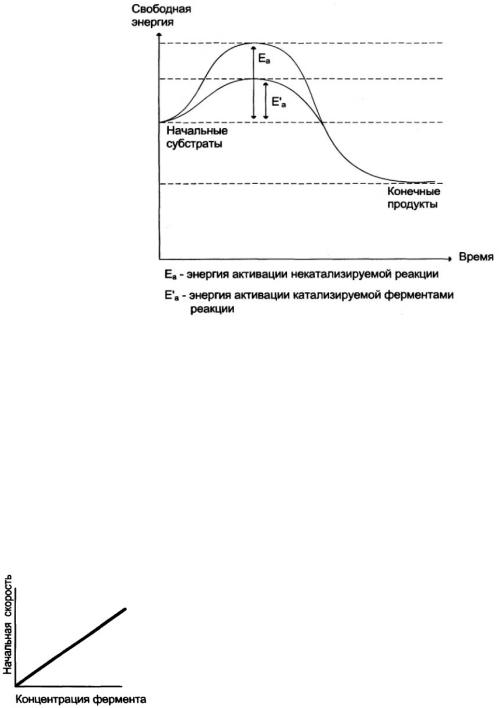
начинают сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или энергетического барьера данной химической реакции. Энергия активации – энергия, необходимая для перевода всех молекул 1 моля субстрата (S) в активированное состояние при данной температуре. Для каждой химической реакции существует свой энергетический барьер. Благодаря образованию фермент-субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа.
3.На третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-субстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне:
7. Кинетика действия ферментов На ход ферментативной реакции оказывают влияние различные факторы окружающей среды:
температура, реакция среды, самые разнообразные вещества, имеющиеся в живой клетке. Все эти факторы можно рассматривать как факторы регуляции ферментативных процессов. Знание их действия дает возможность целенаправленно воздействовать на ход ферментативной реакции.
Об активности фермента судят по скорости ферментативной реакции. Скорость реакции определяется либо по уменьшению количества субстрата, либо по увеличению количества продукта реакции за единицу времени. Об изменениях количества субстрата и продукта узнают, применяя колориметрические, манометрические, поляриметрические, хроматографические и другие методы.
Влияние концентрации фермента Скорость ферментативной реакции прямо пропорциональна концентрации фермента:
V = [F]*K, где К – константа скорости реакции, [F] – концентрация фермента.

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
|
Влияние концентрации субстрата |
Зависимость скорости ферментативной реакции от концентрации субстрата выражается гиперболической кривой. При низких концентрациях субстрата скорость реакции пропорциональна концентрации субстрата. По мере увеличения концентрации субстрата активные центры молекул фермента взаимодействует с молекулами субстрата до полного насыщения активных центров всех молекул фермента. Когда активные центры всех молекул фермента связаны с субстратами, скорость ферментативной реакции максимальна. Дальнейшее увеличение концентрации
субстрата не приводит к увеличению скорости реакции. Л. Михаэлис и М. Ментен предложили, используя график зависимости скорости реакции от концентрации субстрата, определять константу Михаэлиса (Km). Константа Михаэлиса - это такое количество субстрата, при котором скорость ферментативной реакции равна половине от максимальной. Михаэлис и Ментен, исходя из теории фермент-субстратного комплекса, вывели следующую формулу для скорости действия
фермента: |
|
|
|
Vmax * [S] |
Vmax *Km |
Vmax *Km |
Vmax |
V = ––––––––––– ; V = ––––––––––– = –––––––––––– = –––––––––– |
|||
Km + [S] |
Km + Km |
2 Km |
2 |
По величине Км (ее можно измерить для каждого фермента) можно судить о сродстве субстрата к ферменту. Ферменты и субстраты с низкой Кm называют «быстрыми ферментами», с высокой Кm
– «медленными».
8. Общие свойства ферментов Общие свойства ферментов характеризуют ферменты как катализаторы белковой природы. К общим свойствам ферментов относятся:
1.Термолабильность (влияние температуры).
2.Влияние рН
3.Специфичность
1. Влияние температуры (термолабильность). Ферменты не устойчивы к температурному воздействию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость ферментативной реакции имеет свой температурный оптимум, повышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы.
Оптимальной температурой для действия ферментов организма человека является температура 37-38°C. Снижение ферментативной активности наблюдается при низких температурах, но при этом не происходит потери
биологических свойств фермента.
Зависимость скорости реакции от температуры выражается графиком.
Однако есть термоустойчивые ферменты, особенно у растений и микроорганизмов, которые не теряют своих свойств даже при кипячении.
2. Влияние рН. На ферментативную активность в значительной степени влияет концентрация протонов (величина рН). Ферментативная реакция происходит наиболее активно при определенных значениях рН. Такая величина рН, при которой скорость реакции является максимальной у данной ферментативной реакции, называется рН-оптимумом фермента. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка-фермента. Например, при закислении среды происходит протонизация свободных аминогрупп (-NH3+) лизина и аргинина, а при защелачивании – отщепление протона от карбоксильных групп (-СОО-) аспартата и глутамата. Это приводит к изменению конформации фермента и конформации активного центра, в результате чего нарушается присоединение субстрата, кофакторов и коферментов к активному центру.
Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство к активному центру.
При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Наиболее выраженные изменения в конформации фермента и его активном центре наблюдаются в ИЭТ.
Разные ферменты имеют разные оптимумы рН: пепсин – 1,5-2; амилаза – 6,8; трипсин – 7,0 и т.д.
Однако большинство ферментов организма человека имеет оптимум рН близкий к нейтральному.
Влияние рН на активность ферментов для фермента амилазы слюны выражается графиком:
3. Специфичность – очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется совпадением пространственной конфигурации субстрата и субстратного центра (стерическое и химическое совпадение). За специфичность фермента ответственен как активный центр фермента, так и апофермент. Различают три основных вида специфичности: абсолютную, относительную, стереохимическую.
1.Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат. Например, сахараза гидролизует только сахарозу, лактаза – лактозу, мальтаза – мальтозу, уреаза – мочевину, аргиназа – аргинин и т.д.
2.Относительная специфичность – это способность фермента действовать на группу субстратов с общим типом связи, т.е. относительная специфичность проявляется по отношению к группе субстратов. Пример: липаза расщепляет сложноэфирную связь в жирах животного и растительного происхождения. Амилаза гидролизует α-гликозидную связь в крахмале, декстринах и гликогене. Алкогольдегидрогеназа окисляет спирты (метанол, этанол и др.).
3.Стереохимическая специфичность – это способность фермента действовать только на один стереоизомер.
Например: 1) α, β-изомерия: α – амилаза слюны и сока поджелудочной железы расщепляет только α-глюкозидные связи в крахмале и не расщепляет β-глюкозидные связи клетчатки.
2) L, D-изомерия: В нашем организме превращения подвергаются только L-аминокислоты, т.к. эти превращения осуществляются ферментами L-оксидазами, способными реагировать только
сL-формой аминокислот.
3)Цис-, транс-изомерия.
Фумаратгидратаза может превращать только транс-изомер (фумаровую кислоту) в яблочную.
