
2 модуль / enzymes_clinic
.pdfФерменты сыворотки крови
В клинике в диагностических целях исследуют чаще всего ферменты
сыворотки или плазмы крови, ферменты мочи и других биологических
жидкостей.
Ферменты сыворотки крови принято делить на три группы:
1.Секреторные ферменты. Это – собственные ферменты плазмы. Они образуются в печени и выполняют свои функции непосредственно в сосудистом русле, где имеются субстраты для их действия. К
секреторным ферментам относят: липопротеинлипазу, холинэстеразу,
ферменты свертывания крови, церулоплазмин.
2.Экскреторные ферменты. Они попадают в плазму из экзокринных желез (слюнные железы, поджелудочная железа, печень, слизистая желудка и 12-перстной кишки). При многих патологических процессах выделение их нарушается и активность экскреторных ферментов резко увеличивается. Например, воспаление ткани поджелудочной железы приводит к 5–10-кратному увеличению активности амилазы и липазы.
3.Тканевые, или клеточные ферменты. Их называют также
индикаторными, так как уровень их активности в крови является показателем (индикатором) функции органа или ткани, содержащей фермент. Каждый орган или ткань характеризуются определенным набором и уровнем активности ферментов.
Гипоферментемия встречается относительно редко, и касается в основном секреторных ферментов. В большинстве случаев она обусловлена генетическими нарушениями синтеза ферментов или их ингибированием, усиленной деградацией и экскрецией.
Дисферментемия связана в основном с появлением органо-
специфичных ферментов в крови.
Гиперферментемия свидетельствует о некрозе или лизисе клеток,
либо о нарушении проницаемости клеточных мембран при гипоксии,

воздействии токсинов, бактерий, вирусов, действии лекарств и других ксенобиотиков.
Появление в крови или моче тканевых ферментов позволяет судить о функциональном состоянии органа и наличии в нем патологических процессов.
Например, при инфаркте миокарда (ишемия или некроз участка сердечной мышцы) в крови и моче резко возрастает активность креатин-
фосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), трансаминаз. При заболеваниях печени в крови возрастает активность трансаминаз, ЛДГ,
гаммаглутамилтранспептидазы. Нарушение метаболизма костной ткани приводит к увеличению в крови щелочной фосфатазы.
Определение активности индикаторных ферментов при различных заболеваниях составляет основу ферментодиагностики.
Энзимодиагностика (ферментодиагностика)
Ферменты применяются в клинике в нескольких направлениях:
1.Как химические реагенты при проведении клинико-диагностических методик. Например, фермент глюкозооксидаза используется для определения количества глюкозы в крови:
|
неокрашенное |
окрашенный |
||
|
вещество |
продукт |
|
|
глюкоза |
глюкозооксидаза глюконат + Н2О2 |
пероксидаза |
Н2О |
|
|
|
|
||
По количеству образованного окрашенного продукта судят о количестве глюкозы в крови. Такие методы носят название ферментативных методов исследования. Они наиболее современны и обладают высокой точностью. Ферментативные методы используются также для количественного определения в плазме крови холестерина,
триацилглицеринов, мочевины, мочевой кислоты.
2.Определение активности ферментов с целью диагностики функционального состояния органа или степени его поражения.
Для этой цели используют различные методы определения активности ферментов. Каждый орган имеет определенный набор или типичную группу ферментов (ферментативный спектр). Выявление активности ферментов, органоспецифичных для данного органа и составляет основу ферментодиагностики.
Активность ферментов в крови зависит от процессов синтеза и распада ферментов в ткани, состояния проницаемости мембран,
скорости инактивации ферментов и их утилизации. Патологические процессы в органах вызывают деструктивные изменения мембран,
нарушение их проницаемости. В результате ферменты поступают в плазму в повышенном количестве, что сопровождается повышением активности этих ферментов. По мере развития патологического процесса происходит прогрессирующее нарушение целостности мембран и утечка ферментов. В плазме или сыворотке накапливаются ферменты, набор которых характеризует их состав в пораженном органе.
Существует определенная связь между степенью повреждения клеток и последовательностью выхода в кровь ферментов из разных отделов клеток. Например, при воспалительных процессах повышается проницаемость цитоплазматических мембран и в сыворотку крови попадают цитоплазматические ферменты. При некрозе тканей (инфаркт миокарда, цирроз печени) наблюдается разрушение всех клеточных структур, поэтому в сыворотке могут быть обнаружены митохондриальные, лизосомальные, ядерные ферменты.
Определение активности тканевых ферментов дает возможность не только диагностировать заболевание, но и является объективным критерием для контроля за течением заболевания и адекватностью проводимого лечения. Например, активность креатинфосфокиназы резко возрастает в первые часы инфаркта миокарда и нормализуется на
2–3 день заболевания. Увеличение активности этого фермента в
дальнейшей динамике заболевания может свидетельствовать о расширении зоны некроза или появлении новых ишемических очагов.
В настоящее время в лабораторной диагностике заболеваний используются следующие ферменты:
Таблица 1
Фермент |
Заболевание |
|
Аспартатаминотрансфераза (АсАТ) |
Инфаркт миокарда |
|
Аланинаминотрансфераза (АлАТ) |
Вирусный гепатит |
|
Амилаза |
Острый панкреатит |
|
Церулоплазмин |
Болезнь Вильсона |
|
(гепатолентикулярная дегенерация) |
||
|
||
Креатинфосфокиназа (КФК) |
Инфаркт миокарда, |
|
патология скелетных мышц |
||
|
||
Лактатдегидрогеназа (ЛДГ) |
Инфаркт миокарда |
|
-глутамилтрансфераза (ГГТ) |
Заболевания печени |
|
Липаза |
Острый панкреатит |
|
Кислая фосфатаза |
Карцинома предстательной железы |
|
Щелочная фосфатаза |
Заболевания костей, |
|
желчнокаменная болезнь |
||
|
Энзимотерапия
Некоторые ферменты используют как лечебные препараты. Большинство биохимических процессов происходит внутри клеток, куда экзогенные ферменты как высокомолекулярные соединения проникнуть не могут. Поэтому ферментотерапия имеет ограниченное применение.
1.При недостаточной функции пищеварительных ферментов назначают лекарственные препараты, содержащие пепсин или ферменты поджелудочной железы. Так, при снижении секреторной функции желудка назначают препараты, содержащие пепсин; при гипофункции поджелудочной железы рекомендуют препараты «Мезим-форте», «Фестал», в состав которых входит трипсин, химотрипсин, карбокси-
пептидаза. Эти ферменты способствуют перевариванию белков пищи.
2.Введение фермента уреазы больным с заболеваниями почек,
находящимся на лечении в аппаратах «искусственная почка»
способствует расщеплению мочевины и снижению уремической
интоксикации у таких больных.
3.Некоторые ферменты используются для специфической очистки гнойных ран (трипсин, химотрипсин) и для рассасывания рубцов после ожогов или после операций (лидаза). Лидазой называется фармацевтический препарат, содержащий фермент -гиалуронидазу.
Лидазу вводят больным с контрактурами суставов, для рассасывания гематом, для размягчения рубцов. Протеолитические ферменты используются также для лечения тромбозов.
4.Аспарагиназу применяют для лечения некоторых форм лейкозов.
Введение аспарагиназы нарушает синтез белков в лейкозных клетках,
что приводит к гибели опухолевых клеток.
Изоферменты, их значение в клинической диагностике
Перечисленные в таблице 1 ферменты широко распространены в тканях и не являются узкоорганоспецифичными. Более специфичным для диагностики заболеваний является определение изоферментов. Изоферментами называются ферменты, выполняющие одинаковую функцию (катализ определенной реакции) и различающиеся по физико-химическим свойствам: кинетике реакций, аминокислотному составу, электрическому заряду, электро-
форетической подвижности. Особенности изоферментов обусловлены генетическим различием их первичной структуры. Если изоферменты имеют своем составе несколько субъединиц (олигомеров), то они различаются комбинацией протомеров.
Например, лактатдегидрогеназа (ЛДГ) представляет собой тетрамер,
состоящий из двух типов протомеров: Н и М. Возможны 5 комбинаций этих протомеров: Н4, Н3М, Н2М2, НМ3, М4. Все эти виды встречаются в тканях организма, они соответствуют изомерам: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5.
Установлено, что фракция ЛДГ1 происходит из сердца, а ЛДГ5 – из печени.
Определение изоферментов ЛДГ является более точным диагностическим

тестом при поражении печени и миокарда, чем определение общей активности ЛДГ.
Для молекул креатинфосфокиназы (КФК) установлено 3 активных изомера: мышечный изоэнзим (КФК-ММ), сердечный изоэнзим (КФК-МВ),
мозговой изоэнзим (КФК-ВВ). Установлено, что в сыворотке крови здоровых людей активность ММ изофермента составляет 95 % общей активности КФК и около 5 % приходится на изофермент МВ.
При остром инфаркте миокарда спустя 4–6 часов после развития очага некроза активность КФК увеличивается за счет подъема активности КФК-МВ.
Определение «сердечного» изофермента КФК является ранним и точным показателем инфаркта миокарда.
Ферментопатии (энзимопатии)
Ферментопатиями называются заболевания, обусловленные недостатком или полным отсутствием выработки фермента в организме. Различают врожденные и приобретенные ферментопатии. Энзимопатии вызываются мутацией генов, индуцирующих синтез того или другого фермента. Чаще всего это результат точечных мутаций ДНК, например, замена пуринового основания на пиримидиновое. Такая трансверсия на уровне клетки проявляется нарушением синтеза фермента или образованием белка, не обладающего ферментативной активностью. Приобретенные энзимопатии наступают в результате перенесенных вирусных заболеваний, если вирус вызывает мутационные изменения в ДНК.
К числу врожденных ферментопатий относится заболевание фенилкетон-
урия (ФКУ), или фенилпировиноградная олигофрения, основными клиническими проявлениями которой являются умственная отсталость,
припадки, психозы, экзема. Заболевание связано с нарушением обмена фенилаланина (ФА). Фенилаланин – незаменимая аминокислота, так как бензольное кольцо в клетках не синтезируется. В норме фенилаланин окисляется в тирозин при участии фенилаланингидроксилазы:
фенилаланин фенилаланингидроксилаза тирозин
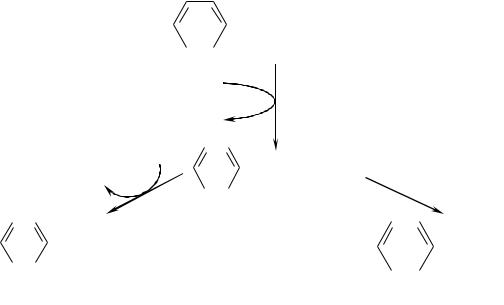
При отсутствии фермента фенилаланингидроксилазы в тканях и крови накапливается фенилаланин, который при действии неспецифических ферментов превращается в фенилкетоновые продукты: фенилпируват,
фениллактат, фенилацетат:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
CH |
|
|
COOH фенилаланин |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
-кетоглутарат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
глутамат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
НАД•Н2 |
|
|
|
|
CH2 |
|
|
C |
|
|
COOH |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
НАД |
|
|
|
|
|
|
|
|
– СО2 |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
+ О |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенилпируват |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
CH2 |
|
CH |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 COOH |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
фениллактат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенилацетат |
||||||||||||||||||||||||
Экскреция фенилпирувата с мочой и определило само название болезни.
ФКУ приводит к нарушению образования тирозина, который является необходимой аминокислотой для синтеза белков и пептидов, а также служит источником для синтеза тироксина в щитовидной железе, адреналина и норадреналина в надпочечниках и образования меланина в меланоцитах.
Прогрессирующее развитие нарушений умственного развития у детей,
больных ФКУ, можно приостановить путем назначения диеты, не содержащей фенилаланин. По достижении 6-летнего возраста эту диету можно отменить,
т.к. к этому времени избыток фенилаланина и его производных перестает оказывать неблагоприятное воздействие на работу мозга.
Функции лактатдегидрогеназы, креатинфосфокиназы, трансаминаз
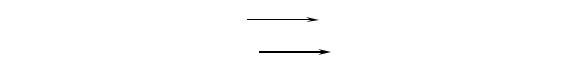
1.Лактатдегидрогеназа (ЛДГ) – цитоплазматический фермент,
катализирующий обратимую реакцию окисления лактата до пирувата.
Акцептором водорода служит кофермент НАД.
Фермент широко распространен в тканях человека. По степени уменьшения активности фермента органы и ткани можно расположить в следующем порядке: почки, сердце, скелетные мышцы, печень, плазма. В
плазме обнаружены несколько изоферментов ЛДГ, все они содержат в качестве кофермента НАД.
Активность ЛДГ возрастает при повреждении миокарда, острой стадии гепатитов, заболеваниях почек, при анемиях.
2.Креатинфосфокиназа (КФК) катализирует обратимую реакцию образования АТФ в клетках миокарда и скелетных мышц путем субстратного фосфори-
лирования АДФ.
Креатинфосфат является макроэргическим соединением, используемым для сокращения и расслабления мышц, транспортировки метаболитов.
Активность КФК отмечается при мышечных повреждениях (инфаркт миокарда, травмы мышц), при мышечной дистрофии, инсультах. КФК не повышается при поражениях паренхимы печени. КФК используется для диагностики острого периода инфаркта миокарда.
3.Трансаминазы (аминотрансферазы) – внутриклеточные ферменты,
участвующие в обмене аминокислот. Содержатся в мышцах, печени, мозге,
миокарде. Повышение концентрации трансаминаз свидетельствует о некрозе или поражении этих тканей.
Трансаминазы катализируют обратимые реакции переноса аминогрупп от аминокислот на кетокислоты и обратно. Содержат в качестве кофермента пиридоксальфосфат и фосфопиридоксамин, в состав которых входит витамин В6. В тканях наиболее активны трансаминазы АлАТ и АсАТ. Они катализируют реакции переаминирования аланина и аспартата:
1) |
аланин + -кетоглутарат |
АлАТ |
пируват + глутамат |
|
|||
2) |
аспартат + -кетоглутарат |
АсАТ |
оксалоацетат + глутамат |
|
Увеличение активности трансаминаз имеет место при инфаркте
миокарда (особенно АсАТ), при остром инфекционном гепатите (АлАТ,
менее АсАТ), при циррозах печени.
