
|
|
61 |
|
|
1) олова |
2) серы |
3) мышьяка |
4) фосфора |
|
11. В ряду N2 O2 H2 прочность связи в молекуле__________. |
||||
1) |
уменьшается |
3) |
увеличивается |
|
2) |
изменяется периодически |
4) |
не изменяется |
|
12. Для какого соединения атом является структурной частицей кристаллической решетки?
1) |
метана |
2) |
кислорода |
|
3) |
водорода |
4) кремния |
13. Кристаллическая решетка графита__________. |
|
||||||
1) |
ионная |
2) |
атомная |
3) |
молекулярная |
4) металлическая |
|
14) В молекуле хлорида алюминия тип гибридизации атомных орбиталей? |
|||||||
|
1) sp2 |
2) |
sp |
3) sp3 |
4) |
d2sp3 |
|
Занятие 1.2.3
ТЕМА: Химия биогенных элементов d-блока. Лигандообменные процессы. Строение металлоферментов, биокомплексных соединений.
ЦЕЛЬ: Изучить положение d-элементов в периодической системе, их свойства и биологическое действие. На основе знаний координационной теории Вернера сформировать представление о ферментах как биокомплексных соединениях, их свойствах и роли в жизнедеятельности организма.
ЗНАТЬ:
1.Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока.
2.Общая характеристика d- элементов. Изменение химической активности d-элементов вподгруппах в направлении сверху вниз. Степень окисления, закономерности изменения кислотно-основных и окислительно-восстановительных свойств d- элементов в зависимости от степени окисления. Роль d- элементов в организме. Характерные степени окисления для d- элементов, встречающихся в организме.
3.Классификация и номенклатура комплексных соединений. Координационная теория Вернера. Получение комплексных соединений. Природа химической связи в комплексных соединениях. Геометрическая форма комплексных соединений и гибридизация атомных орбиталей комплексообразователя (sp-, sp3-, sp3d2-, dsp2-). Поляризующая способность лигандов. Внутриорбитальные и внешнеорбитальные комплексы.
4.Представления о строении металлоферментов и других биокомплексных соединений: (гемоглобин, цианкобаламин, каталаза, цитохромы). Физико-химические принципы транспорта кислорода гемоглобином.
5.Метало-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжёлых металлов и мышьяка. Термодинамические принципы хелатотерапии.
6.Общая характеристика d- элементов VI Б группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений хрома в степени окисления +2, +3, +6. Биологическая роль Сг+3, Мо+6. Ксантиноксидаза и альдегидоксидаза - ферменты, содержащие Мо+6.
7.Общая характеристика элементов VII Б группы. Электронные формулы для марганца, технеция, рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2, +4, +6, +7. Окислительная активность перманганатиона в зависимости от среды. Биологическая роль Мn+2 и соединения марганца, применяемые в медицине.
8.Элементы VIII группы. Семейство железа. Характерные степени окисления для железа, никеля, кобальта. Свойства соединений железа со степенью окисления +2, +3, +6. Характерные
61
62
комплексные соединения для Fe+2, Fe+3. Биологическая роль Fe+2, Fe+3 и Co+3. Препараты железа, используемые в медицине. Механизм цитотоксического действия соединений платины.
9.Общая характеристика d-элементов1 Б группы. Электронные формулы и степени окисления для меди, серебра и золота. Координационные числа, тип гибридизации атомных орбиталей,
структура соединений. Биологическая роль Сu+2. Оксигеназы и гидроксилазы. Церуллоплазмин. Их роль в биохимических процессах.
10. Общая характеристика d-элементов II Б группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Изменение кислотно-основных свойств от цинка к ртути. Строение комплексных соединений. Гидроксиды данных элементов и их свойства. Биологическая роль Zn+2. Карбоангидраза, строение активного центра металлофермента, биологическая роль. Карбоксипепсидаза. Механизм участия карбоксипепсидазы в реакциях гидролиза пептидных связей. Токсическое действие на организм Hg+2, Cd+2. Соединения цинка и ртути, применяемые в медицине.
УМЕТЬ:
1.Самостоятельно пользоваться учебной и справочной литературой.
2.Пользоваться химической посудой и оборудованием (пробирки, индикаторная бумага, водяные бани, спиртовки, держатели для спиртовок и т.д.).
3.Наблюдать за протеканием химических реакций и делать обоснованные выводы.
4.С помощью качественных химических реакций подтверждать наличие в исследуемом растворе соответствующих катионов и анионов элементов d-блока, уметь записывать химизм происходящих процессов.
5.Называть, классифицировать, определять природу химической связи и выводить константу нестойкости для комплексных соединений.
6.Решать типовые практические задачи.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками безопасной работы в химической лаборатории.
3.Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №7 «Химические свойства d-элементов»
Обучающие задачи и упражнения Упражнение 1. Определите степень окисления комплексообразователя в комплексном соединении [Cо(NH3)5Br]SO4
Решение: Внешняя сфера SO4 2-, имеет заряд -2, значит внутренняя сфера [Cо(NH3)5Br] имеет заряд +2. [Cо(NH3)5Br]2+
Поскольку заряд внутренней сферы определяется как алгебраическая сумма заряда комплексообразователя и лигандов, можно определить степень окисления комплексообразователя, т.е. кобальта. Зная, что заряд NH3 равен 0, а для Br-1, степень окисления Со будет равна +3.
Ответ: +3
Упражнение 2. Определите заряд комплексного иона и тип гибридизации атомных орбиталей комплексообразователя в данном соединении: [Cu+2(H2O)4]x
Решение: Заряд лиганда Н2О равен 0, тогда заряд комплексного иона равен 2+ [Cu+2(H2O)4]2+ Координационное число равно 4, что определяет гибридизацию атомных орбиталей по типу sp3 . Ответ: 2+, sp3 - гибридизация.
Упражнение 3. Запишите константу нестойкости для следующего соединения: Na2[Zn(OH)4] Решение: В водном растворе соединение полностью диссоциирует на внешнюю и внутреннюю сферу: Na2[Zn(OH)4] 2Na+ + [Zn(OH)4]2-
Данный процесс называется первичной диссоциацией. Внутренняя среда диссоциирует слабо, этот процесс является обратимыми и он характеризуется константой равновесия, называемой константой нестойкости
[Zn(OH)4]2- Zn+2 + 4OH-
62

63
Кнест |
|
[Zn 2 ][OH ]4 |
|||
[[Zn(OH )4 |
] |
2 |
] |
||
|
|
|
|||
[Zn+2]× [OH-]4
К нест. =
[[Zn(OH)4]2-]
Упражнение 4. Существует два изомера состава CrCl2(NO2)(NH3)4. Один из них дает осадок с раствором нитрата серебра, другой не образует осадка. Чем можно объяснить это различие в поведении двух изомеров?
Ответ:
1. Cr(NH3)4 Cl2 NO2 + AgNO3 Cr(NH3)Cl(NO2) NO3 + AgNO2
осадка нет
2. Cr(NH3)Cl(NO2) Cl + AgNO3 Cr(NH3)Cl(NO2) NO3 + AgCl
выпадает осадок, т.к. в комплексном соединении хлорид-ион находится во внешней сфере. Упражнение 5. Британский антилюизит (БАЛ) используется как антидот при отравлении солями ртути. Запишите уравнение взаимодействия солей ртути с БАЛ в качестве лечебного средства.
Ответ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
||||
СН2 |
|
|
|
SH |
|
|
СН2 |
|
|
S |
|
S |
|
|
|
|
CH2 |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2CH |
|
|
|
|
|
|
|
|
|
|
|
Hg2+ |
|
|
|
|
|
|
|
CH + 2H+ |
|||
|
|
|
|
SH |
+ Hg2+ |
|
|
S |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
СН |
S |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
СН2 |
|
|
|
OH |
|
|
|
|
|
|
|
OH |
|
|
|
CH2 |
|||||||
|
|
|
|
|
СН2 |
|
|
|
OH |
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Упражнение 6. Сколько изомеров существует у иона Co(H2N-CH2-CH2-NH2)2Cl2 + ? Ответ обоснуйте и проиллюстрируйте.
Ответ: Существует 2 изомера транс (а)- и цисизомер (б).
|
NH2 |
|
|
|
NH |
|
|
|
|
|
|
2 |
|
Cl |
NH2 |
H |
N |
|
|
NH |
|
Co |
2 |
|
|
Co |
2 |
|
|
|
|
|
||
H2N |
Cl |
|
H |
N |
|
|
|
|
Cl |
||||
|
|
|
2 |
|
|
|
|
NH2 |
|
|
|
Cl |
|
а- транс-изомер |
|
|
|
б –цис-изомер |
||
Упражнения и задачи для самостоятельной работы Упражнение 1. Определите степень окисления комплексообразователя, назовите комплексное соединение и выразите константу нестойкости:
K3[Fe(CN)6] [Co(H2O)6]Cl3 K4[Fe(CN)6] KFe[Fe(CN)6]
Упражнение 2. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями Hg+2.
Упражнение 3. Из предложенных ниже молекул и ионов составьте комплексные соединения
анионного, катионного и нейтрального типа (Pt+2, NН3, К+, С1-, Сu+2).Назовите их. |
|
Упражнение 4. В аналитической и медицинской практике используется |
ЭДТА |
(этилендиаминтетрауксусная кислота) и его соль Na2H2Т (трилон Б) С какими катионами: Со3+
(kн=2,51×10-41), Мg2+ (kн=7,59×10-10), Fe2+ (kн=6,31×10-15), Fe3+ (kн=5,89×10-25) он образует менее прочное комплексное соединение? Расположите комплексы по убыванию их прочности. Упражнение 5. Укажите, в состав каких ферментов входит кобальт:
1) |
карбоангидразы; |
3) |
цитохромов |
2) |
витамина В12 |
4) |
супероксиддисмутазы; |
|
|
5) |
ксантиноксидазы |
Задача 1. При отравлениях ляписом (нитрат серебра) желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при взаимодействии 0,1 г нитрата серебра с избытком хлорида натрия.
Ответ: m(AgCl)=0,084г
63
64
Задача 2. Сульфат цинка ZnSO4 применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25г раствора ZnSO4 c массовой долей 2%, чтобы приготовить глазные капли?
Ответ: 175 г воды.
Задача 3. Массовая доля цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30мг) яда?
Ответ: N (Zn)=1,38×1018 атомов
Тестовые вопросы 1. Медь содержащий белок плазмы крови человека называется______.
|
1) |
гемоглобин |
2) цитохром |
|
3) альбумин |
|
4) церрулоплазмин |
||||||
2. |
Какой микроэлемент входит в состав фермента ксантиноксидазы_______. |
||||||||||||
|
1) |
железо |
2) |
серебро |
3) кобальт 4) молибден |
|
|
||||||
3. |
Какой металл входит в состав гемоглобина? |
|
|
|
|
||||||||
|
1) |
медь (II) |
2) |
железо (II) 3) кобальт (III) |
4) железо (III) |
||||||||
4. |
Какое эндемическое заболевание возникает при избытке Мо6+ в воде и почве? |
||||||||||||
|
1) |
кариес |
2) |
подагра 3) эндемический зоб4) анемия |
|
||||||||
5. |
Какой фермент катализирует процесс гидролиза пептидной связи? |
||||||||||||
|
1) |
глутатион |
2) |
ксантиноксидаза |
3)карбопепсидаза |
4) каталаза |
|||||||
6) Какой фермент участвует в разложении пероксидов (H2O2)? |
|
||||||||||||
|
1) |
каталаза |
2) |
инсулин |
3) гидроксилаза |
4) карбоангидраза |
|||||||
7. |
Какой раствор соли используют при отравлении ионами серебра? |
||||||||||||
|
1) NaCl |
2) NaSO4 |
|
3) CH3COOH 4) KCl |
|
|
|
|
|||||
8. |
Какая болезнь возникает при избыточном поступлении меди в организм? |
||||||||||||
|
1) |
анемия |
|
|
|
|
3) |
Коновалова-Вильсона |
|
||||
|
2) |
медная анемия |
|
|
4) |
остеопороз |
|
|
|
|
|||
9. |
Общее число электронов в ионе Cr 3+ равно: |
|
|
|
|
||||||||
|
1) |
21 |
|
2) |
27 |
|
3) |
24 |
4) |
52 |
|
|
|
10. Соль образуется при__________. |
|
|
|
|
|
|
|||||||
1) |
разложении пероксида водорода |
3) |
обугливании сахара в серной кислоте |
||||||||||
2) |
горении железа в хлоре |
|
|
4) |
растворении негашеной извести в воде |
||||||||
11. При частичном восстановлении Сr2O3 образуется_________. |
|
||||||||||||
|
1) СrO |
|
2) СrO4 2- |
|
3) СrO2 – |
|
|
4) Сr2O7 2- |
|||||
12. Какие из приведенных оснований проявляют амфотерные свойства? |
|||||||||||||
1) Ca(OH)2 |
|
2) |
Zn(OH)2 |
|
3) |
KOH |
4) Fe(OH)2 |
5) NH4OH |
|||||
13. С кислотами и щелочами взаимодействует оксид? |
|
|
|
||||||||||
1) |
хрома (VI) |
2) |
магния |
|
3) |
хрома (II) |
|
|
4) хрома (III) |
||||
14. |
Эквивалент перманганата калия, если ион MnO-4 восстанавливается до Mn+2, равен ____. |
||||||||
|
1) |
1/5 |
|
2) 1/2 |
3) |
1/3 |
4) |
1/4 |
|
15. |
Определите значение фактора эквивалентности для КMnO4 в кислой среде. |
||||||||
|
1) |
1/2 |
2) |
1/5 |
3) |
3/4 |
4) |
1,5 моль |
|
16.Как меняется химическая активность d-элементов побочных подгрупп в направлении сверху вниз?
1)возрастает2) не изменяется 3) уменьшается 4) изменяется дискретно
17.Какой оксид обладает основными свойствами?
1) FeО3 |
2) CO2 |
3) P2O5 |
4) FeO |
5) SO3 |
64
|
|
|
|
|
65 |
|
|
18. |
Гидроксид хрома (III) Сг(ОН)3 может проявлять в окислительновосстановительных |
||||||
реакциях свойства ____________. |
|
|
|
|
|||
1) только окислителя |
|
3) и окислителя, и восстановителя |
|||||
2) только восстановителя |
|
4) ни окислителя, ни восстановителя |
|||||
19. |
Для ослабления процесса гидролиза хлорида железа (III) к раствору добавляют___. |
||||||
|
1) HCl |
2) Cl2 |
3) KOH |
|
4) H2O |
||
20. |
Сильным электролитом является водный раствор_______. |
||||||
|
1) |
оксида углерода (IV) |
|
3) |
оксида углерода (II) |
||
|
2) |
этанола |
|
|
4) |
хлорида меди (II) |
|
21. |
Хлорид меди (II) образуется при действии соляной кислоты на_________. |
||||||
|
1) CuO |
2) CuBr2 |
|
3) Cu |
4) CuCO3 |
||
22. |
Одним из продуктов гидролиза нитрата железа (III) по второй ступени является____. |
||||||
|
1) Fe(OH)3 |
2) FeOH(NO3)2 |
3) |
FeOH(NO3 |
4) Fe(OH)2NO3 |
||
Занятие 1.2.4.
ТЕМА: Физико-химия поверхностных явлений в функционировании живых систем ЦЕЛЬ: Изучить явление адсорбции, применение адсорбционных процессов в медицине
ЗНАТЬ:
1.Поверхностная энергия Гиббса и поверхностное натяжение.
2.Явление адсорбции. Понятие адсорбента и адсорбтива.
3.Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Уравнение Гиббса. Поверхностно-активные и поверхностно-неактивные вещества.
4.Изотерма поверхностного натяжения. Поверхностная активность. Правило Дюкло-Траубе.
5.Изотерма адсорбции. Ориентация молекул в поверхностном слое и структура биомембран.
6.Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твёрдых телах. Адсорбция из растворов. Уравнение Лэнгмюра. 7.Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция.
1.Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применение в медицине ионитов.
2.Мицеллообразование в растворах ПАВ. Определение критической концентрации мицелообразования. Липосомы.
УМЕТЬ:
1.Самостоятельно пользоваться учебной и справочной литературой.
2.Подбирать адсорбент для адсорбции веществ из полярных и неполярных растворителей.
3.Разделять катионы методом бумажной и колоночной хроматографии.
4.Решать типовые расчётные задачи.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками безопасной работы в химической лаборатории.
3.Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №8 «Адсорбционные процессы»
Основные уравнения по теме: «Физико-химия поверхностных явлений в функционировании живых систем»
65
|
|
|
|
|
|
|
|
|
66 |
||
1. |
g - |
d |
|
|
|
|
|
поверхностная активность |
|||
dC |
|
|
|||||||||
|
|
|
|
|
|
|
|
||||
2. |
Г |
|
С |
|
2 1 относительная адсорбция на подвижных поверхности раздела фаз |
||||||
|
|
|
|||||||||
|
|
|
|
RT |
|
|
C2 C1 |
||||
|
|
|
|
|
|
|
|
|
|
|
(уравнение Гиббса) |
3. |
S0 |
|
|
|
|
|
1 |
|
|
расчёт площади одной молекулы занимаемой в адсорбционном слое |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
Г |
N А |
|||||
|
|
|
|
|
|
|
|
|
|
||
4. |
l |
Г М |
|
|
расчёт толщины одной молекулы |
||||||
|
|
|
ρ |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
5. |
Г Г |
|
|
С |
|
|
расчёт адсорбции жидких веществ твёрдыми поверхностями |
||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
К |
С |
|||||
|
|
|
|
|
|
|
|
|
|
|
(уравнение Ленгмюра) |
6) |
Г Г |
|
|
Р |
|
|
расчёт адсорбции газообразных веществ твёрдыми поверхностями |
||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
К |
|
Р |
||||
|
|
|
|
|
|
|
|
|
|
|
(ур-ние Ленгмюра) |
7) |
Г = Кф×Сn |
|
|
уравнение Фрейндлиха |
|||||||
Обучающие задачи.
Задача 1. Определить величину адсорбции при 100С для раствора, содержащего 0,05 г в литре нонановой (пеларгоновой) кислоты C8H17COOH. Поверхностное натяжение воды при данной температуре 74,2 10-3 н/м, а исследуемого раствора 57 10-3 Н/м Решение: Уравнение Гиббса для адсорбции на границе жидкость-газ имеет вид:
Г |
С |
|
2 |
1 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
RT |
C2 |
C1 |
|
|
|
|
|||
Определяем концентрацию кислоты в растворе |
|
||||||||||||
C |
n |
|
|
m |
|
|
0,05г |
|
|
0,0003моль/л |
|
||
|
|
|
|
|
|
|
|
||||||
V |
|
MV 158г/моль 1л |
|
||||||||||
Г |
|
|
0,0003г/ммол |
|
(57 10 3 Н/м - 74,2 10-3 Н/м) |
7,3 10 6 моль/м2 |
|||||||
8,31Д,31ДжьК 283К |
|
||||||||||||
|
|
|
|
0,0003м,00 /л - 0 |
|
||||||||
Ответ: Г=7,3×10-6 моль/м2
Задача 2. Пользуясь правилом Дюкло-Траубе, определите во сколько раз поверхностная активность пальмитиновой кислоты (С15Н31СООН) меньше поверхностной активности арахиновой кислоты (С19Н39СООН).
Решение: Согласно правилу Дюкло-Траубе - при увеличении углеводородного радикала на одну метиленовую группу -СН2- поверхностная активность увеличивается в 3,2 раза, то в нашем случае
G С15Н31СООН
= 3,24 = 104,85 раза.
G С19Н39СООН
Ответ: увеличивается в 104,85 раза Задача 3. Найдите площадь, приходящуюся на одну молекулу в насыщенном адсорбционном
слое анилина на поверхности его водного раствора, если предельная адсорбция равна 6,0 10-6 моль/см2
Решение: |
S0 |
|
|
1 |
|
|
|
1 |
|
2,7 10 19 |
см2 |
|
|
|
|
|
|
||||||
Г |
N |
|
6,0 10 6 |
моль/см2 6,02 1023 |
моль 1 |
||||||
|
|
|
А |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: S0= 2,7×10-19 см2
66

67
Задание 4. Опишите поведение приведенных ниже структур в системе вода-липид. В каком качестве они применяются медицине (в хирургии, в частности).
I – бензалкония хлорид (N-бензил-N, N-диметил-N- октадецил аммония хлорид); II –цистеинилэтил-N, N -диметил-N-цетил аммония хлорид
|
|
|
|
|
|
|
CH |
|
H2 |
|
|
H2 |
|
|
H2 |
|
H2 |
|
H2 |
H2 |
H2 |
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
C |
C |
C |
|
|
|
|||||
|
|
|
|
|
|
|
|
3 |
|
C |
|
|
C |
|
|
|
|
|
|
C |
CH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
CH2 |
N |
+ |
CH |
|
|
C |
|
|
C |
|
C |
C |
|
C |
C |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
H |
2 |
|
H |
|
H2 |
H |
|
H2 |
H2 |
H |
2 |
|
- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
Cl |
||
|
|
|
|
|
|
|
CH3 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
C |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H +N |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
HN |
CH2 CH3 H |
|
|
H |
|
H |
2 |
H |
H |
2 |
H2 |
H2 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
N+ |
2 |
|
|
|
2 |
|
|
2 |
|
C |
|
C |
|
|
|
|
|||
HS-CH2 |
|
|
|
C |
C |
|
|
C |
|
C |
|
C |
C |
|
|
|
|
CH3 |
|
|||||||
|
|
|
|
|
|
H2 |
|
|
|
|
|
|
C |
|
|
|
|
|
|
C |
C |
C |
|
|
|
|
|
|
|
|
|
|
H3C |
|
C |
|
C |
|
|
|
|
C |
|
C |
|
|
|
|
- |
||||
|
|
|
O |
|
|
H |
|
|
H |
|
|
|
H |
|
H2 |
H |
H |
2 |
|
2 Cl |
||||||
|
|
|
|
|
|
|
|
H |
2 |
2 |
|
2 |
|
H |
|
|
|
2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|||
2
Ответ: Соединения в своей структуре содержат катион (гидрофильный фрагмент молекулы, склонный растворяться в воде) (полярная головка) и длинный углеводородный «хвост», имеющий гидрофобные свойства (стремящийся максимально отдалиться от воды). В связи с особенностями своего строения соединения обладают дифильными свойствами. Они легко встраиваются в биологические мембраны вирусов и бактерий и способствуют их гибели за счет разрушения биологических мембран. Применяются в медицине, в том числе в хирургии, в качестве антисептических и фунгицидных средств.
Задачи для самостоятельной работы
Задача 1. Пользуясь правилом Дюкло-Траубе, определите во сколько раз поверхностная активность амилового спирта СН3(СН2)3СН2ОН больше поверхностной активности этилового спирта СН3СН2ОН.
Задача 2. Опредлите, во сколько раз поверхностная активность цетилового спирта (С16Н33ОН) больше поверхностной активности гептанола (С7Н15ОН).
Задача 3. Определите величину адсорбции водного раствора капроновой кислоты (С5Н11СООН) при 15оС, если ее концентрация составляет 0,25 моль/л, поверхностное натяжение раствора 35 10-3 Н/м, а поверхностное натяжение воды равно 73,4 10-3 Н/м.
Задача 4. Определите величину адсорбции водного раствора пеларгоновой кислоты (С8Н17СООН) при 10оС, если ее концентрация составляет 0,05 г/л, поверхностное натяжение воды при указанной температуре равно 74,2 10-3 Н/м, поверхностное натяжение раствора 57 10-3 Н/м.
Задача 5. Гmax для изоамилового спирта равна 7×10-6 моль/см2, молярная масса 88 г/моль, =0,81 г/см3. Определите толщину и площадь, занимаемую одной молекулой на поверхности раздела. Задача 6. Найдите площадь, приходящуюся на 1 молекулу в насыщенном адсорбционном слое анилина (С6Н5NH2) на поверхности его водного раствора, если предельная адсрбция равна 6,0 10-6 моль/см2.
|
|
|
|
Тестовые вопросы |
|
1. |
Какие вещества могут адсорбироваться на угле из крови при гемосорбции? |
||||
1) полярные |
2) неполярные |
|
3) малополярные |
||
2. |
Вещество, которое адсорбируется на поверхности адсорбента, называют_______. |
||||
|
1) |
катализатором; |
3) |
поверхностно-неактивным; |
|
|
2) |
адсорбатом; |
4) |
электролитом; |
|
3. При растворении поверхностно-активных веществ поверхностное натяжение____.
1) увеличивается; |
2) уменьшается; |
3) не изменяется; |
4) становится равным нулю. |
4. Площадь, занимаемая одной молекулой адсорбтива в насыщенном адсорбционном слое, определяется по формуле:
67
68
1) |
S0 |
1 |
; |
|
|
|
3) |
S 0 |
|
1 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||||||
|
σ 0 N A |
|
|
|
Γ max |
N A |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2) |
S |
|
Γ |
|
S |
|
N |
|
4) |
S |
|
|
Γ max M |
. |
|||
уд |
мах |
0 |
A |
0 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
ρ |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Выберите уравнение Лэнгмюра для расчёта адсорбции газообразных веществ:
1) Г Г
3) Г Г
мах
мах
|
С |
2) |
|
|
|
С |
|
|
К С |
С |
RT |
||||||
|
|
|
|
|||||
|
Р |
4) |
Г Kф С n |
|||||
К Р |
||||||||
|
|
|
|
|
|
|
||
6. Какой из растворителей будет лучше адсорбироваться на активированном угле:
1) |
ацетон ( = 20,7); |
2) вода ( = 80,9); |
2) |
хлороформ ( = 4,7); |
4) бутанол ( = 12,2) |
7. Подобрать адсорбент (уголь или МgО) и растворитель (вода (ε=80) или этанол (ε= 24)) для
адсорбции диэтилового эфира (ε=4,3). |
|
||
|
1) МgО и вода; |
2) уголь и вода; |
|
|
3) уголь и этанол; 4) МgО и этанол |
||
8. Характерной особенностью поверхностно-активных веществ является: |
|||
1) |
природное происхождение; |
2) |
дифильность; |
3) |
высокая летучесть; |
4) |
наличие окраски |
9. Зависимость величины |
адсорбции от равновесной |
концентрации или парциального |
||
давления называется _______адсорбции |
|
|
||
1) изохорой |
2) |
изотермой |
3) изобарой |
4) адиабатой |
10. Зависимость величины адсорбции от равновесной концентрации или парциального давления при постоянной температуре называется ___ адсорбции.
1) адиабатой |
2 изобарой |
3 изотермой |
4 изохорой |
||
11. Изотерму адсорбции описывают уравнением: |
|
||||
1) |
Ван-дер-Ваальса |
3) |
Аррениуса |
|
|
2) |
Лэнгмюра |
4) |
Смолуховского |
|
|
12. Какое определение подходит для характеристики поверхностно-активных веществ
(ПАВ)?
1)вещества, адсорбция которых на поверхности раздела фаз приводит к значительному повышению поверхностного натяжения
2)вещества, адсорбция которых на поверхности раздела фаз приводит к значительному понижению поверхностного натяжения
3)вещества, концентрирующиеся в объеме раствора, приводящие к значительному понижению поверхностного натяжения
4)вещества, адсорбирующиеся на поверхности раздела фаз и не влияющие на величину поверхностного натяжения
13.Что понимают под дифильностью структуры ПАВ ?
1)наличие в структуре гидрофильных групп и гидрофобных фрагментов
(длинноцепочечных радикалов)
68
69
2)наличие в структуре ионогенных групп
3)наличие в структуре длинноцепочечных радикалов (гидрофобных «хвостов»)
4)наличие в структуре катионов и анионов
14.Какое определение подходит для катионактивных ПАВ
1)молекулы ПАВ диссоциируют в водном растворе с образованием катиона с длинной гидрофобной цепью
2)молекулы ПАВ диссоциируют в водном растворе с образованием аниона, связанного с длинной гидрофобной цепью и катиона
3)молекулы ПАВ содержат 2 и более катиона, связанных с длинной гидрофобной цепью
4)молекулы ПАВ диссоциируют с образованием аммонийной и гидроксильной группы
15.Что понимается под поверхностной активностью?
1)способность вещества снижать поверхностное натяжение растворителя на границе раздела фаз
2)способность вещества изменять (снижать или увеличивать) поверхностное натяжение растворителя на границе раздела фаз
3)способность растворенного вещества снижать плотность раствора
4)способность вещества изменять оптические свойства раствора по сравнению с растворителем
16.По какой формуле определяется поверхностная активность?
1)производная поверхностного натяжения от концентрации ПАВ, взятая со знаком минус
2)отношение поверхностного натяжения к концентрации растворенного вещества
3)величина поверхностного натяжения, отнесенная к низкой концентрации ПАВ
4)отношение плотности раствора к концентрации растворенного ПАВ
17.Среди приведенных соединений выберите поверхностно-активное вещество__
1) |
глицерин |
3) |
сахароза |
2) |
фосфолипиды |
4) |
серная кислота |
18.Каким образом ориентированы молекулы фосфолипидов в биологических мембранах
1)образуют бислой с ориентацией полярных головок к водной фазе, а длинноцепочечных хвостов внутрь бислоя
2)образуют мономолекулярные слои с ориентацией длинноцепочечных хвостов к водной фазе внутри клетки
3)образуют мицеллы с ориентацией полярных головок внутрь надмолекулярной структуры
69
70
4) образуют бислой с ориентацией длинноцепочечных хвостов к водной фазе, а полярных
головок – внутрь бислоя
19. Укажите ответ, правильно отражающий применение ПАВ в медицине
1) |
в качестве дезодорантов |
3) |
в качестве смягчающих повязки веществ |
2) |
в качестве антисептиков |
4) |
в качестве инсектицидов |
20. Какое из приведенных поверхностно-активных веществ участвует в образовании
биологических мембран
1) |
п-додецилбензолсульфокислота |
2) |
бензалкония гидрохлорид |
3) |
фосфатидилхолин |
4) |
твин |
21. Каким образом согласно правила Дюкло-Траубе меняется поверхностная активность веществ одного гомологического ряда при увеличении углеводородной цепи на одну метиленовую группу (–СН2-) ?
1) |
увеличивается в 103 раз |
3) |
уменьшается в 9 раз |
2) |
увеличивается в 3 раза |
4) |
увеличивается в 9 раз |
22.Какое вещество называют адсорбентом
1)вещество, которое адсорбируется на поверхности твердого тела
2)твердое вещество, на поверхности которого происходит адсорбция
3)вещество, образующее нерастворимый комплекс с раствореным в растворе соединением
4)вещество, в котором растворяют поглотитель
23.Для наилучшей адсорбции растворенное неполярное вещество следует экстрагировать растворителем, характеризующимся
1) низкой полярностью |
3) высокой полярностью |
2)смесью растворителей с низкой и высокой полярностью; 4) водой
24.Укажите катионы, адсорбция которых на поверхности адсорбента, несущего
отрицательный заряд, будет наибольшей
1) |
К+ |
3) |
Cu2+ |
2) |
Fe3+ |
4) |
Cu+ |
25. Укажите анионы, которые будут лучше извлекаться адсорбентом, поверхность которого заряжена положительно?
1) |
PO43- |
3) |
S2- |
2) |
SO42- |
4) |
J- |
26. Укажите правильную формулировку правила выравнивания полярностей (правило Ребиндера)
1) чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже
адсорбируется, чем хуже растворяется – тем лучше адсорбируется
70
71
2)чем лучше в данном растворителе растворяется данный адсорбат, тем он лучше адсорбируется, чем хуже растворяется – тем хуже адсорбируется
3)подобное адсорбируется подобным
Занятие 1.2.5 ТЕМА Физико-химия дисперсных систем в функционировании живых систем
ЦЕЛЬ: Ознакомиться с методами получения и способами очистки коллоидных растворов. Для этого необходимо
ЗНАТЬ:
1.Классификация дисперсных систем (по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой).
2.Условия и методы получения коллоидных растворов. Особенности коллоидного состояния.
3.Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
4.Диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки.
5.Молекулярно-кинетические свойства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление, седиментационное равновесие.
6.Оптические свойства: рассеивания света (закон Рэлея).
7.Электрокинетические свойства: электрофорез и электроосмос, потенциал течения и седиментации. Электрокинетический потенциал и его зависимость от различных факторов.
8.Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей.
9.Коагуляция. Порог коагуляции, его определение. Правило Шульце-Гарди. Взаимная коагуляция. Коллоидная защита и пептизация в медицине.
10.Строение коллоидной частицы. Агрегат, гранула, адсорбционный и диффузный слой, мицелла.
УМЕТЬ:
1.Самостоятельно пользоваться учебной и справочной литературой.
2.Получать коллоидные растворы физическим (замены растворителя) и химическим методами (гидролиз солей).
3.Проводить очистку коллоидных растворов методом диализа.
4.Записывать структуру мицеллы золя, полученного различными способами.
5.Решать типовые расчётные задачи.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками безопасной работы в химической лаборатории.
3.Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №9 «Свойства коллоидных растворов»
Обучающие задачи
Задача 1. Напишите мицеллу BaSO4, стабилизированную раствором BaCl2. Определите заряд коллоидной частицы. К какому электроду при электрофорезе она будет двигаться?
Решение:
Na2SO4 + BaCl2(избыток) = BaSO4 + 2NaCl
Строение мицеллы:
71
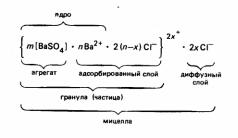
Коллоидная частица или гранула заряжена положительно и движется к катоду.
Упражнения для самостоятельной работы
Упражнение 1. Напишите строение мицеллы CuS, если при электрофорезе она движутся к катоду. Определите заряд гранулы.
Упражнение 2. Напишите строение мицеллы CaCO3, если при электрофорезе она движется к катоду. Определите заряд гранулы.
Упражнение 3. Какова структура мицелла золя, если при его приготовлении использованы серная кислота и избыток хлорида бария?
Упражнение 4. Напишите строение мицеллы AgJ, если при электрофорезе она движется к аноду. Определите заряд гранулы.
Упражнение 5. Какой из электролитов (FeCl3, CuCl2, NaCl) будут иметь наименьший порог коагуляции для золя, гранула которого движется к аноду.
Упражнение 6. Пороги коагуляции золя Fe(OH)3 для электролитов KJ и K2Cr2O7соответственно равны 10,0 и 0,195 ммоль/л. Во сколько раз коагулирующая способность бихромата калия больше, чем у иодида калия?
Упражнение 7. Пороги коагуляции некоторого золя различными электролитами (NaNO3, CaCl2, NaJ) соответственно равны 50,0 0,8 и 49 ммоль/л. Определите соль, которая будет обладать наибольшей коагулирующей способностью.
Упражнение 8. Какой из электролитов: KCl, Fe2(SO4)3, AlCl3, Na3PO4 будет иметь наименьший порог коагуляции для золя,полученного в результате взаимодействия H2SO4 и избытока BaCl2.
Тестовые вопросы 1. Коагуляцией называется______________.
1) процесс объединения коллоидных частиц в более крупные агрегаты вследствие потери агрегативной устойчивости; 2) процесс распада агрегата на коллоидные частицы;
3) процесс распада электолитов на ионы; 4) процесс перехода свежеполученного при коагуляции осадка в золь.
2. Какова структура мицеллы золя, если для его приготовления взяты Н2SO4 и избыток ВаСl2?
1){m BaSO4 n Ba+2 2(n-x) Cl-}2X+ 2х Cl-
2){m BaSO4 n SO42- 2(n-x) Н+}2X- 2х Н+
3){m BaSO4 n SO42- 2(n-x) Cl-}2X- 2х Н+
4){m BaSO4 n Ba+2 (n-x) SO42-}2X+ 2х SO42-
3.К какому электроду будет двигаться гранула СаСО3, имеющая положительный заряд?
|
1) |
аноду; |
3) |
не будет перемещаться; |
|
2) |
катоду; |
4) |
положительному электроду |
4. |
Какие части мицеллы движутся к электродам при электрофорезе? |
|||
|
1) |
агрегат; |
3) |
гранула; |
|
2) |
адсорбционный слой; |
4) |
ядро |
5. |
К каким растворам можно отнести цельную кровь? |
|||
|
1) |
истинные; |
3) |
грубодисперсные; |
|
2) коллоидные; |
4) молекулярные |
||
6. Что такое электроосмос?
1) это перемещение частиц дисперсионной среды относительно неподвижной дисперсной фазы под действием электрического тока;
72
73
2)это возникновение потенциала при перемещении частиц дисперсной фазы относительно дисперсионной сред;
3)это перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием электрического тока;
4)это взаимное перемещение частиц коллоидной системы под действием электрического тока;
7. Что такое электрофорез?
1)это перемещение частиц дисперсионной среды относительно дисперсной фазы под действием электрического тока;
2)это взаимное перемещение частиц коллоидной системы под действием электрического тока;
3) это перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием электрического тока; 4) это возникновение потенциала при перемещении частиц дисперсной фазы относительно дисперсионной среды.
8. В коллоидной частице, образующейся при взаимодействии избытка раствора нитрата серебра с раствором хлорида натрия, потенциалопределяющим является ион______.
1) Ag+ 2) Cl- 3) Na+ 4) NO3-
9. Для золя ВаSO4, полученного по реакции Ва(NO3)2 + Na2SO4 (изб) ↔ ВаSO4 + 2NaNO3 , наилучшим коагулирующим действием будет обладать ион ____.
1) Mg2+ 2) Fe3+ 3) K+ 4) Fe2+
10. Ион, адсорбирующийся на поверхности ядра и определяющий заряд коллоидной частицы
(гранулы), называется _______. |
|
1) коагулирующим |
3) дисперсионным |
2)потенциалопределяющим 4) поверхностным
11.Коагуляцию золя сульфата бария, полученного по реакции BaCl2 + K2SO4(изб) → BaSO4 +
2KCl, вызывают
1) нейтральные молекулы 2) катионы и анионы одновременно
3) анионы электролита |
4) катионы электролита |
12. При сливании равных объёмов 0,001М раствора AgNO3 и 0,002М раствора KI ядром мицеллы будет являться …
1) AgI |
2) KI |
3) AgNO3 |
4) KNO3 |
13. Среди приведенных веществ дисперсной системой является …
1) |
минеральная вода |
3) |
раствор сахара |
2) |
соленый раствор |
4) |
молоко |
14. Метод разделения, основанный на проникновении молекул и ионов через мембрану,
непроницаемую для коллоидных частиц, называется…
1) |
электрофорезом |
3) |
переносом |
2) |
диализом |
4) |
коацервацией |
15. Дым и туман относится к дисперсным системам типа…
1) |
золь |
3) |
суспензия |
2) |
аэрозоль |
4) |
эмульсия |
16. Коагуляция коллоидных растворов может протекать под действием…
73
