
федеральное государственное бюджетное образовательное учреждение высшего образования «Тюменский государственный медицинский университет»
Министерства здравоохранения Российской Федерации (ФГБОУ ВО ТюмГМУ Минздрава России)
Кафедра общей и биоорганической химии
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ПО ХИМИИ
для самостоятельной работы студентов лечебного и педиатрического факультетов
Тюмень, 2016 г.
2
Методическое пособие разработано: профессором Сторожок Н.М., доцентами Дарюхиной Е.Н., Медяник Н.П., Цымбал И.Н.
Настоящее пособие предназначено для самоподготовки студентов лечебного и педиатрического факультетов по курсу химии.
Методическое пособие включает положение о модульно рейтинговой системе по усвоению дисциплины Химия, тематические планы лекций и практических занятий, методические указания для студентов при подготовке к каждому занятию, решение типовых задач с приведением основных расчётных формул, список заданий для самостоятельного решения, список тем реферативных работ, списки основной и дополнительной литературы.
Утверждено ЦКМС ФГБОУ «Тюменский государственный медицинский университет» Министерства здравоохранения РФ « » ____________________ 2016 г.
2
3
Предисловие
Учебно-методическое пособие по курсу химии подготовлено с целью методического обеспечения самостоятельной работой студентов 1 курса лечебного и педиатрического факультетов.
Пособие включает положение о модульно-рейтинговой системе усвоения дисциплины «Химия», тематические планы лекций и практических занятий, методические указания для подготовки студентов, типовые задачи с решением, список заданий для самоподготовки, список тем реферативных работ, тесты для контроля уровня подготовки к занятию, список основной и дополнительной литературы.
В методических указаниях приведены теоретические вопросы по каждой теме, которые должны быть изучены студентами при подготовке к занятию. Традиционно при изучении химии наибольшую трудность представляет решение задач. В связи с этим в пособии представлено решение основных типов задач.
В материалах пособия по каждой теме приведены формулы математических уравнений, используемых для решения задач и тесты, самостоятельное выполнение которых позволит определить степень подготовленности студента к занятию. Упражнения, как правило, профилизированы и включают ситуации, с разрешением которых будущий врач может сталкиваться в своей практической деятельности.
В течение семестра каждый из студентов самостоятельно готовит реферат по избранной теме и докладывает его на соответствующем занятии. В пособии приведен примерный перечень рефератов по курсу химии, список литературы, необходимый для их подготовки. Студентам рекомендовано, при подготовке рефератов, использовать различные информационные ресурсы. Реферативные работы, как правило, оформляются и наиболее интересные из них участвуют в конкурсе рефератов.
Процесс изучения дисциплины Химия направлен на формирование следующих компетенций:
общекультурных компетенций (ОК):
-ОК-1 – способность к абстрактному мышлению, анализу, синтезу;
-ОК-5 – готовность к саморазвитию, самореализации, самообразованию, использованию творческого потенциала;
общепрофессиональных компетенций (ОПК):
-ОПК-7 - готовность к использованию основных физико-химических, математических и иных естественнонаучных понятий и методов при решении профессиональных задач;
Структура и содержание дисциплины (модуля)
Модульная единица 1.1. Основы химической термодинамики и кинетики, свойства растворов, редокс-процессы Модульная единица 1.2. Биологически активные неорганические соединения (строение,
свойства, участие в функционировании живых систем). Физико-химия поверхностных явлений и свойства дисперсных систем Модульная единица 1.3. Низкомолекулярные биорегуляторы и биологически активные
высокомолекулярные соединения (строение, свойства, участие в функционировании живых систем)
Общая трудоемкость дисциплины составляет 3 зачетные единицы 108 час
|
Вид учебной работы |
|
Всего часов |
|
Семестры |
|
|
|
I |
||
|
|
|
|
|
|
|
Аудиторные занятия (всего) |
|
72 |
|
|
|
|
|
|
|
|
|
В том числе: |
|
|
|
|
|
Лекции (Л) |
|
|
21 |
|
3
4
Практические занятия (ПЗ) |
|
|
|
|
|
|
|
|
Семинары (С) |
|
|
|
|
|
|
|
|
Лабораторные работы (ЛР) |
|
|
|
|
|
51 |
|
|
Самостоятельная работа (всего) |
|
|
36 |
|
|
36 |
|
|
В том числе: |
|
|
|
|
|
|
|
|
Реферат |
|
|
|
|
|
|
|
|
Вид промежуточной аттестации |
|
|
|
зачет |
|
зачет |
||
Общая трудоемкость: |
часы |
|
|
108 |
|
|
108 |
|
|
зачетные единицы |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Положение
о модульно-рейтинговой системе организации учебного процесса и оценки усвоения дисциплины Химия»
Система оценки знаний студентов проводится по 100 бальной шкале, где в 60 баллов оценивается освоение студентом основной образовательной программы, самостоятельная работа студентов, и другие виды работ, входящие в основную образовательную программу, 40 баллов отводится на итоговый контроль – зачет.
Для получения положительной итоговой (суммарной) оценки по дисциплине необходимо набрать не менее 41 балла.
Рейтинговая оценка по дисциплинарному модулю складывается из количества баллов, набранных за текущую работу (от 20 до 60 баллов) и полученных при итоговом контроле (от 11 до 40 баллов).
Согласно п. 4.8. «Положения о МРС организации учебного процесса» (ТюмГМА, 2012) преподаватель в соответствии с «Положением кафедры по МРС» может добавлять студенту за регулярную активную работу на всех практических занятиях до 10 баллов в каждом дисциплинарном модуле. При этом условием для добавления «премиальных» баллов рекомендуется считать следующий «текущий рейтинг» студента:
-36 – 38 баллов (от 60 до 64% успеваемости) – 6 премиальных баллов;
-39 – 41 балл (от 65 до 69% успеваемости) – 7 премиальных баллов;
-42 – 44 балла (70 - 74% успеваемости) – 8 премиальных баллов;
-45 – 47 баллов (75 - 79% успеваемости) - 9 премиальных баллов;
-48 баллов и выше (80% успеваемости и выше) - 10 премиальных баллов;
Студент, не изучивший одну и более модульных единиц, допускается к изучению следующих разделов и тем дисциплины в случае:
-если студент не изучил по уважительной причине, то ему предоставляется возможность добора баллов.
-если студент не изучил без уважительной причины, то ему предоставляется возможность добора баллов только с разрешения заведующего кафедрой, декана.
Студент обязан отчитаться по задолженностям за модули (по отдельным темам дисциплины) во время текущих консультаций или дополнительных занятий (отработок) по добору баллов до итогового контроля. Для дополнительных занятий преподавателями, ведущими практические (семинарские, лабораторные) занятия, выделяется время вне основного расписания.
Если студент желает повысить рейтинговую оценку по дисциплине в данном семестре, то он обязан заявить об этом преподавателю на последнем занятии. Дополнительная проверка знаний осуществляется преподавателем в течение недели, при этом преподаватель должен ориентироваться на те темы дисциплины, по которым студент набрал наименьшее количество баллов.
Полученные баллы вносятся в единую ведомость оценки успеваемости студентов (графа «Добор баллов»), включенную в информационную систему, и учитываются при определении рейтинговой оценки по календарному модулю. Если студент во время дополнительной проверки знаний не смог повысить рейтинговую оценку, то ему сохраняется количество баллов, набранных ранее.
4

5
Добор баллов - это проверка знаний студентов, желающих отчитаться по задолженностям или повысить свой рейтинг.
Для возможной компенсации баллов, потерянных при оценке текущей успеваемости студенту предоставляется комплект не обязательных контролирующих материалов, которые могут выполняться только по собственному желанию студента, причем вне графика обязательных занятий.
Для добора баллов студент может получить не более 10 заданий, каждое из которых имеет рейтинговую оценку не более 1 балла.
Максимум компенсационных баллов не может быть более 10, при этом величина рейтинга текущей успеваемости не может превышать установленный максимум (60 баллов).
Рейтинг текущей успеваемости включает оценки не менее чем по трем видам деятельности студентов: практическим умениям, теоретической подготовке, самостоятельной работе.
Самостоятельная работа студентов (СРС) является обязательной составной частью основной образовательной программы.
Рейтинг текущей успеваемости формируется только из оценок, полученных с первого раза. Максимальный рейтинг текущей успеваемости равен 60 баллам.
Пороговая величина рейтинга текущей успеваемости устанавливается на уровне не менее 20 баллов. Принимая во внимание, что для успешного освоения дисциплины важны все компоненты учебной деятельности (практические умения, теоретическая подготовка,
самостоятельная работа) условием допуска к зачёту является получение не менее 30% баллов за каждый установленный вид деятельности.
Допуском к экзаменационной сессии является сумма баллов, набранная студентом за дисциплинарный модуль и должна составлять от 20 до 60 баллов.
Студент, не набравший минимального количества рейтинговых баллов в дисциплинарном модуле (20-60) не допускается до зачета. Студенту предоставляется возможность добора баллов по дисциплинарному модулю в течение двух недель до начала сессии.
Зачётный рейтинг включает оценки по всем видам контроля подготовки студентов. Уровень, соответствующий удовлетворительным знаниям студента на зачёте составляет
не менее 11 баллов, при этом минимально допустимый уровень баллов за теоретическую подготовку и практические умения не может составлять менее 5 баллов.
Студент, получивший во время зачёта менее 11 баллов, направляется на пересдачу. Студент, не набравший в итоговом рейтинге 41 балл, должен пересдавать зачёт. Итоговый рейтинг – это итоговая интегрированная рейтинговая оценка знаний и умений
студентов по дисциплине в целом, складывающаяся из результатов текущего и итогового контроля по результатам зачета.
Для получения дифференцированного зачета сумма баллов итогового рейтинга должна составлять для оценки:
-«удовлетворительно» - 41-70 баллов;
-«хорошо» - 71-85 баллов;
-«отлично» - 86-100 баллов.
Рейтинг-план дисциплины
Дисциплинарный модуль
Название модульной единицы (темы занятий) |
Виды работ студента |
Число |
Примечание |
|
|
баллов |
|
Модульная единица 1.1. |
Теоретическая |
8,0 |
Максимальное |
«Основы химической термодинамики и |
подготовка |
|
число баллов |
кинетики, свойства растворов, редокс- |
Практические умения |
7,0 |
за модульную |
процессы» |
|
|
единицу 1.1. |
|
Самостоятельная |
3,5 |
18,5 |
|
работа |
|
|
5

6
|
Занятие 1.1.1. |
|
|
Практические умения: |
|
«5» - 1,0 |
||||
Введение в курс химии. Окислительно- |
программированный |
|
«5-» - 0,9 |
|||||||
восстановительные |
|
реакции. |
контроль |
0-1,0 |
«4» - 0,8 |
|||||
Электродные процессы. |
|
|
|
|
|
|
«4-» -0,7 |
|||
|
|
|
|
|
|
|
|
|
|
«3» - 0,6 |
|
|
|
|
|
|
|
|
|
|
«3-» - 0,3 |
|
|
|
|
|
|
|
|
|
|
«2» - 0 |
|
Занятие 1.1.2. |
|
|
Практические умения: |
|
«5» - 2,0 |
||||
Основы химической термодинамики и |
программированный |
|
«5-» - 1,8 |
|||||||
биоэнергетики. |
|
Термодинамика |
контроль |
|
«4» -1,6 |
|||||
химического равновесия. |
|
|
|
|
|
0-2,0 |
«4-» -1,4 |
|||
Лабораторная работа №1. |
|
|
|
|
|
|
«3» - 1,2 |
|||
«Качественные опыты по химическому |
|
|
|
«3-» - 0,6 |
||||||
равновесию» |
|
|
|
|
|
|
|
|
«2» - 0 |
|
|
|
|
|
|
|
|
Практические умения: |
0 - 0,5 |
«5» - 0,5 |
|
|
|
|
|
|
|
|
выполнение |
|
«4» -0,45 |
|
|
|
|
|
|
|
|
лабораторной работы и |
|
«4-» - 0,4 |
|
|
|
|
|
|
|
|
оформление протокола |
|
«3» -0,3 |
|
|
|
|
|
|
|
|
|
|
|
«3-» -0,15 |
|
|
|
|
|
|
|
|
|
|
«2» - 0 |
|
Занятие 1.1.3. |
|
|
Практические умения: |
0-1,0 |
|
||||
Растворы. |
Коллигативные свойства |
программированный |
|
|
||||||
растворов. |
Лабораторная |
работа |
№2 |
контроль |
|
|
||||
«Определение |
|
осмотической |
Практические умения |
0-0,5 |
|
|||||
концентрации |
и |
изотонического |
|
|
|
|
||||
коэффициента раствора электролита» |
|
|
|
|
||||||
|
Занятие 1.1.4. |
|
|
Практические умения: |
0-1,0 |
|
||||
Протолитические |
реакции. Буферные |
программированный |
|
|
||||||
растворы. |
|
|
|
|
|
|
контроль |
|
|
|
Лабораторная работа №3 «Свойства |
Практические умения |
0-0,5 |
|
|||||||
буферных растворов» |
|
|
|
|
|
|
|
|
||
|
Занятие 1.1.5. |
|
|
Практические умения |
0-0,5 |
|
||||
Химическая кинетика и катализ. |
|
|
|
|
||||||
Лабораторная работа №4. «Изучение |
|
|
|
|
||||||
зависимости скорости |
реакции |
от |
|
|
|
|
||||
концентрации и температуры» |
|
|
|
|
|
|
||||
Тестирование по модульной единице |
Теоретическая |
0-8,0 |
«5» - 8,0 |
|||||||
|
|
1.1. |
|
|
|
|
подготовка |
|
«5-» - 7,2 |
|
|
|
|
|
|
|
|
|
|
|
«4» -6,4 |
|
|
|
|
|
|
|
|
|
|
«4-» -5,6 |
|
|
|
|
|
|
|
|
|
|
«3» - 4,8 |
|
|
|
|
|
|
|
|
|
|
«3-» - 2,4 |
|
|
|
|
|
|
|
|
|
|
«2» - 0 |
|
|
|
|
|
|
|
Самостоятельная |
0 - 3,5 |
«5» - 3,5 |
|
|
|
|
|
|
|
|
работа |
|
«5-» - 3,15 |
|
|
|
|
|
|
|
|
|
|
|
«4» -2,8 |
|
|
|
|
|
|
|
|
|
|
«4-» -2,45 |
|
|
|
|
|
|
|
|
|
|
«3» - 2,1 |
|
|
|
|
|
|
|
|
|
|
«3-» - 1,05 |
|
|
|
|
|
|
|
|
|
|
«2» - 0 |
Название модульной единицы (темы занятий) |
|
Виды работ студента |
|
Число |
Примечание |
|||||
|
|
|
|
|
|
|
|
|
баллов |
|
|
|
|
|
|
|
|
|
|
|
|
6
7
Модульная единица 1.2. |
|
Теоретическая |
8,0 |
Максимальное |
||||
«Биологически активные |
|
подготовка |
|
число баллов |
||||
неорганические соединения (строение, |
|
|
за модульную |
|||||
Практические умения |
6,5 |
|||||||
|
свойства, участие в |
|
|
единицу 1.2. |
||||
|
|
|
|
|
||||
функционировании живых систем). |
|
|
18,0 |
|||||
Физико-химия поверхностных явлений |
|
|
|
|||||
Самостоятельная |
3,5 |
|
||||||
и свойства дисперсных систем» |
|
|
||||||
|
работа |
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
Занятие 1.2.1. |
|
|
Практические |
|
«5» - 1,0 |
||
Химия биогенных элементов. Химия |
умения: |
|
«5-» - 0,9 |
|||||
биогенных элементов s-блока. |
|
|
программированный |
|
«4» - 0,8 |
|||
Лабораторная работа №5 «Химические |
контроль |
0-1,0 |
«4-» -0,7 |
|||||
свойства S-элементов, их применение |
|
|
«3» - 0,6 |
|||||
в медицине» |
|
|
|
|
|
«3-» - 0,3 |
||
|
|
|
|
|
|
|
«2» - 0 |
|
|
|
|
|
|
Практические умения |
0-0,5 |
«5» - 0,5 |
|
|
|
|
|
|
выполнение |
|
«4» -0,45 |
|
|
|
|
|
|
лабораторной работы |
|
«4-» - 0,4 |
|
|
|
|
|
|
и оформление |
|
«3» -0,3 |
|
|
|
|
|
|
протокола |
|
«3-» -0,15 |
|
|
|
|
|
|
|
|
«2» - 0 |
|
|
Занятие 1.2.2. |
|
|
Практические умения |
0-1,0 |
|
||
Химия биогенных элементов р-блока. |
|
|
|
|||||
Лабораторная работа №6 «Химические |
|
|
|
|||||
Практические умения |
0-0,5 |
|
||||||
свойства |
р-элементов |
и |
их |
|
||||
|
|
|
||||||
соединений» |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
Занятие 1.2.3. |
|
|
Практические умения |
0-1,0 |
|
||
Химия биогенных элементов d-блока. |
|
|
|
|||||
Практические умения |
0-0,5 |
|
||||||
Лигандообменные процессы. Строение |
|
|||||||
|
|
|
||||||
металлоферментов, |
биокомплексных |
|
|
|
||||
соединений. |
|
|
|
|
|
|
||
Лабораторная работа №7 «Химические |
|
|
|
|||||
Общие свойства d-элементов» |
|
|
|
|
|
|||
|
Занятие 1.2.4. |
|
|
Практические умения |
0-1,0 |
|
||
Физико-химия поверхностных явлений |
|
|
|
|||||
Практические умения |
0-0,5 |
|
||||||
в функционировании живых систем. |
|
|||||||
|
|
|
||||||
Лабораторная |
работа |
|
№8 |
|
|
|
||
«Адсорбционные процессы» |
|
|
|
|
|
|||
|
Занятие 1.2.5. |
|
|
Практические умения |
0-0,5 |
|
||
Физико-химия дисперсных систем в |
|
|
|
|||||
функционировании |
живых |
систем. |
|
|
|
|||
Лабораторная работа №9 «Свойства |
|
|
|
|||||
коллоидных растворов» |
|
|
|
|
|
|||
Тестирование по модульной единице |
Теоретическая |
0-8,0 |
«5» - 8,0 |
|||||
|
1.2. |
|
|
|
подготовка |
|
«5-» - 7,2 |
|
|
|
|
|
|
|
|
«4» -6,4 |
|
|
|
|
|
|
|
|
«4-» -5,6 |
|
|
|
|
|
|
|
|
«3» - 4,8 |
|
|
|
|
|
|
|
|
«3-» - 2,4 |
|
|
|
|
|
|
|
|
«2» - 0 |
|
7

8
|
|
|
|
Самостоятельная |
0-3,5 |
«5» - 3,5 |
|
|
|
|
работа |
|
«5-» - 3,15 |
|
|
|
|
|
|
«4» -2,8 |
|
|
|
|
|
|
«4-» -2,45 |
|
|
|
|
|
|
«3» - 2,1 |
|
|
|
|
|
|
«3-» - 1,05 |
|
|
|
|
|
|
«2» - 0 |
|
|
|
|
|||
Название модульной единицы (темы занятий) |
Виды работ студента |
Число |
Примечание |
|||
|
|
|
|
|
баллов |
|
|
|
|
|
|||
Модульная единица 1.3. |
Теоретическая |
8,0 |
Максимальное |
|||
Низкомолекулярные биорегуляторы и |
подготовка |
|
число баллов |
|||
биологически |
|
|
активные |
Практические умения |
8,0 |
за модульную |
высокомолекулярные |
|
соединения |
|
|
единицу 1.3. |
|
(строение, свойства, участие в |
Самостоятельная |
5,0 |
21,0 |
|||
функционировании живых систем) |
работа |
|
|
|||
Занятие 1.3.1. |
|
Практические |
|
«5» - 1,0 |
||
Полифункциональные |
|
соединения |
умения: |
|
«5-» - 0,9 |
|
(многоатомные спирты и фенолы, |
программированный |
0-1,0 |
«4» - 0,8 |
|||
полиамины, двухосновные карбоновые |
контроль |
|
«4-» -0,7 |
|||
кислоты). |
|
|
|
|
|
«3» - 0,6 |
Лабораторная работа №10 «Свойства |
|
|
«3-» - 0,3 |
|||
одно-и многоатомных спиртов и |
|
|
«2» - 0 |
|||
фенолов» |
|
|
|
Практические |
|
«5» - 0,5 |
|
|
|
|
умения: выполнение |
0-0,5 |
«4» -0,45 |
|
|
|
|
лабораторной работы |
|
«4-» - 0,4 |
|
|
|
|
и оформление |
|
«3» -0,3 |
|
|
|
|
протокола |
|
«3-» -0,15 |
|
|
|
|
|
|
«2» - 0 |
Занятие 1.3.2. |
|
Практические умения |
0-1,0 |
|
||
Гетерофункциональные |
|
соединения |
|
|
|
|
(аминоспирты, |
|
|
гидрокси- |
|
|
|
аминокислоты, оксокислоты) |
|
|
|
|||
Занятие 1.3.3. |
|
Практические умения |
0-1,0 |
|
||
Биологически |
важные |
ароматические |
|
|
|
|
и гетероциклические соединения |
|
|
|
|||
Занятие 1.3.4. |
|
Практические умения |
0-1,0 |
|
||
Важнейшие α-аминокислоты пептиды. |
|
|
|
|||
Лабораторная |
работа |
№11 |
Практические умения |
0-0,5 |
|
|
«Химические |
методы |
обнаружения |
|
|
|
|
аминокислот и белков» |
|
|
|
|
|
|
Занятие 1.3.5. |
|
Практические умения |
0-1,0 |
|
||
Углеводы. Монозы, биозы. |
|
|
|
|
||
|
Практические умения |
0-0,5 |
|
|||
Лабораторная |
работа |
№12 |
|
|||
|
|
|
||||
«Качественные реакции на углеводы и |
|
|
|
|||
их функциональные группы» |
|
|
|
|||
Занятие 1.3.6. |
|
Практические умения |
0-1,0 |
|
||
Нуклеиновые кислоты. |
|
|
|
|
|
|
|
|
Практические умения |
0-0,5 |
|
||
Лабораторная |
работа |
№13 |
|
|||
|
|
|
||||
«Определение |
|
|
состава |
|
|
|
нуклеопротеидов» |
|
|
|
|
|
|
8
9
|
|
Занятие 1.3.7. |
|
|
|
Теоретическая |
|
0-8,0 |
|
«5» - 8,0 |
|
|
||||||
|
Высшие жирные кислоты. Липиды. |
|
|
подготовка |
|
|
|
|
«5-» - 7,2 |
|
|
|||||||
|
Тестирование по модульной единице |
|
|
|
|
|
|
|
|
«4» -6,4 |
|
|
||||||
|
|
1.3. |
|
|
|
|
|
|
|
|
|
|
|
|
«4-» -5,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3» - 4,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3-» - 2,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«2» - 0 |
|
|
|
|
|
|
|
|
|
|
Самостоятельная |
|
0-5,0 |
|
«5» - 5,0 |
|
|
||||
|
|
|
|
|
|
|
|
|
работа |
|
|
|
|
«5-» - 4,5 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4» -4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4-» -3,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3» - 3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3-» - 1,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«2» - 0 |
|
|
|
|
|
Реферат |
|
|
|
|
|
|
|
|
0 – 2,5 |
|
«5» - 2,5 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4» - 2,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3» - 1,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«2» - 0,0 |
|
|
|
|
|
|
Итоговая таблица дисциплинарного модуля |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Максимальное |
|
Минимальное |
|||||
|
|
|
|
|
|
|
|
|
|
|
количество |
|
количество баллов |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
баллов |
(30%) |
|
|
|||
|
|
|
|
|
|
|
Теоретическая |
|
|
24,0 |
|
8,0 |
|
|
||||
|
|
ИТОГО |
|
|
|
подготовка |
|
|
|
|
|
|
|
|
|
|||
|
по видам деятельности |
|
|
Практические |
|
|
21,5 |
|
7,0 |
|
|
|||||||
|
дисциплинарного модуля 1. |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
умения |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Самостоятельная |
|
|
12,0 |
|
4,0 |
|
|
||||
|
|
|
|
|
|
|
|
работа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реферат |
|
|
2,5 |
|
1,0 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Всего |
|
|
|
|
|
|
|
|
60 |
|
20 |
|
|
|||
|
за дисциплинарный модуль 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Зачётный рейтинг |
|
|
|
|
|
|
|
||||
1. |
|
Итоговое тестирование |
|
0-30,0 |
|
|
|
«5» - 30,0 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«5-» - 27,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4» - 24,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4-» - 21,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3» - 18,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3-» - 9,0 |
|
|
|
2. |
|
Практические умения: |
|
0-5,0 |
|
|
|
«5» - 5,0 |
|
|
||||||||
|
|
|
1. |
решение |
расчётных |
|
|
|
|
|
|
«5-» - 4,5 |
|
|
||||
|
|
|
задач – 5 баллов; |
|
|
|
|
|
|
|
|
|
|
«4» - 4,0 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4-» - 3,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3» - 3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«3-» - 1,5 |
|
|
|
|
|
|
2. |
написание |
|
|
химизма |
|
0-5,0 |
|
|
|
«5» - 5,0 |
|
|
|||
|
|
|
качественных реакций. |
|
|
|
|
|
|
«5-» - 4,5 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4» - 4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
«4-» - 3,5 |
|
|
|
9

10
«3» - 3,0 «3-» - 1,5
ИТОГО |
40 баллов |
Другие виды деятельности: Добор баллов:
Студенты желающие повысить свой рейтинг, могут осуществить добор баллов. Занятия со студентами проводится в течение 2 недель до начала сессии по графику, утвержденному заведующим кафедрой.
Для добора баллов студент может получить не более 10 заданий.
Максимальное количество баллов за каждое выполненное задание - 1 балл.
|
|
1) Тестовые задания по темам занятий: |
2) Ситуационные задачи по темам |
|||
|
|
«5» - 1,0 |
|
занятий: «5» - 1,0 |
|
|
|
|
«5-» - 0,9 |
|
«5-» - 0,9 |
|
|
|
|
«4» - 0,8 |
|
«4» - 0,8 |
|
|
|
|
4-» -0,7 |
|
«4-» -0,7 |
|
|
|
|
«3» - 0,6 |
|
«3» - 0,6 |
|
|
|
|
«3-» - 0, 3 |
|
«3-» - 0,3 |
|
|
|
|
|
Перевод баллов итогового рейтинга в оценку |
|
||
|
|
|
Оценка |
|
Итоговый рейтинг |
|
|
|
|
«Отлично» («5») |
|
86 - 100 баллов |
|
|
|
|
|
|
|
|
|
|
|
«Хорошо» («4») |
|
71 - 85 баллов |
|
|
|
|
|
|
|
|
|
|
|
«Удовлетворительно» («3») |
|
41 - 70 баллов |
|
|
|
|
|
|
|
|
|
|
|
«Неудовлетворительно» («2») |
|
40 и менее баллов |
|
|
|
|
|
|
|
|
|
|
|
Тематический план лекций |
|
||
|
|
|
|
|
||
|
№ |
|
Тематика лекции |
часы |
||
|
п/п |
|
|
|
|
|
Модульная единица 1.1. Основы химической термодинамики и кинетики, свойства
растворов, редокс-процессы
1 |
|
Введение в предмет. Элементы химической термодинамики и биоэнергетики. |
|
2 |
|
|
Химическое равновесие. |
|
|
2 |
|
Роль воды в жизнедеятельности организма. Теория растворов электролитов и |
|
2 |
|
|
неэлектролитов. Коллигативные свойства растворов. |
|
|
3 |
|
Протолитические реакции. Буферные системы организма. Гидролиз солей. |
|
2 |
4 |
|
Основы химической кинетики катализа |
|
2 |
|
|
Модульная единица 1.2. Биологически активные неорганические соединения |
|
|
|
(строение, свойства, участие в функционировании живых систем). Физико-химия |
|||
|
|
поверхностных явлений и свойства дисперсных систем |
|
|
5 |
|
Биогенные элементы. Комплексные соединения. Лигандообменные |
|
2 |
|
|
процессы. Строение металлоферментов, биокомплексных соединений. |
|
|
|
|
Хелатотерапия. |
|
|
6 |
|
Физико-химия поверхностных явлений в функционировании живых систем. |
|
2 |
10
11
Свойства дисперсных систем
Модульная единица 1.3. Низкомолекулярные биорегуляторы и биологически активные высокомолекулярные соединения (строение, свойства, участие в функционировании живых систем)
7 |
Поли-и гетерофункциональные соединения |
2 |
8 |
Важнейшие α-аминокислоты, пептиды |
2 |
9 |
Высшие жирные кислоты. Липиды |
2 |
10 |
Углеводы. Монозы, биозы |
2 |
11 |
Биологически важные ароматические и гетероциклические соединения. |
2 |
|
Нуклеиновые кислоты |
|
Тематический план лабораторных и практических занятий
№ |
Тематика занятий |
час |
занятия
Модульная единица 1.1.
Основы химической термодинамики и кинетики, свойства растворов, редокс-процессы
1.1.1.Введение в курс химии. Окислительно-восстановительные реакции. 3 Электродные процессы.
1.1.2. |
Основы химической термодинамики и биоэнергетики. Термодинамика |
3 |
||||
|
химического равновесия. Лабораторная работа №1 «Качественные опыты |
|
||||
|
по химическому равновесию» |
|
|
|
|
|
1.1.3. |
Растворы. Коллигативные свойства растворов. Лабораторная работа №2 |
3 |
||||
|
«Определение |
осмотической |
концентрации |
и |
изотонического |
|
|
коэффициента раствора электролита» |
|
|
|
||
1.1.4 |
Протолитические реакции. Буферные растворы. Лабораторная работа № 3 |
3 |
||||
|
«Свойства буферных растворов». |
|
|
|
|
|
1.1.5. |
Химическая кинетика и катализ. Лабораторная работа №4 «Изучение |
3 |
||||
|
зависимости скорости реакции от концентрации и температуры». |
|
||||
|
Тестирование по модульной единице 1.1. |
|
|
|
||
Модульная единица 1.2.
Биологически активные неорганические соединения (строение, свойства, участие в функционировании живых систем). Физико-химия поверхностных явлений и свойства дисперсных систем
1.2.1.Химия биогенных элементов. Химия биогенных элементов s-блока. 3 Лабораторная работа №5 «Химические свойства s-элементов, их применение в медицине».
1.2.2.Химия биогенных элементов p-блока. Лабораторная работа №6 3 «Химические свойства p-элементов и их соединений».
1.2.3.Химия биогенных элементов d-блока. Лигандообменные процессы. 3 Строение металлоферментов, биокомплексных соединений. Лабораторная работа №7 «Химические свойства d-элементов».
1.2.4. Физико-химия поверхностных явлений в функционировании живых |
3 |
систем. Лабораторная работа №8 «Адсорбционные процессы» |
|
1.2.5.Физико-химия дисперсных систем в функционировании живых систем. 3 Лабораторная работа №9 «Свойства коллоидных растворов». Тестирование по модульной единице 1.2.
Модульная единица 1.3. Низкомолекулярные биорегуляторы и биологически активные высокомолекулярные соединения (строение, свойства, участие в функционировании живых систем)
11
12
1.3.1. |
Полифункциональные соединения (многоатомные спирты и фенолы, |
3 |
|||
|
полиамины, двухосновные карбоновые кислоты). Лабораторная работа |
|
|||
|
№10 «Свойства одно-и-многоатомных спиртов и фенолов» |
|
|
||
1.3.2. |
Гетерофункциональные |
соединения |
(аминоспирты, |
гидрокси-и |
3 |
|
аминокислоты, оксокислоты. |
|
|
|
|
1.3.3. |
Биологически важные ароматические и гетероциклические соединения. |
3 |
|||
1.3.4. |
Важнейшие α-аминокислоты, пептиды. |
Лабораторная |
работа №11 |
3 |
|
|
«Химические методы обнаружения аминокислот и белков» |
|
|
||
1.3.5. |
Углеводы. Лабораторная работа №12 «Качественные реакции на углеводы |
3 |
|||
|
и их функциональные группы» |
|
|
|
|
1.3.6. |
Нуклеиновые кислоты. Лабораторная работа №13 «Определение состава |
3 |
|||
|
нуклеопротеидов». Зачёт: практические умения |
|
|
||
1.3.7. |
Высшие жирные кислоты. Липиды. Тестирование по модульной единице |
3 |
|||
|
1.3. |
|
|
|
|
|
Зачёт: теоретическая подготовка (итоговое тестирование) |
|
|
||
Основная литература (О.Л.)
1.Общая химия. Учебник. (А.В. Жолнин; под ред. В.А. Попкова, А.В. Жолнина). – М.: ГЭОТАРМедиа, 2012. – 400 с.
2.Биоорганическая химия: учебник /Н.А Тюкавкина., Ю.И. Бауков, С.Э.Зурабян.- М.: ГЭОТАРМедиа, 2015– 416 с.
Дополнительная литература
1.Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. (Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др.; Ред.Ю.А.Ершов), М.: Высш. шк., 2002 г. -
560с.
2.Биоорганическая химия: учебник /Н.А. Тюкавкина, Ю.И. Бауков, С.Э. Зурабян. - М.: ГЭОТАРМедиа, 2010. – 416 с.
3.Биоорганическая химия: руководство к практическим занятиям /ред. Н.А. Тюкавкина.- М.: ГЭОТАР-Медиа, 2010.-168с.
4.Сборник задач и упражнений по общей химии: учебное пособие для вузов /С.А. Пузаков, В.А. Попков, А.А. Филиппова. – 5-е изд., перераб. И доп. - М.: Изд-во Юрайт, 2014 г.- 255 с.
5.ХИМИЯ общая и биоорганическая. Учебник (К.Н. Зеленин, В.В. Алексеев). – СПб., ЭЛБИ-СПб., 2003. – 712 с.
6.Базы данных, информационно-справочные и поисковые системы интернет ресурсы, отвечающие тематике дисциплины, в том числе: -Сhemlib.ru, Chemist.ru, ACD Labs, MSU.Chem.ru
Модульная единица 1.1. Основы химической термодинамики и кинетики, свойства растворов, редокс-процессы
ЗАНЯТИЕ 1.1.1 ТЕМА: Окислительно – восстановительные реакции. Электродные процессы.
ЦЕЛЬ: Закрепить школьные знания по окислительно - восстановительным реакциям, обсудить их значение для медицины. Изучить основы электрохимии.
ЗНАТЬ:
1.Окислительно – восстановительные реакции. Степень окисления. Классификацию окислительно– восстановительных реакций.
2.Окислители и восстановители. Процесс окисления и восстановления.
3.Электролиз. Электролиз расплавов. Процесс на катоде и на аноде.
4.Электролиз растворов на инертных электродах. Электродные процессы на катоде и на аноде. Суммарное уравнение процесса. Закон Фарадея.
5.Гальванические элементы. Элемент Даниэля – Якоби. Строение. Краткая запись.
12
13
6.Процессы на катоде и на аноде. ЭДС гальванического элемента. Электродные потенциалы. Формула Нернста.
7.Определение электродных потенциалов. Водородный электрод. Формула Нернста. Ряд напряжения металлов.
8.Аккумуляторы. Примеры. Процессы при работе свинцового аккумулятора.
9.Электрохимическая коррозия. Анодное и катодное покрытие.
УМЕТЬ:
1.Анализировать информацию, используя учебную и справочную литературу.
2.Методом электронного баланса подбирать коэффициенты в окислительно-восстановительных реакциях.
3.Записывать процессы, протекающие на электродах при электролизе расплавов, растворов солей, кислот и щелочей.
4.Рассчитывать электродвижущую силу (ЭДС) гальванических элементов.
ВЛАДЕТЬ:
1. Навыками самостоятельной работы с учебной и справочной литературой
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно – восстановительными реакциями (ОВР) называют реакции протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Степенью окисления элемента в соединении называют формальный заряд атома элемента, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
Степень окисления элемента указывается вверху над символом элемента со знаком «+» или (–) перед цифрой. Степень окисления элемента рассчитывается из положения, что сумма степеней окисления элементов в соединении равна нулю.
В окислительно – восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление. Вещества, атомы или ионы, которые отдают электроны, называются восстановителями, процесс отдачи электронов называется окислением. Таким образом, восстановители в ОВР окисляются. Алгебраическая величина степени окисления восстановителя повышается. Вещества, атомы или ионы которых присоединяют электроны, называются окислителями, процесс присоединения электронов называется восстановлением. Окислители в ОВР восстанавливаются. В результате процесса восстановления алгебраическая величина степени окисления окислителя понижается.
Важнейшими восстановителями являются:
а) все простые вещества металлы, наиболее активные восстановители – щелочные и щелочноземельные металлы.
б) сложные вещества, молекулы, которых содержат элементы в низшей степени окисления – метан CH4, силан SiH4, аммиак NH3, фосфин PH3, нитриды и фосфиды металлов (Na3N Ca3P2) , сероводород H2S, галогенводороды (HI, HCI, HBr) галогениды металлов, гидриды металлов (NaH, CaH2).
Важнейшими окислителями являются:
а) простые вещества – неметаллы с наибольшим значением электроотрицательности - фтор F2, кислород O2, хлор CI2.
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления – перманганат калия KMnO4, бихромат калия K2Cr2O7, азотная кислота HNO3, и ее соли нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) PO2, хлорная кислота HCIO4 и ее соли перхлораты и др.
Вещества, содержащие атомы в промежуточных степенях окисления могут как восстановителями (при действии более активного, чем они окислителя), так и окислителями (при действии более активного, чем они восстановителя) е вещества проявляют окислительно – восстановительную двойственность.
Окислители чрезвычайно токсичны для организма.
ТИПЫ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
13
14
1) Межмолекулярные окислительно – восстановительные реакции, окислитель и восстановитель входят в состав молекул различных веществ.
+4 |
+7 |
+6 |
+2 |
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5 Na2SO4 + 2MnSO4 + K2SO4 + 3H2O Na2SO3 - восстановитель, сера меняет степень окисления от +4 до +6 KMnO4 –окислитель, марганец меняет степень окисления с +7 до +2 2) внутримолекулярные окислительно – восстановительные реакции.
В этих реакциях и окислитель и восстановитель входят в состав одного и того же вещества.
_-3 +6 |
0 +3 |
(NH4)2Cr2O7 |
= N2 + Cr2O3 + 4H2O |
Восстановитель азот, меняет степень окисления от -3 до 0, окислитель хром, меняет степень окисления от +6 до +3.
3) реакции диспропорционирования, при которых один и тот же элемент, находящийся в промежуточной степени окисления является и окислителем и восстановителем.
0 |
-1 |
+1 |
2CI2 |
+ 2Ca(OH)2 = CaCI2 |
+ Ca(CIO)2 + 2H2O |
CОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления уравнений окислительных – реакций используется метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которое отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая
выражается следующей схемой.
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
а) Определяем степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
+1 +7 -2 +1 -1 +1 +6 -2 +2 +6 -2 0 +1 +6 -2 +1 -2
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
б) Находим элементы, которые изменяют степени окисления, это марганец и бром:
+7 -1 +2 0
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
в) Составляем уравнения процессов окисления и восстановления: Mn +7 + 5e = Mn+2 восстановление окислителя
2Br-1 - 2e = Br2 окисление восстановитель
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые количество отданных и принятых электронов будут равны;
Mn +7 + 5e = Mn+2 |
|2 |
2Br-1 - 2e = Br2 |
| 5 |
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие процессах окисления и восстановления:
2KMnO4 + 10KBr + H2SO4 = 2MnSO4 + 5Br2 + K2SO4 + H2O
е) Уравниваем число атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода:
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
Проверяем правильность уравнивания по равенству числа атомов кислорода в левой (40 атомов) и правой (40 атомов) частях уравнения.
ЭЛЕКТРОЛИЗ
Электролизом называется окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита. Заряженные ионы электролита под действием электрического тока начинают двигаться к электродам: катионы к катоду (отрицательно заряженному электроду), анионы к аноду
14

15
(положительно заряженному электроду).На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются.
Электролиз расплавов и растворов протекает по-разному т.к. в растворах дополнительно присутствуют ионы Н+ и ОН- , которые также участвуют в процессе электролиза.
Электролиз расплава. В теоретическом плане простейшим примером электролиза является электролиз расплава. Рассмотрим процесс электролиза расплава NaCI
NaCI = Na+ + CI–
Под действием электрического тока катионы движутся катоду и принимают от него электроны: Катод (—) Na+ + e = Na0 – процесс восстановления.
Анионы CI– движутся к аноду и отдают электроны:
Анод (+) |
2 CI– - 2е = CI2 - процесс окисления. |
|
|
|
Na+ |
+ e = Na0 |
|
|
|
2 CI– — 2е = CI2 |
|
|
|
|
Суммарное ионное уравнение электролиза: |
2Na+ |
+ 2 CI– |
= 2Na0 + CI2 |
|
Суммарное молекулярное уравнение: 2NaCI |
= |
2Na + CI2 |
||
На катоде выделяется металлический натрий, на |
аноде |
– газообразный хлор. Это реакция |
||
окислительно - восстановительная, на катоде всегда идет процесс восстановления, на аноде всегда идет процесс окисления.
Электролиз растворов. Процесс на катоде.
1.Если катион электролита находится в начале электрохимического ряда (по AI включительно), то на катоде идет процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2.Если катион электролита находится в ряду между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды.
3.Если катион электролита находится в ряду напряжения после водорода, то на катоде идет только процесс восстановления ионов металла.
4.Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы менее активных металлов.
Катодные процессы в водных растворах солей
Li, K, Ca, |
|
|
|
Mn, Zn, Fe, |
H2 |
Cu, Hg, Ag, |
Na, Mg, Al |
|
|
Ni, Sn, Pb |
|
Pt, Au |
|
Men+ |
- |
металл |
не |
Men+ + Me0 |
|
Men+ +2e = Me0 |
востанавливается |
|
|
|
|
||
2Н2О + 2е = Н2 + 2ОН— |
|
2Н2О + 2е = Н2 + 2ОН— |
|
|
||
Процесс на аноде. Продукты электролиза зависят от материала |
анода и природы аниона. |
|||||
1.Если анод растворимый (железо, медь, серебро), то независимо от природы аниона всегда идет окисление металла анода.
2.Если анод нерастворимый (уголь, графит, платина, золото), то анионы безкислородных кислот (за исключением фторидов) окисляются на аноде, а анионы оксокислот и фториды не окисляются на аноде, а идет окисление воды с выделением кислорода. При электролизе щелочей идет окисление гидроксид ионов.
Анодные процессы в водных растворах
Анод |
Анионы безкислородные |
Анионы |
|
|
кислородсодержащие |
Нерастворимый |
Окисление аниона |
В щелочной среде |
|
(кроме фторидов) |
4ОН—— 4е = О2 + 2Н2О |
|
Асm — +me = Ас0 |
В кислой, нейтральной |
|
|
средах |
|
|
2Н2О — 4е = О2 + 4Н+ |
Растворимый |
Окисление металла анода |
Окисление металла анода |
|
Ме0 —ne = Меn+ |
Ме0 —ne = Меn+ |
15
16
|
Анод |
раствор |
Анод |
раствор |
Массу вещества, образовавшегося при электролизе найти исходя из закона Фарадея:
m |
M I t |
|
|
nF |
, где m - масса вещества, М – молярная масса, n - |
||
|
|||
|
|
количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I
– сила тока (А), t - продолжительность процесса.
Электролиз используется для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Для защиты от коррозии электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Устройства, которые применяют для непосредственного преобразования энергии химических реакций в электрическую энергию, называют гальваническими элементами или химическими источниками электрической энергии. Действие любого гальванического элемента основано на протекании в нем окислительно – восстановительной реакции.
3
2
1 |
4 |
|
Классический пример гальванического элемента – элемент Даниэля – Якоби, он состоит из цинковой пластины (1), погруженной в раствор сульфата цинка и медной пластины (2), погруженной в раствор сульфата меди. Растворы разделены пористой перегородкой (4) (или электролитическим мостиком).
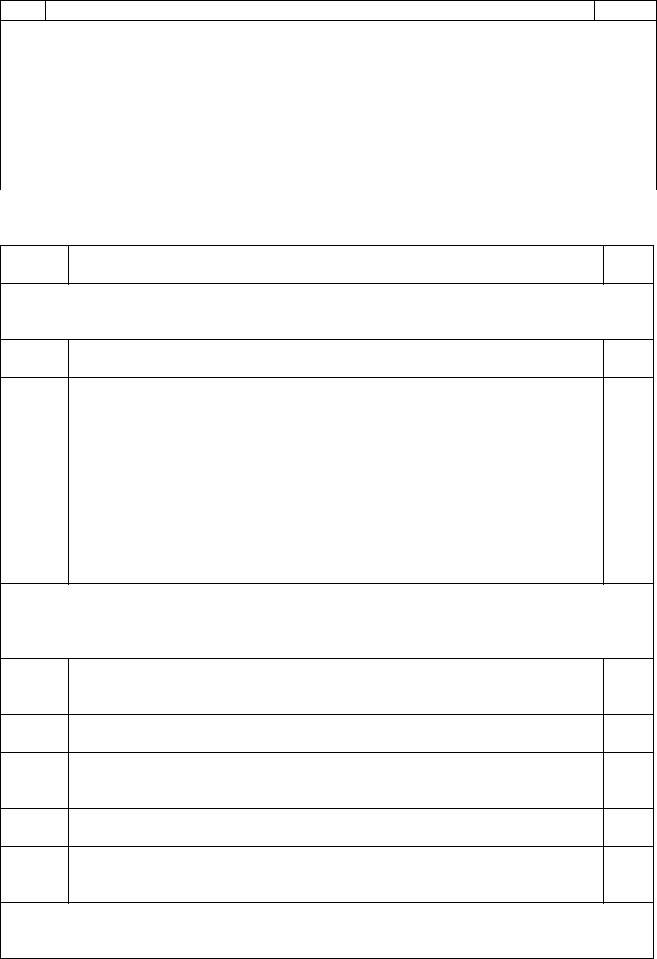
При замкнутой цепи цинк окисляется, ионы цинка переходят в раствор, электроны движутся по внешней цепи к медному электроду.
На медном электроде происходит восстановление ионов меди из раствора, медь выделяется на пластинке. Цинковый электрод является анодом, медный катодом, цинк растворяется, медь выделяется из раствора, сульфат анионы движутся через пористую перегородку от медного к
цинковому электроду. |
|
|
Процесс на аноде |
Zn - 2e = Zn+2 |
|
Процесс на катоде |
Cu+2 |
+ 2e = Cu |
Суммарное уравнение: Zn |
+ Cu+2 = Zn+2 + Cu |
|
Молекулярное уравнение: |
Zn + CuSO4 = Zn SO4 + Cu |
|
Кратко строение элемента Даниэля – Якоби можно записать следующей схемой:
Zn|ZnSO4(р) || CuSO4(р)|Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. В настоящее время используются различные гальванические элементы: железо – никелевые, кадмиево – никелевые, серебряно – цинковые, свинцовые, и др. их называют аккумуляторами. В свинцовом аккумуляторе одни пластины заполнены дооксидом свинца, другие губчатым свинцом. Металлический свинец при работе аккумулятора является анодом и окисляется:
Pb + SO4-2 = PbSO4 +2e
Диоксид свинца является катодом, он восстанавливается:
PbO2 + SO4-2 + 4H+ + 2e = PbSO4 +2H2O
16

17
Суммарный процесс: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
При зарядке, через аккумулятор пропускают электрический ток и в результате этого электрохимические процессы на электродах протекают в обратном направлении.
Свинцовый электрод становится катодом, на нем протекает процесс восстановления:
PbSO4 +2e = Pb + SO4-2
На электроде из PbO2 происходит процесс окисления:
PbSO4 + 2H2O = PbO2 + SO4-2 + 4H+ + 2e
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.
Cu Zn
Скачок потенциала, возникающий на границе раздела металл – раствор его соли, называется электродным или окислительно – восстановительным потенциало ( ). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста.
0 RTzF ln CMe z , где F - число Фарадея
равно 96500Кл/моль, z – заряд иона, R – газовая постоянная 8,31Дж/моль·К, Т температура по Кельвину, 0 - стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
0 0,059 lg CMe z z
Стандартным электродным потенциалом металла 0 называется скачок потенциала на
границе раздела металл - раствор его соли с концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента), а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла. Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35
– (-0,76) = 1,11В.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
К электрохимической коррозии относятся все случаи коррозии в водных растворах или во влажной атмосфере. Для предупреждения от электрохимической коррозии применяются различные методы. Например, защитные металлические покрытия. Железные изделия могут покрываться тонкой пленкой хрома, никеля, цинка, кадмия, алюминия, олова, серебра, золота и др. При нарушении целостности металлического покрытия в влажной среде, возникает гальванический элемент, что приводит к растворению более активного металла. Металл, который в ряду напряжения стоит левее, становится анодом и разрушается, при этом менее активный металл не изменяется.
17
18
Для защиты металлов от коррозии используют как анодное, так и катодное покрытие металлов. При анодном покрытии берется более активный металл (например, покрытие цинком железного изделия), он и растворяется при коррозии, а основной металл не разрушается. Катодное покрытие (например, серебрение железного изделия), защищает металл до тех пор пока, пленка не нарушена. При нарушении защитной пленки основной металл становится анодом, а покрытие катодом, соответственно разрушается защищаемый металл, а покрытие не разрушается.
Обучающие задачи Задача 1. Сумма коэффициентов в уравнении реакции:
Cu + HNO3 = Cu(NO3)2 |
+ NO + H2O, составляет |
|
|||
|
|
1) 10 |
2) 15 |
3) 20 |
4) 18 |
Решение: |
|
|
|
|
|
0 |
+5 |
+2 |
+2 |
|
|
Cu + HNO3 = Cu(NO3)2 + NO + H2O
Сu - 2e = Cu+2 | 3 Окисление восстановителя N+5 + 3e = N+2 | 2 восстановление окислителя
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Ответ: 3
Задача 2. При электролизе водного раствора NaCI c нейтральными электродами протекает следующая окислительно – восстановительная реакция:
1) 2NaCI + 2Н2О = |
Н2 |
+ CI2 + 2NaOH |
2) 2NaCI = 2Na + |
CI2 |
|||||||||
3) NaCI + Н2О = НCI + NaOH |
|
4) 2NaCI + 2Н2О |
= |
CI2 + 2NaOH |
|||||||||
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
Катод (—) 2Н2О + 2е = Н2 + 2ОН— |
Анод (+) 2 CI– |
— 2е = CI2 |
|||||||||||
Суммарное ионное уравнение: |
|
2Н2О + 2 CI– = Н2 |
+ 2ОН— + |
CI2 |
|
|
|
||||||
|
|
|
|
|
|
электролиз |
|
|
|
|
|
||
Суммарное молекулярное уравнение: 2NaCI + 2Н2О = |
Н2 + |
CI2 + 2NaOH Ответ: №1 |
|||||||||||
Задача 3. Написать уравнения электролиза раствора Cu(NO3)2 c инертным анодом. |
|||||||||||||
Решение: |
Катод (—) Сu2+ + 2е = Cu0 |
|
|
Анод (+) 2Н2О — 4е = О2 + 4Н+ |
|||||||||
Суммарное ионное уравнение: |
|
2Сu2+ + 2Н2О = 2Cu0 |
+ О2 + 4Н+ |
|
|
|
|||||||
Суммарное молекулярное уравнение: 2 Cu(NO3)2 + 2Н2О = 2Cu0 |
+ О2 + 4НNO3 |
||||||||||||
Задача 4. |
При прохождении через раствор нитрата серебра количества электричества величиной |
||||||||||||
48250 Кл на катоде образуется ____граммов чистого серебра. (F = 96500Кл/моль) |
|||||||||||||
|
1) |
27 |
2) |
54 |
|
3) 18 |
|
|
|
4) 108 |
|
|
|
Решение: Можно рассчитать массу серебра по закону Фарадея |
|
m |
M I t |
; М(Ag = 108 |
|||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
nF |
||
г/моль, I ·t = 48250Кл, F = 96500Кл/моль |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
m |
108 48250 |
54г |
|
|
|
|
|
|
|
|
|
|
|
1 96500 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
Ответ: 2
Задания для самостоятельной работы
При выполнении самостоятельной работы необходимо полностью приводить обоснования правильности выбора номера верного ответа (посмотрите примеры решения теста выше).
1) Согласно уравнению Нернста потенциал электрода______.
1) Зависит от его массы |
2) Зависит от его природы |
3) Не зависит от температуры 4) Не зависит от концентрации электролита
18
|
|
|
|
19 |
|
2) |
ЭДС гальванического элемента, состоящего из медного и цинкового электродов, |
||||
погруженных в 0,01 М растворы их сульфатов |
|
||||
(Е0Сu2+/Cu=0,34B, Е0Zn2+/Zn=-0,76B) равна___ В. |
|
||||
|
1) |
1,10 |
2) 0,70 |
3) 0.28 |
4)0,43 |
3) |
Если при электролизе водного раствора соли значение рН в катодном пространстве |
||||
возросло, то электролизу подвергался раствор____. |
|
||||
|
1) |
Cu(NO3)2 |
2)KCl |
3) CuCl2 |
4) ZnCl2 |
4) В гальваническом элементе, состоящем из никелевого 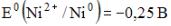 и железного
и железного
|
электродов, погруженных в 1 М растворы их солей, на аноде |
протекает процесс: |
|
1) |
2) |
3) |
4) |
5) Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора
AgNO3 равна___.
1) |
11 |
2) 15 |
3) |
3 |
4) |
7 |
6) При электролизе раствора хлорида меди (II) на катоде выделилось 2,7 г меди. Объем газа
(н.у.), выделившегося на аноде равен _______ л.
1) |
4,48 |
2) |
0,945 |
3) 2,24 |
4) |
6,72 |
7) Сумма коэффициентов в левой части уравнения реакции KMnO4 + Na2SO3 + H2SO4 …
составляет____.
1) |
6 |
2) 8 |
3) |
12 |
4) |
10 |
8) При прохождении через раствор нитрата серебра количества электричества величиной
48250Кл на катоде образуется ___граммов чистого серебра (F=96500Кл/моль).
1) |
27 |
2) |
54 |
3) |
18 |
4) 108 |
9) Коэффициент перед молекулой восстановителя в уравнении реакции KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O равен____.
1) |
5 |
2) 3 |
3) 2 |
4) 1 |
10) Если гальванический элемент составлен из двух серебряных электродов, один из которых стандартный, то для достижения наибольшего ЭДС другой электрод следует погрузить в раствор AgNO3 c концентрацией____.
1) 0,5 М |
2) 0,2 М |
3) 0,4 М |
4) 0,1 М |
11) ЭДС гальванического элемента состоящего из железного и серебрянного электродов, погруженных в 0,1 М растворы их нитратов Е0(Fe+2/ Fe)= -0,44 В, Е0(Ag+/ Ag)= 0,80 В,
равна_______В.
19
|
|
20 |
|
1) 1,21 |
2) 1,24 |
3) – 1,21 |
4)– 1,24 |
12) Для получения 54 г серебра электролизом водного раствора нитрата серебра (выход по току 100%), необходимо чтобы в растворе содержалось___граммов чистой соли.
1) 255 2) 85 3) 340 4) 170
13) При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода,
выделившегося на катоде равен ____ л (н.у.).
1) 22.4 2) 5.6 3) 44.8 4) 11.2
14) Если гальванический элемент составлен из двух электродов, один из которых стандартный цинковый электрод Е0 = -0,76В, то для достижения наибольшего значения
Э.Д.С. другим электродом должен быть стандартный______.
1) медный Е0=+0,34 В |
2) |
серебряный Е=+0,8 В |
3)свинцовый Е=-0,13 В |
4) |
водородный |
15) Максимальное значение ЭДС |
(при одинаковых концентрациях солей) будет у |
|
гальванического элемента Ме|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен ___В.
1) – 0,76 |
2) – 2,36 |
3) + 1,19 |
4) +1,50 |
Занятие 1.1.2 ТЕМА: Основы химической термодинамики и биоэнергетики. Химическое равновесие.
ЦЕЛЬ: Познакомиться с основами термодинамики и биоэнергетики, научиться прогнозировать направление химических и биологических процессов.
ЗНАТЬ:
1.Предмет и методы химической термодинамики. Основные понятия термодинамики.
2.Параметры состояния (интенсивные и экстенсивные) Функция состояния.
3.Внутренняя энергия. Работа и теплота – две формы передачи энергии.
4.Типы термодинамических систем (изолированные, закрытые, открытые).
5.Типы термодинамических процессов (изотермические, изобарные, изохорные). Стандартное состояние.
6.Энтальпия. Стандартная энтальпия образования и сгорания вещества. Стандартная энтальпия реакции. I начало термодинамики.
7.Закон Гесса. Следствия из закона Гесса. Применение 1 начала термодинамики к биосистемам. Энергетическая ценность пищевых продуктов, обоснование рационов питания.
8.Обратимые и необратимые в термодинамическом смысле процессы. Второе начало термодинамики. Энтропия.
9.Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах. Роль энтальпийного и энтропийного факторов.
10.Термодинамические условия равновесия. Стандартная энергия Гиббса образования и биологического окисления веществ. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов. Принцип энергетического сопряжения.
11.Обратимые и необратимые реакции. Термодинамические условия равновесия в изолированных и закрытых системах.
12.Закон действующих масс. Константа химического равновесия.
13.Уравнение изотермы и изобары химической реакции.
14.Прогнозирование смещения химического равновесия. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
20

21
15. Понятие о гомеостазе и стационарном состоянии живого организма.
УМЕТЬ:
1.Самостоятельно пользоваться учебной, научной и справочной литературой;
2.Пользоваться химическим оборудованием (спиртовки, химическая посуда и т.д.).
3.Наблюдать за протеканием химических реакций и делать обоснованные выводы.
4.Фиксировать аналитические эффекты химических реакций и определять направление протекания процесса.
5.Устанавливать взаимосвязь между калорийностью пищи и энергозатратами.
6.Решать типовые практические задачи.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками безопасной работы в химической лаборатории.
Лабораторная работа №1 «Качественные опыты по химическому равновесию»
Основные уравнения химической термодинамики и химического равновесия
1.Q = E + W - уравнение первого начала термодинамики
2.W = P V – работа расширения
3.Qv = Ev - теплота изохорного процесса
4.Qp = Hp - теплота изобарного процесса
5.Hp = E + P V - уравнение первого начала термодинамики для изобарных процессов
6. H = n H0 298 обр. прод. реак. - n H0 298 обр. исх. веществ - первое следствие закона Гесса
7.H = n H0 298 сгор. исход. в. - n H0 298 сгор. прод. реакции - второе следствие закона Гесса
8.Q = W - уравнение первого начала термодинамики для биосистем
9.S = Q / T - энтропия как функция состояния системы
10.S 0 - уравнение второго начала термодинамики
11.S = nS0 298 прод. р. - nS0 298 исх. в. - расчет энтропии реакции
12.G0 = H0 - T S0 - уравнения для расчета энергии Гиббса
13.G0 = n G0 298 прод. р. - n G0 298 исх. в. расчет энергии Гиббса по реакции
14.G0 = - 2,3RT lg Кс - уравнение изотермы химической реакции при стандартных условиях
15. G 2,3RT lg |
Пс |
|
- уравнение изотермы химической реакции |
|||||
Кс |
||||||||
|
|
|
|
|
||||
|
|
a |
|
b |
|
|||
16. |
k |
[ A] |
[B] |
- |
константа химического равновесия, выраженная через равновесные |
|||
d |
c |
|||||||
|
|
[D] |
[C] |
|
||||
концентрации вещества
17. k Pa Pb - константа химического равновесия, выраженная через равновесные парциальные
Pc Pd
давления вещества
21

|
|
|
|
|
|
|
|
|
|
|
22 |
|
18. |
lg |
KT 2 |
|
|
(T2 |
T1 ) |
- |
уравнение изобары |
||||
K |
T 1 |
2,3R(T T ) |
||||||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
1 |
2 |
|
|
|
|||
19. |
|
|
2,3R(T1 T2 ) |
lg |
KT 2 |
- расчет теплового эффекта по значениям констант |
||||||
|
|
|
||||||||||
|
|
|
|
|
|
T2 T1 |
|
|
|
KT 1 |
|
|
Таблица 1
Стандартные энтальпии образования веществ, стандартные энтропии и стандартные энергии Гиббса образования веществ
|
Стандартная энтальпия |
Стандартная |
Стандартная энергия Гиббса |
|
Вещество |
энтропия |
|||
образования кДж/моль |
образования кДж/моль |
|||
|
Дж/моль×К |
|||
|
|
|
||
|
Неорганические вещества |
|
||
С (графит) |
0 |
+6 |
|
|
СО (г) |
-110 |
+198 |
-137 |
|
СО2 (г) |
-393,5 |
+214 |
-394 |
|
Cl2 (г) |
0 |
+223 |
0 |
|
Cl2O (г) |
+76 |
+266 |
+94 |
|
FeСО3 (тв) |
-753 |
+96 |
-680 |
|
H2 (г) |
0 |
+131 |
0 |
|
HCl (г) |
-92 |
+187 |
-95 |
|
HI (г) |
+24 |
+206 |
-1 |
|
HNO2 (р-р) |
-119 |
+153 |
-56 |
|
HNO3 (ж) |
-174 |
+156 |
-81 |
|
H2O (ж) |
-286 |
+70 |
-237 |
|
H2O2 (ж) |
-187 |
+110 |
-120 |
|
H2S (г) |
-21 |
+206 |
-34 |
|
H2SO4 (ж) |
-814 |
+157 |
-690 |
|
KNO3 (тв) |
-495 |
+133 |
-395 |
|
KOH(р-р) |
-477 |
+92 |
-441 |
|
N2 (г) |
0 |
+192 |
0 |
|
NH3 (г) |
-46 |
+192 |
-16 |
|
H2O (г) |
+82 |
+220 |
+104 |
|
NO (г) |
+91 |
+211 |
+87 |
|
NO2 (г) |
+33 |
+240 |
+51 |
|
N2O3 (г) |
+11 |
+356 |
+115 |
|
Na2O2 (тв) |
-510 |
+95 |
-447 |
|
Na2S2O3 (тв) |
-1117 |
+225 |
-1043 |
|
O2 (г) |
0 |
+205 |
0 |
|
SO2 (г) |
-297 |
+248 |
-300 |
|
SO3 (г) |
-396 |
+257 |
-371 |
|
|
Органические вещества |
|
||
Метан (г) |
-75 |
+186 |
-51 |
|
Этан (г) |
-85 |
+229 |
-33 |
|
Этилен (г) |
+52 |
+219 |
+68 |
|
Ацетилен (г) |
+227 |
+201 |
+209 |
|
Бензол (ж) |
+49 |
+173 |
+125 |
|
Циклогексан (ж) |
-156 |
+204 |
+27 |
|
Хлорметан (г) |
-86 |
+234 |
-63 |
|
Дихлорметан (г) |
-95 |
+270 |
-69 |
|
Трихлорметан (г) |
-101 |
+296 |
-69 |
|
Тетрахлорметан (г) |
-100 |
+310 |
-58 |
|
Метанол (ж) |
-239 |
+127 |
-166 |
|
Этанол (ж) |
-277 |
+161 |
-174 |
|
Диэтиловый эфир (ж) |
-279 |
+253 |
-123 |
|
Ацетальдегид (г) |
-166 |
+264 |
-133 |
|
22
23
Ацетон (ж) |
-247 |
+199 |
-154 |
|
С3Н7СООН (ж) |
-535 |
-376 |
226 |
|
Пируват-ион (р-р) |
|
+ |
-559 |
|
L-молочная кислота |
-686 |
+222 |
-539 |
|
(р-р) |
||||
|
|
|
||
Цитрат-ион |
- |
- |
-1167,2 |
|
Изоцитрат-ион |
- |
- |
-1160,6 |
|
-кетоглутарат-ион |
- |
- |
-796,8 |
|
Сахароза (тв) |
-2222 |
+360 |
-1545 |
|
D-глюкоза (р-р) |
-1264 |
+269 |
-917 |
|
Нитробензол (ж) |
+16 |
+224 |
+146 |
|
Анилин (ж) |
+31 |
+191 |
+149 |
|
L-лейцин (р-р) |
-643 |
+208 |
-362 |
|
Глицин (р-р) |
-523 |
+159 |
-380 |
|
D,L-лейцилглицин |
|
+ |
-464 |
|
(р-р) |
|
|||
|
|
|
||
Глицилглицин (р-р) |
-734 |
+231 |
-492 |
Стандартные энтальпии сгорания органических веществ, кДж/моль
Метан (г) |
-890 |
Этанол (ж) |
-1371 |
Ацетилен (г) |
-1300 |
Диэтиловый эфир (ж) |
-2727 |
Бензол (ж) |
-3268 |
Нитробензол (ж) |
-3091 |
Циклогексан (ж) |
-3920 |
Анилин (ж) |
-3396 |
Метанол (ж) |
-727 |
Глюкоза |
-2810 |
Удельная теплота полного окисления веществ в условиях организма, кДж/г.
Условный белок |
17 |
Условный жир |
39 |
Углеводы |
17 |
1 ккал = 4,18 кДж
Обучающие задачи Задача 1. В организме человека реакция окисления этилового спирта протекает в две стадии.
Первая - окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С2H5OH + ½ O2 = CH3COH + H2O.
Рассчитайте H0 реакции, используя первое следствие закона Гесса, еслиН0 обр.(C2H5OH) = - 278 кДж/моль;
Н0 обр.(CH3СOH) = - 166 кДж/моль;
Н0 обр.(H2O) = - 286 кДж/моль.
Решение: H0 = n H0 обр.пр.р. - n Н0 обр.исх.в.в; H = (-166+ (-286)-(-278)) = - 174 кДж/моль
Ответ: тепловой эффект реакции H = -174 кДж/моль, т.е. процесс экзотермический.
Задача 2. Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы:
С6Н12О6= 2С2Н5ОН + 2СО2 Решение: Тепловой эффект данной реакции можно рассчитать, применяя второе следствие из закона Гесса:
Н = n Н0 сгор. исход. веществ - n H0 сгор. прод. реакции
Н = -2810 - 2 ∙(-1366) = - 78 кДж/моль
Ответ: тепловой эффект процесса брожения равен - 78 кДж/моль.
23
|
|
24 |
Задача 3. Рассчитайте стандартную энтропию реакции: |
||
NH2 - CH2 - COOH + NH2 - CH2 - COOH → |
NH2 - CH2 - CO - NH - CH2 - COOH + H2O |
|
глицин |
глицин |
глицилглицин |
Если S0 (глицилглицина) = 231 Дж/моль×К;
S0 (глицина) = 159 Дж/ моль×К; S0( H2O) = 70 Дж/моль×К;
Решение:
S = S0298(гл-гл) +S0298(H2O)– 2 S0 298 (глицина) = (231+70)-(159+159)= -17 Дж/моль×К
Ответ: S0 298= - 17 Дж/моль×К, т.е. энтропия уменьшится.
Задача 4. Теплота сгорания углеводов, белков и жиров составляет 17, 17 и 39 кДж соответственно. Среднесуточная потребность в белках, жирах и углеводах для студентов - мужчин составляет 113, 106 и 451г. Какова суточная потребность студентов - мужчин в энергии? Решение: Рассчитываем, сколько энергии выделяется при окислении углеводов, белков и жиров
H = (451×17) + (113 × 17) + (106 × 39) = 13722 кДж или в килокалориях 13722: 4,18 = 3282,78
ккалл.
Ответ: Суточная потребность в энергии равна 13722 кДж или 3282,78 ккалл.
Задача 5. Почему процесс денатурации белка при 400С является самопроизвольным, если реакция эндотермическая и тепловой эффект составляет 2830 Дж/моль? Значение S для данной реакции равно 288 Дж/моль×К Решение: Для определения направления процесса необходимо знать величину изменения энергии
Гиббса, рассчитываемой по уравнению: G0 = H0 - T S0. Расчет показывает, что G < 0 ( G0 = 2830 Дж/моль - (313К × 288 Дж/моль×К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Ответ: Поскольку G < 0, то процесс денатурации белка при 400С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Задача 6. Вычислите энергию Гиббса, являющуюся критерием самопроизвольности процессов, для реакции гликолиза при стандартных условиях: С6H12О6 (р-р) 2С3H6О3 (р-р) (молочная кислота).
Решение:
Из таблицы термодинамических величин запишем стандартную энергию Гиббса для участников химического процесса: ∆G0 (С6H12О6) = -917 кДж/моль; ∆G0(С3H6О3) = -539 кДж/моль. Используя 1 следствие из закона Гесса вычислим энергию Гиббса:
ΔG0 = 2×ΔG0 (C3H6O3) - ΔG0 (C6H12O6) ΔG0 = 2(-539) – (-917) = -161 кДж/моль
Ответ: т.к. ΔG0 < 0, то реакция протекает самопроизвольно в прямом направлении.
Задача 7. Вычислить изменение энергии Гиббса при 250С по стандартным значениям энтальпий образования и абсолютных энтропий для данной реакции: СО + 2Н2 = СН3ОН
Н0обрСН3ОН = -293 кДж/моль |
S0(СН3ОН) = 127 Дж/моль×К |
Н0обрСО = - 110 кДж/моль. |
S0(CO) = 198 Дж/моль×К |
|
S0(H2) = 131 Дж/моль×К |
Решение: G0 = H0 - T S0 |
|
H0 = n H0обр. пр. реак. - n Н0обр. исх. веществ
Н0 = - 293 - (-110) = - 183 кДж/моль
S0 = n S0 прод. р - n S0 исход. веществ
S0 = 127 - (198 + 2(131) = - 333 Дж/моль×К
G0 = - 183,5 кДж/моль - (298К × 0,333 кДж/моль×К) = - 83,8 кДж/моль
Ответ: G0 = - 83,8 кДж/моль
Задача 8. Рассчитайте константу равновесия при 310 К для реакции АТФ + АМФ↔2 АДФ, если свободная энергия Гиббса реакции G°=-2,1 кДж/моль
24

|
|
|
|
|
|
25 |
|
|
||
Решение: в состоянии равновесия G0 = - 2,3RT lg Кс |
|
|||||||||
lg Kc |
G |
|
2,10 |
|
|
|
2,10 |
|
0,354 |
|
2,3 RT |
2,3 8,31 10 3 310 |
5,925 |
||||||||
|
|
|
|
|||||||
lgKc= 0,354
Kc = 100,354=2,26 Ответ: Kc = 2,26
Задача 9. Константа равновесия реакции: PCl5(г) PCl3(г) + Cl2(г) при 2500С равна 2. В каком направлении идет реакция при следующих концентрациях: С(PCl5) = C(PCl3) = 2 моль/л; С(Сl2) = 4 моль/л ?
Решение: Для определения направления протекания реакции воспользуемся уравнением изотермы
G 2,3RT lg Пс Кс
Рассчитаем Пс
П |
|
|
СРСl3 СCl 2 |
|
2 4 |
4 |
с |
CPCl5 |
|
||||
|
|
2 |
|
|||
|
|
|
|
|||
G 2,3RT lg Пс 2,3RT lg 4
Кс 2
Т.к. Пс > Кс, то G > 0
Вывод: реакция самопроизвольно протекать в прямом направлении не может, т.к. G>0.
Задача 10. Константа равновесия реакции 2SO2 (г) + O2(г) 2SO3(г) при температуре 6270С равна 2,3∙10-7, Н0 = 376,5 кДж/моль. Рассчитайте константу равновесия при 7270С.
Решение: воспользуемся уравнением изобары химической реакции:
lg |
|
KT 2 |
|
|
|
(T2 T1 ) |
|
|
|
|
|
|
|
|||||
|
KT 1 |
2,3R(T1 T2 ) |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
T1 = 273 + 627 = 900 K |
|
|
|
|
|
|
||||||||||||
T2 = 273 + 727 = 1000K |
|
|
|
|
|
|
||||||||||||
lg |
KT 2 |
|
|
|
|
|
376,5 (1000 900) |
|
|
|
37650 |
2,189 |
|
|||||
KT 1 |
|
|
2,3 8,31 10 3 (900 1000) |
17201,7 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
KT 2 |
10 |
2,189 |
154,5 |
|
|
|
|
|
|
||||||||
|
KT1 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
K |
T 2 |
|
K |
T1 |
154,5 2,3 10 7 |
154,5 355,4 10 7 |
3,56 10 5 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ответ: Константа равновесия при 7270С равна 3,56 × 10-5 .
Задача 11. Для реакции Н2О(г) + СO(г) CO2(г) + H2(г) константы химического равновесия равны: при 8000С Кр = 2,87, при 10000С Кр = 1,39. Вычислите тепловой эффект этой реакции.
Решение: Применив, уравнение изобары химической реакции, рассчитаем Н
lg |
KT 2 |
|
(T2 T1 ) |
|
KT 1 |
2,3R(T1 T2 ) |
|||
|
|
25
26
Н |
2,3R(T1 T2 ) |
lg |
KT 2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
T2 |
T1 |
|
|
|
|
|
KT1 |
|
|
|
|
|
|
|
|
|
|
|
|||
Перевёдём температуру в Кельвины: |
T1 |
= 800 + 273 = 1073 K |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
= 1000 + 273 = 1273 K |
|
|
|
|
|
|
|
|
|
2,3R(T T |
2 |
) |
|
|
|
K |
T 2 |
|
2,3 8,31 10 3 (1073 1273) |
|
1,39 |
|
26107 |
|
|
||||||
Н |
|
|
1 |
|
|
lg |
|
|
|
|
|
|
lg |
|
|
|
|
lg 0,484 |
39,16кД |
||||
|
T2 |
T1 |
|
|
|
|
KT 1 |
|
1273 1073 |
2,87 |
200 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Ответ: Н = -39,16 кДж/моль.
Задачи для самостоятельной работы Задача 1. Сколько теплоты будет потеряно за день при выделении через кожу 576г воды, если на испарение 1 моля воды требуется 40 кДж?
Ответ: 1280 кДж
Задача 2. Одним их путей метаболизма глюкозы в организме является процесс: С6Н12О6 (р-р) → С3Н7СООН (ж) + 2СО2(г) + 2Н2(г). Рассчитайте тепловой эффект этого процесса.
Ответ: Н= - 58,2 кДж
Задача 3. В 100 граммах бисквитного десерта содержится 5,5 г белка, 24 г жира и 54 г углеводов. Вычислите калорийность десерта массой 80 г.
Ответ: 372,7 ккал
Задача 4. Вычислите стандартную энтропию реакции окисления сахарозы С12Н22О11(к) + 12О2(г) → 12СО2(г) + 11Н2О(ж), используя справочные данные.
Ответ: S0р-ции = 518 Дж/моль×K
Задача 5. В цикле Кребса цитрат превращается в изоцитрат, а затем в -кетоглутарат. Рассчитайте величину G для этих реакций, используя справочные данные, определите направление протекания каждого из процессов:
1)Цитрат3- → Изоцитрат3-
2)Изоцитрат3- + ½О2(г) + Н+ ↔ -кетоглутарат2- + Н2О(ж) + СО2(г)
Ответ: G1 р-ции = 6,6 кДж/моль, G2 р-ции = - 267,2 кДж/моль
Задача 6. Вычислите стандартную энтальпию образования глюкозы, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания: С6Н12О6 + 6О2 → 6СО2+6Н2О Ответ: Н0обр. = - 1267 кДж/моль Задача 7. Вычислите энергию Гиббса тепловой денатурации трипсина при 500С, если Н0р-ции=
283 кДж/моль, а S0р-ции= 288 Дж/моль×K. Считать, что изменение энтальпии и энтропии не зависят от температуры в данном диапазоне.
Ответ: G = 190 кДж/моль
Задача 8. Для реакции синтеза аммиака из простых веществ равновесные концентрации при некоторой температуре равны С(NН3) = 4 моль/л, С(N2) = 3 моль/л, С(Н2) = 9 моль/л. В каком направлении будет идти реакция при концентрации всех реагентов, равных 5 моль/л. Ответ подтвердите расчётами.
Ответ: Пс >Кс, G > 0, равновесие смещено в сторону исходных веществ.
Задача 9. Рассчитайте константу равновесия реакции гидролиза сложноэфирной связи при температуре 310К, если G0 = -10,48 кДж/моль.
Ответ: Кс = 58,7 Задача 10. Для реакции Н2О(г)+СО(г)↔ СО2(г)+Н2(г) константы равновесия равны при 8000С К=
2,87, а при 10000С К=1,39. Вычислите тепловой эффект реакции по уравнению изобары. Ответ: Н = - 41,1 кДж/моль.
Тестовые вопросы
26
27
1. Если энтальпия образования SO2 равна -297 кДж/моль, то количество теплоты,
выделяемое при сгорании 16г серы, равно ____кДж.
1) 148,5 2) 297 3) 594 4)74,25
2. В реакции, протекающей в соответствии с термохимическим уравнением
3H2 + N2 = 2 NH3 + 92 кДж, выделилось 23 кДж теплоты. Объём полученного (при н.у.)
аммиака равен____.
1) 5,6 л 2) 11,2л 3) 22,4л 4) 44,8л
3. По термохимическому уравнению реакции С2Н4 + Н2О ↔ С2Н5ОН +46 кДж
вычислите объём взятого этилена (н,у.), если известно, что выделившаяся в этом процессе
теплота составила 138 кДж. |
|
|
|
1) 44,8 л |
2) 22,4л |
3) 67,2 |
4) 89,6л |
4. В реакцию, протекающую в соответствии с термохимическим уравнением
2Al + 3S = Al2S3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно____.
1) 242,5 кДж 2) 509 кДж 3) 1018 кДж 4) 2036 кДж
5. В результате реакции, термохимическое уравнение которой 2Al +Fe2O3 = Al2O3 + 2 Fe +848
кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна_____.
1) 11,2 г 2) 22,4 г 3) 56 г 4) 28 г
6. По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О
+2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67,2 л
ацетилена (н.у.) |
|
|
|
1) 870 кДж |
2) 3915 кДж |
3) 5220 кДж |
4) 7830 кДж |
7. В результате реакции, термохимическое уравнение которой 2С2Н4+ 5О2 = 4СО2 + 2Н2О
+2610 кДж выделилось 652, 5 кДж теплоты. Объём сгоревшего ацетилена равен
1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л
8. Какое выражение соответствует константе химического равновесия для данной реакции
|
|
N2+3H2 = 2NH3 |
1) Kc = NH3 2/ N2 + H2 3 |
3) Кр = NH3 2 / N2 H2 |
|
2) Кс = NH3 2 / N2 H2 3 |
4) Кс = N2 H2 3/ NH3 2 |
|
9. Как нужно изменить давление, чтобы реакция гемоглобина с кислородом |
||
Hb + O2 HbO2 была смещена вправо? |
||
1) |
уменьшить давление |
2) увеличить давление 3) давление не влияет |
10. Какое значение константы равновесия соответствует данной реакции 2NO +O2 2NO2 |
||
1) |
Kc= [NO2]2/ [NO][O2] |
3) Kc= [NO][O2]/ [NO2]2 |
2) |
Kc= [NO2]2 / [NO]2[O2] |
4) Kc= [NO2]/ [NO][O2] |
27
28
11. Как нужно изменить давление реакции N2+3H2 2 NH3, чтобы сместить равновесие
вправо?
1) |
уменьшить |
3) |
не изменять |
2) |
увеличить |
4) |
увеличить давление NH3 |
12. Будет ли влиять давление на смещение равновесия данной реакции H2 + Cl2 = 2 HCl ?
1) |
будет |
2) |
нет |
3) |
сместит равновесие вправо |
4) |
сместит равновесие влево |
13. Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном
направлении?
1) G0 0 2) G0 0 3) G0 = 0 4) G0 = 1
14. Равновесие в реакции, уравнение которой СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), H<0,
сместиться влево при ______.
1)понижении давления 3) дополнительном введении серы
2)понижении температуры 4) увеличении концентрации H2S
15. Будет ли протекать реакция в прямом направлении, если G = 18 кДж/моль?
1) нет 2) химическое равновесие 3) будет
16. Система, в которой повышение давления и повышение температуры приведут к
смещению равновесия в противоположных направлениях:
1) СO2(г) + C(т) ↔ 2СО(г), Н<0
2) J2(г) + 5 СО2(г) ↔ J2O5(т) + 5СО(г), Н>0 3) N2(г) + О2(г) ↔ 2 NO(г), Н>0
4) С2Н2(г) + 2Н2(г) ↔ С2Н6 (г), Н<0
17. Как нужно изменить давление, чтобы равнеовесие реакции гемоглобина с кислородом
былаосмещено влево Hb + O2 |
HbO2? |
1) уменьшить давление |
2) увеличить давление 3) давление не влияет |
18. В реагирующей системе, уравнение которой NO(г) + Cl2(г) ↔ NOCl2(г) H > 0, равновесие
сместиться вправо при_____.
1) повышении давления 3) понижении температуры
2) использовании катализатора 4) повышении концентрации NOCl2
19. Для смещения равновесия в системе SO2(г)+Cl2(г) SO2Cl2(г), H <0 в сторону продуктов
SO2Cl2(г), H <0 в сторону продуктов
реакции необходимо_____,
1) |
понизить температуру |
3) |
понизить концентрацию SO2 |
|
2) |
понизить давление |
4) |
ввести катализатор |
5) повысить температуру |
28
|
|
|
29 |
|
|
|
|
20. На состояние химического равновесия в системе 2SO2(г) + О2 |
(г) ↔2 SO3, H0 |
< 0 не |
|||||
влияет____ |
|
|
|
|
|
|
|
1) |
катализатор |
|
|
3) |
изменение температуры |
|
|
2) |
изменение концентрации исходных веществ 4) |
изменение давления |
|
||||
21. Для |
нахождения |
0 реакции |
2Н |
S(г.) SO (г.) 3S( ромб.) 2Н О(ж.) , |
следует |
||
|
|
298 |
2 |
|
2 |
2 |
|
воспользоваться формулой:
1)0298 2 0298, Н 2 S (г.) 0298, SO2 (г.) 2 0298, Н 2O(ж.)
2)0298 0298, Н 2О(ж.) 0298, H 2 S (г.) 0298,SO2 (г.)
3)0298 0298, Н 2 S (г.) 0298,SO2 (г.) 0298, Н 2O(ж.)
4)0298 2 0298, Н 2О(ж.) 2 0298, Н 2 S (г.) 0298,SO2 (ж.)
22. Для нахождения S2980 реакции 2C2 H2 г 5О2 г 4СО2 г 2Н2О ж следует воспользоваться
формулой: 1) S2980 4S2980 CO2 (г) 2S2980 Н2О(ж) 2S2980 C2 Н2 (г)
2)S2980 S2980 CO2 (г ) S2980 Н2О( ж) S2980 C2 Н2 (г) S2980 O2 (г)
3)S2980 4 S2980 CO2 (г) 2 S2980 Н2О(ж) 2 S2980 C2 Н2 (г)
4)S2980 4S2980 CO2 (г) 2S2980 Н2О(ж) 2S2980 C2 Н2 (г) 5S2980 O2 (г)
Занятие 1.1.3 ТЕМА: Растворы. Коллигативные свойства растворов.
ЦЕЛЬ: Изучить коллигативные свойства растворов и приобрести навыки криометрических измерений.
ЗНАТЬ:
1.Растворы, определение. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее роль в качестве единственного биорастворителя. Строение воды, образование межмолекулярных водородных связей.
2.Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр.
3.Зависимость растворимости вещества в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий на растворимость.
4.Понятие об идеальном растворе.
5.Закон Рауля и следствия из него: понижение температуры замерзания, повышение температуры кипения раствора.
6.Коллигативные свойства разбавленных растворов неэлектролитов.
7.Коллигативные свойства разбавленных растворов электролитов.
8.Осмос. Омотическое давление: закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
9.Понятие о изоосмии. Роль осмоса в биологических системах. Плазмолиз, гемолиз.
10.Законы растворения газов в воде и биологических жидкостях.
УМЕТЬ:
1.Самостоятельно пользоваться учебной, научной и справочной литературой.
2.Пользоваться химическим оборудованием (термометром, прибором для криометрических измерений, химической посудой и т.д.).
3.Наблюдать за протеканием физических процессов и делать обоснованные выводы.
29

30
4.По экспериментально найденному понижению температуры замерзания раствора рассчитать изотонический коэффициент и осмотическую концентрацию.
5.Рассчитывать давление пара над раствором, температуру кипения, замерзания, осмотическое давление растворов электролитов и неэлектролитов, молярную массу вещества эбулиометрическим и криометрическим методом.
6.Уметь применять законы Генри, Дальтона и Сеченова при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками безопасной работы в химической лаборатории.
3.Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №2 «Определение осмотической концентрации и изотонического коэффициента раствора электролита»
Основные уравнения по теме: «Растворы. Коллигативные свойства растворов»
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m(х) |
Способы выражения концентрации растворов: |
|||||||||||||||||||||
1. |
|
|
|
( Х ) |
|
|
100% |
массовая доля (%) |
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
m( р ра) |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
2. |
|
|
С( Х ) |
|
|
|
|
|
|
n( Х ) |
|
|
|
|
|
m( Х ) |
|
|
|
молярная концентрация (моль/л) |
||||||||||||||||
|
|
V ( р ра) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
M ( Х ) V ( р |
ра) |
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
n( |
1 |
|
Х ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
3. |
|
С( |
|
Х ) |
|
|
|
|
|
|
|
молярная концентрация эквивалента (моль/л) |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
z |
|
|
|
V ( р ра) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
где, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
n( |
1 |
Х ) |
|
m( Х ) |
С( |
1 |
Х ) |
|
|
m( Х ) |
M ( |
1 |
Х ) |
1 |
М ( Х ) |
|||||||||||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|||||||||||||
|
|
z |
|
|
|
M ( |
Х ) |
|
|
|
z |
|
M ( |
Х ) V ( р ра) |
|
z |
z |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
4. |
|
|
b( Х ) |
|
z n( Х ) |
|
|
|
|
m(х) |
z |
|
|
моляльная концентрация (моль/кг) |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
m( р ль) |
M (х) m( р ль) |
|
|
|
|
|
|
||||||||||||||||||||||||||
5. |
( Х |
) |
|
|
|
|
|
n( Хi) |
|
|
молярная доля |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
i |
|
|
n( р р) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
i
6. |
( Х ) |
V ( Х ) |
|||
|
V ( р ра) |
||||
7. |
Т ( Х ) |
m( Х ) |
|
||
V ( Х ) |
|||||
|
|
||||
8. P = P0× (X1)
9. Р 0 0 Р ( Х 2 )
Р
10. ∆Р = Р0×χ(Х2)
объёмная доля
титр (г/мл)
закон Рауля
закон Рауля
закон Рауля
11.Tк = Кэ × b(x) - повышение температуры кипения растворов
12.Tз = Кз × b(x) - понижение температуры замерзания растворов
30

|
|
|
|
31 |
М ( Х ) |
k э m(х) 1000 |
расчёт молярной массы вещества эбулиометрическим |
||
m( р ля) Т кип |
|
|||
|
|
|
|
методом |
14. М ( Х ) |
k з m( х) 1000 |
расчёт молярной массы вещества криометрическим |
||
m( р ля) Т зам |
||||
|
|
|
|
методом |
15.осм. = С(х) × RT - уравнение Вант-Гоффа
16. |
М ( Х ) |
|
m( Х )RT |
|
осмометрическое определение молярной массы вещества. |
||||||
|
осмVр ра |
||||||||||
|
|
|
|
|
|
|
|
|
|||
17. |
i |
практ |
|
|
Ткип.практ |
|
Т зам.практ |
|
осм.прак |
- расчет изотонического коэффициента |
|
теор |
|
Ткип.теор |
Т зам.теор |
осм.теор |
|||||||
|
|
|
|
|
|
|
|||||
Уравнения коллигативных свойств растворов электролитов:
1.P = i P0 (X2)
2.Tкип = i ×Кэ ×b (х)
3.Tзам = i ×Кз × b (x)
4.осм. = i ×C(х) ×R×T
Обучающие задачи Задача 1. Какой объем раствора серной кислоты с массовой долей 98 % (ρ = 1,81г/мл) необходимо
взять для приготовления 500 мл раствора с молярной концентрацией кислоты 0,25 моль/л. (Кз=1,86 кг×К/моль)
Решение:
С(H |
2SO4 ) |
n(H |
2 SO4 ) |
|
V ( р ра) |
||||
|
|
|||
n (H2SO4) = C (H2SO4) × V (p-pa) = 0,25 моль/л×0,5л = 0,125моль
2. m (H2SO4) = n (H2SO4)×M (H2SO4) M (H2SO4) = 2 + 32 + 64 = 98 г/моль
m (H2SO4) = 0,125моль×98 г/моль = 12,25 г
m(H 2 SO4 ) 100% m( р ра)
m( р ра) 1298,25100% 12,5г
V ( р ра) |
m( р ра) |
|
||||
|
|
|
|
|||
|
|
( р ра) |
|
|||
V ( р ра) |
|
12,5г |
|
6,9мл |
||
1,81г / мл |
||||||
|
|
|
||||
Ответ: V(р-ра) = 6,9 мл
Задача 2. Вычислите температуру замерзания раствора, содержащего 10г глюкозы в 180г воды (изотонический раствор).
Решение:
1. Tзам = K∙× b (C6H12O6)
b(C6 H12 O6 ) |
m(C6 H12 O6 ) 1000 |
|
m(H 2 O) M (C6 H12 O6 ) |
||
|
31
|
|
|
|
|
|
32 |
|
|
|
|
|
kз m(C6 H12O6 ) 1000 |
|
|
1,86 10 1000 |
|
18600 |
0,57K |
|
|
|
|
|||||||
зам |
|
m(H 2O) M (C6 H12O6 ) |
|
180 180 |
32400 |
||||
|
|
|
|||||||
Tзам раствора = Tзам. р-ля - Tзам.
Tзам. раствора = 273 - 0,57 = 272,430К или -0,570С
Ответ: -0,570 С
Задача 3. Определите осмотическое давление при 370С в растворе с молярной концентрацией NaCl 0,16 моль/л. Будет ли этот раствор изотоничен плазме крови? Изотонический коэффициент NaCl равен 1,95.
Решение:
= i×C (NaCl)∙×R×T R = 8,31 кПа×л/моль×К T = 273 + 37 = 310 K
= 1,95 × 0,16моль/л × 8,31кПа×л/моль×К × 310К = 803,7 кПа Осмотическое давление близко плазме крови, раствор изотоничен плазме крови.
Задачи для самостоятельной работы Задача 1. Вычислить молярную, моляльную, моль-эквивалентную концентрации и молярную
долю фосфорной кислоты в 10% её водном растворе с плотностью 1,075 г/мл.
Ответ: С(Н3РO4)=1,097 моль/л; b(Н3РO4)=1,134моль/кг; С(1/3Н3РO4)=3,29 моль/л; χ (Н3РO4)=0,02
Задача 2. Глицерин массой 5,66г растворили в воде массой 200г. Определите температуру кипения и замерзания данного раствора (КЭ(вода) =0,52К×кг/моль, Кзам. (вода) =1,86 К×кг/моль)
Ответ: Ткип =100,160С, Тзам. = - 0,570С
Задача 3. Рассчитайте осмотическое давление при t=370С 10% водного раствора маннита (С6Н14О6) с плотностью 1,04 г/мл, применяющегося для понижения внутричерепного давления. Каким является этот раствор (гипо-, гипер-, или изотоническим) по отношению к плазме крови.
Ответ: Посм= 1472 кПа
Задача 4. Хлорид калия вводят внутривенно при аритмиях, гипокалиемии. Рассчитайте, сколько граммов хлорида калия необходимо для приготовления 200мл раствора изотоничного плазме крови. Степень диссоциации хлорида калия 95%.
Ответ:2,31г.
Задача 5. Опишите поведение эритроцитов при 310К в растворе глюкозы с ω=3% (плотность 1,006 г/мл). Ответ подтвердите расчётами.
Ответ: гемолиз, Посм= 432 кПа Задача 6. При несахарном диабете выделяются очень большие количества разбавленной мочи,
осмотическое давление которой может снижаться до 155кПа. Вычислите осмомолярность такой мочи при 310 К.
Ответ: Сосм = 0,06 осмоль/л Задача 7. Плазме крови изотоничен раствор хлорида натрия с массовой долей 0,9%. Плотность
раствора 1,005г/мл. Вычислите изотонический коэффициент хлорида натрия в этом растворе.
Ответ: i = 1,95
Тестовые вопросы
|
|
|
|
|
|
|
1,86 |
град кг |
||
1. |
Раствор, содержащий 4,6 г глицерина (М=92) в 100 г воды К |
Н О |
|
, замерзает |
||||||
моль |
||||||||||
|
|
|
|
|
|
2 |
|
|
||
при темпратуре___ С. |
|
|
|
|
|
|
|
|||
|
1) |
-0,465 |
2) -0,372 |
3) 0,186 |
4) -0,93 |
|
|
|
||
2. |
Растворение твердых веществ в воде характеризуется: |
|
|
|
|
|
||||
|
1) |
0, S 0 |
3) |
0, S=0 |
|
|
|
|
|
|
|
2) |
0, S 0 |
4) |
=0, S 0 |
|
|
|
|
|
|
32
|
|
|
|
33 |
|
3. |
Сольватирование частиц растворенного вещества является процессом_____. |
||||
|
1) |
Эндотермическим |
3) |
Экзотермическим |
|
|
2) |
Физическим |
4) |
Необратимым |
|
4. |
Растворимость газов в жидкости повышается при______. |
||||
|
1) |
понижении температуры |
|
3) |
повышении температуры |
|
2) |
понижении давления газа |
|
4) |
введении в жидкость электролитов |
5. Зависимость растворимости газа от концентрации электролита в растворе описывается
законом____ . |
1) |
Генри |
3) Вант-Гоффа |
|
2) |
Рауля |
4) Сеченова |
6. Осмотическое давление раствора глюкозы с молярной концентрацией 0,1 моль/л при 25 С
равно _____ кПа. |
|
|
|
|
|
|
|
1) |
61,9 |
2) |
51,6 |
3) |
123,8 |
4) |
247,6 |
7. Осмотическое давление раствора хлорида натрия с молярной концентрацией 0,1 моль/л
(изотонический коэффициент 1,95) при 25 С равно _____ кПа. |
||||||||
1) |
247,6 |
2) |
482,9 |
3) |
20,8 |
4) |
40,5 |
|
8. Уравнение π=СRT является математическим выражением закона_____. |
||||||||
1) |
Вант-Гоффа |
|
3) |
Дальтона |
|
|
|
|
2) |
Рауля |
|
4) |
Сеченова |
|
|
|
|
9. Осмолярная концентрация раствора глюкозы, если при температуре 25 С его
осмотическое давление равно 247,6 кПа, составляет _____ моль/л.
1) 1,2 2) 0,12 3) 0,1 4) 12
10. Процесс перехода молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется___.
1) |
электролитическая диссоциация |
3) |
осмос |
2) |
гидролиз |
4) |
диффузия |
11. Растворы хлорида натрия и глюкозы с одинаковой концентрацией имеют_______. |
|||
1) |
Одинаковое осмотической давление |
3) |
Одинаковое давление пара над раствором |
2) |
Разное осмотическое давление |
4) |
Разный цвет |
12. |
Водный раствор глюкозы с моляльной концентрацией 0,5 моль/кг замерзнет при |
|||||||
температуре___ С. Криоскопическая постоянная воды равна 1,86 |
кг×К/моль. |
|||||||
|
1) |
– 0,93 |
2) |
0,93 |
3) 0 |
|
4) – 3,72 |
|
13. |
Водный раствор глюкозы с моляльной концентрацией 1 моль/кг закипит при |
|||||||
температуре ___ С. Эбулиоскопическая постоянная воды 0,516 кг×К/моль. |
||||||||
|
1) |
0,516 |
2) |
100,516 |
3) |
273,516 |
4) |
298,516 |
33
34
14. Растворы глицерина и глюкозы будут иметь одинаковое осмотическое давление при
25 С, если у них ____.
1) |
Одинаковый объем |
3) |
Разная концентрация |
2) |
Одинаковая концентрация |
4) |
Разный объем |
15. В случае равных моляльных концентраций наибольшее понижение температуры будет в растворе______.
1) С6Н12О6 |
2) NaCl |
3) KCl |
4) CaCl2 |
16. Повышение температуры кипения раствора по сравнению с чистым растворителем является следствием_________.
1)понижения давления пара над раствором;
2)повышения давления пара над раствором;
3)повышения плотности раствора;
4)изменения поверхностного натяжения раствора.
Занятие 1.1.4 ТЕМА: Протолитические реакции. Буферные растворы.
ЦЕЛЬ: Познакомиться с основами протолитических процессов, протекающих в организме человека, усвоить природу протолитического гомеостаза и возможные причины его нарушения.
ЗНАТЬ:
1.Основные положения протолитической теории кислот и оснований. Кислоты и основания по Бренстеду-Лоури, сопряженные кислоты и основания. Константы кислотности и основности. Показатели кислотности (рКа) и основности (рКb). Связь между константой кислотности и константой основности в сопряжённой протолитической паре.
2.Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели, рН биологических жидкостей.
3.Изменение рН органов и тканей при различных заболеваниях. Ацидоз. Алкалоз. Способы их устранения.
4.Гидролиз солей. Степень и константа гидролиза. Амфолиты. Изоэлектрическая точка.
5.Буферные системы. Механизм буферного действия систем I и II типа. Расчет рН буферных систем при добавлении сильной кислоты или сильного основания.
6.Буферное действие. Буферная ёмкость. Расчет буферной ёмкости по кислоте и по основанию. Факторы влияющие на буферную ёмкость.
7.Буферные системы крови. Сравнительная буферная емкость буферных систем крови. Бикарбонатная, фосфатная, белковая, гемоглобиновая буферные системы. Механизм действия. Формулы для расчета.
8.Применение реакции нейтрализации в фармакотерапии.
УМЕТЬ:
1.Самостоятельно пользоваться учебной, научной и справочной литературой.
2.Пользоваться химической посудой (бюретки, пипетки, конические колбы и т.д.).
3.Готовить буферные смеси с определёнными значениями рН среды и определять буферную ёмкость методом титрования.
5.Рассчитывать рН и рОН сильных (слабых) электролитов и буферных систем.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками приготовления буферных смесей.
3.Навыками оформления результатов и выводов экспериментальных работ.
34

35
Лабораторная работа №3 «Свойства буферных растворов»
Основные уравнения по теме: «Протолитические реакции. Буферные растворы»
1.рKa = -lgKa - показатель константы кислотности
2.рKb =-lgKb - показатель константы основности
3.рH = -lg [H+] - водородный показатель среды
4.pOH = -lg [OH-] - гидроксильный показатель среды
5.[H+]×[OH-] = 1×10-14 - ионное произведение воды pH + pOH = 14
6. |
Kq |
- закон разведения Оствальда |
С (кислоты) |
7. рH = 1/2 [pKa - lgC(1/z кислоты)] - расчет рН для растворов слабых кислот
8. pH = 14-1/2 [pKb - lgC(1/z основания)] - расчет рН для растворов слабых оснований
9. K г |
|
|
|
K W |
|
|
- |
расчёт константы гидролиза соли слабой кислоты и сильного основания |
||||||||
|
|
K а |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
10. K г |
|
|
K W |
|
- |
расчёт константы гидролиза соли слабого основания и сильной кислоты |
||||||||||
|
K b |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
C(OH ) |
|
|
|
C( H ) |
|
|
|
|
|
|||||
11. h |
|
|
h |
h |
K г |
|
|
|||||||||
|
|
|
|
|
|
, |
|
, |
Cсоли |
|
- степень гидролиза соли |
|||||
|
|
|
|
|
|
|||||||||||
|
|
|
Cсоли |
|
|
|
Cсоли |
|
|
|
|
|||||
12.pH 7 12 pKb 12 lgCсоли - расчёт рН раствора соли, гидролизующейся по катиону
13.pH 7 12 pKa 12 lgCсоли - расчёт рН раствора соли, гидролизующейся по аниону
14. |
pH pKa |
lg |
Cсоли |
|
- расчет рН для буферных систем I типа |
||||||||||||||||||||||||||
Cк ты |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
15. |
pH 14 pKb lg |
Cоснования |
- расчет рН для буферных систем II типа |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cсоли |
|
|
|
|
|
|
|
||||||
|
|
|
n( |
1 |
к ты) |
|
|
|
|
|
C( |
1 |
к ты) V |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
z |
|
|
к -ты |
|
|
|||||
16. |
Ba |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- определение буферной емкости по кислоте |
||||||||
|
|
|
|
|
|
pH |
|
|
|
|
|
|
|
|
|
( pH1 pH2 ) |
|||||||||||||||
|
|
Vбуф. р ра |
|
|
|
Vбуф.р-ра |
|
||||||||||||||||||||||||
|
|
|
n( |
1 |
осн я) |
|
|
|
C( |
1 |
осн я) V |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
z |
|
|
осн |
|
|
|
|
||||
17. Bb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- определение буферной емкости по основанию |
|||||||||
V |
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
( pH pH |
) |
||||||||||||
|
|
ра |
pH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
буф. р |
|
|
|
|
|
|
|
|
|
буф.р-ра |
|
1 |
2 |
|
|
|
|||||||||||||
18. |
pH 6,36 lg |
C(HCO3 ) |
- уравнение Гендерсона-Гассельбаха для бикарбонатной |
||||||||||||||||||||||||||||
|
|
PCO |
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
буферной системы
35

36
19.HHb + O2 + HCO3- = HbO2- + H2CO3 - суммарный процесс, протекающий в легочных капиллярах
20.HbO2- + H2CO3 = O2 + HHb + HCO3 - - суммарный процесс, протекающий в тканевых капиллярах
Обучающие задачи Задача 1. Биологические жидкости имеют следующие значения рН: слюна 6,8; желудочный сок
1,5; кровь 7,4. Рассчитайте концентрацию ионов водорода в каждой из указанных жидкостей.
Решение: рН= - lg [H+] , |
lg [H+] = - pH |
|
|
а) слюна рН = |
6,8 , отсюда |
lg [H+] = -6,8 |
|
[H+]=10-6,8=1,59∙ 10 -7 моль/л |
|
||
б) желудочный сок рН = 1,5 |
|
|
|
рН= - lg [H+] , |
lg [H+] = - pH, отсюда lg [H+] = - 1,5 |
|
|
[H+]=10-1,5=3,16∙ 10 -2 моль/л |
|
||
в) кровь рН = 7,4 |
|
|
|
рН= - lg [H+] , |
lg [H+] = - pH |
|
|
отсюда lg [H+] = -7,4 |
|
|
|
[H+]=10-7,4 = 4,0 10 -8 моль/л |
|
|
|
Ответ: слюна [H+] = 1,59∙ 10-7моль/л, желудочный сок [H+] = 3,16 10-2 моль/л, кровь |
[H+] = 4 10 |
||
-8 моль/л.
Задача 2. Вычислите степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента 0,001 моль/л. Ка (СН3СООН) = 1,8 10-5. Найти концентрацию ионов водорода и рН данного раствора.
Решение: |
|
рН = 1/2 [pKa - lgC(CH3COOH)]; |
pH = 1/2 [4,75 - lg 0,001] = 1/2∙ 7,75 = 3,875 |
[H+] = 10-pH = 10-3,875 = 1,35 ×10 -4; |
|
[H+] = 1,35 10-4 моль/л. |
|
|
|
Kа |
|
|
|
[H ] |
|
1,35 10 4 |
1 |
|
|
|
|
или |
|
|
|
|
|
1,35 10 |
или 13,5% |
||
C |
|
|
|
3 |
|||||||
|
|
|
|
|
C |
|
1 10 |
|
|
||
Ответ: [H+] = 1,35 10-4 моль/л, рН = 3,875, α = 13,5%.
Задача 3. В клинических и биохимических лабораториях применяется ацетатный буфер, который содержит уксусную кислоту 12 г/л и ацетат натрия 16,4 г/л. Определите концентрацию в моль/л уксусной кислоты и ацетата натрия, рН буферного раствора, зону буферного действия. (Ка
(СН3СООН) = 1,8 10-5).
Решение:
С(СН3СООН ) |
|
n(CH3COOH ) |
|
|
|
n(CH |
3COOH ) |
m(CH |
3COOH ) |
|
||||||
|
|
|
Vр ра |
|
|
M (CH 3COOH ) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
M (CH3COOH) = 12+3+12+32+1 = 60 г/моль |
|
|
|
|
|
|
||||||||||
n(CH COOH ) |
12 |
0,2моль |
|
|
|
С(СH COOH ) |
0,2 |
0,2моль/ л |
||||||||
|
|
|
|
|
|
|
||||||||||
|
3 |
60 |
|
|
|
|
|
3 |
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
n(СН |
3СООNa) |
|
m(CH 3COOH ) |
|
16,4 |
0,2моль |
|
|
|
|
|
|||||
|
M (CH 3COOH ) |
|
82 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
M (CH3COONa) = 12+3+12+32+23 = 82 г/моль.
0,2
С(СН 3СООNa) 0,2моль
1
36

37
рН рК lg C(CH 3COONa) C(CH 3COOH )
pH lg1,8 10 5 lg 00,,22 4,75
Ответ: С(CH3COOH)=0,2 моль/л, С(CH3COONa) =0,2 моль/л, pH = 4,75, зона буферного действия
4,75 1
Задача 4. Напишите уравнения гидролиза: CuCl2, Na2SO3, Cr2S3, NaCl, тристеарид, глицил-глицин, этилэтаноат, АТФ.
Решение:
CuCl2 – растворимая в воде соль, образована катионом слабого основания и анионом сильной кислоты, подвергается гидролизу. Гидролиз протекает по катиону слабого основания, рН<7.
При обычных условиях гидролиз протекает преимущественно по I ступени.
CuCl2 = Cu2+ + 2Cl-
Cu2+ +HOH ↔ CuOH+ + H+ CuCl2 + HOH ↔ CuOHCl + HCl
Na2SO3 – растворимая в воде соль, образована катионом сильного основания и анионом слабой кислоты, подвергается гидролизу. Гидролиз протекает по аниону слабой кислоты, рН>7.
Na2SO3 = 2Na+ + SO32-
SO32- + HOH ↔ HSO3- + OH-
Na2SO3 + HOH ↔ NaHSO3 + NaOH
Cr2S3 – соль, образованная слабым нерастворимым в воде основанием и слабой летучей кислотой. В водном растворе соль не существует, так как подвергается полному гидролизу:
Cr2S3 + 6HOH = 2Cr(OH)3↓ + 3H2S↑
NaCl – растворимая в воде соль, образована катионом сильного основания и анионом сильной кислоты. Гидролизу не подвергается.
Тристеарид – это жир, образованный многоатомным спиртом глицерином и стеариновой кислотой, эти вещества и получаются при гидролизе:
CH2-O-CO-C17H35 |
CH2-OH |
| |
| |
CH-O-CO-C17H35 |
+ 3H2O ↔ CH-OH + 3C17H35COOH |
| |
| |
CH2-O-CO-C17H35 |
CH2-OH |
Глицилглицин – дипептид, при его гидролизе происходит разрыв пептидной связи
NH2-CH2-CO-NH-CH2-COOH + H2O ↔ NH2-CH2-COOH + NH2-CH2-COOH
Этилэтаноат – сложный эфир, при гидролизе которого образуются спирт и карбоновая кислота.
СH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH
Аденозинтрифосфат (АТФ) – главный источник энергии для многих биологических процессов – биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток. Гидролиз АТФ записывают в виде кислотно-основного равновесия:
АТФ4- + HOH ↔ АДФ3- + HPO42- + H+, ∆G0=-30,5кДж/моль
Задача 5. Определить рН раствора, константу и степень гидролиза ацетата калия, если молярная концентрация соли равна 0,1 моль/л, а Kа(СН3СООН)=1,8×10-5.
Решение: Уравнение гидролиза СН3СООК + НОН ↔ СН3СООН + КОН СН3СОО- + НОН ↔ СН3СООН + ОН- Вычислим константу гидролиза
K |
|
|
K W |
|
1 10 14 |
5,6 10 |
10 |
|
г |
K |
|
1,8 10 5 |
|
||||
|
|
|
|
|
|
|||
|
|
|
a |
|
|
|
||
|
|
|
|
|
|
|
|
|
Рассчитаем степень гидролиза
37

38
h |
K |
г |
|
|
5,6 10 10 |
|
7,5 10 |
5 |
Cсоли |
10 1 |
|
|
|||||
|
|
|
|
|
|
|||
Определяем концентрацию гидроксид-ионов в растворе и рОН С(ОН-)= h×Cсоли = 7,5×10-5×0,1 = 7,5×10-6 (моль/л)
рOН = -lg[OH-] = -lg7,5×10-6 = 5,12 pH = 14 – pOH = 14 – 5,12 = 8,88
Ответ: рН = 8,88, Кг = 5,6×10-10, h = 7,5×10-5
Задачи для самостоятельного решения:
Задача 1. Вычислите степень диссоциации и рН хлорноватистой кислоты, если Ка(НCIO)=2,82 10-8, а концентрация 0,1 моль/л
Ответ: рН = 4,28; α= 0,053 %
Задача 2. Концентрация ионов [OH-] в растворе равна 5,9×10-7 моль/л. Вычислите рН этого раствора.
Ответ: рН=7,77
Задача 3. Среднее значение рН внеклеточной среды 7,4, а внутриклеточной – 6,9. В какой среде концентрация протонов выше и во сколько раз?
Ответ: в 3,16 раза выше внутри клеток Задача 4. Определите концентрацию ионов водорода в моче, если её рН=4,8 - 7,5.
Ответ: 1,58 10-5 - 3,16 10-8
Задача 5. Вычислите молярное соотношение компонентов буферной системы, содержащей аммиак и хлорид аммония, если рН = 9,8, Кв(NH4OH)= 1,79 10-5.
Ответ: 3,55
Задача 6. В качестве консерванта пищевых продуктов часто применяется бензоат натрия. Вычислите соотношение бензоат-иона и бензойной кислоты в желудочном содержимом.
рН желудочного сока в норме 0,9; Ка(бенз. к-ты)=6,14 10-5.
Ответ: 5 10- 4
Задача 7. Как изменится рН ацетатного буферного раствора, содержащего 200 мл раствора уксусной кислоты и 400 мл раствора ацетата натрия (концентрации исходных растворов равны по 0,1 моль/л) при добавлении к нему 20 мл раствора NaOН с концентрацией 0,2 моль/л,
Ка(СH3СОOH)=1,8 10-5.
Ответ: ∆рН=0,14
Задача 8. Сколько мл 4% раствора гидрокарбоната натрия необходимо ввести больному для нормализации крови при ацидозе, если рН его крови 7,25 (нижняя граница 7,35) общее количество крови 5л, буферная емкость по основанию 45 ммоль/л
Ответ: V(р-ра NaHCO3)= 47 мл
Задача 9. Напишите по стадиям уравнения реакций гидролиза следующих солей: CrCl3, К3РО4. На основании чего можно утверждать, что последняя стадия реакции гидролиза этих солей не происходит.
|
|
|
Тестовые вопросы |
|
1. |
Сокращенное молекулярно-ионное уравнение Ва+2+SO42-=BaSO4 соответствует реакции: |
|||
|
1) |
Ba(NO3)2+SO2 |
2) |
BaCO3+H2SO4 |
|
3) |
BaCl2+Na2SO4 |
4) |
Ba3(PO4)2+H2SO4 |
2. |
Полному гидролизу подвергаются соли___. |
|||
|
1) |
CrCl3 |
3) Cr2S3 |
|
|
2) |
Al2(SO4)3 |
4) Cs2CO3 |
|
3. |
Нейтральную среду имеют растворы солей ___. |
|||
38
|
|
|
|
|
|
|
39 |
|
|
|
1) |
RbNO3 |
2) HCOOK |
|
3) BaCl2 |
|
4) CsF |
||
4. |
Кислую среду имеют растворы солей___. |
|
|
||||||
|
1) |
K2SiO3 |
2) AlCl3 |
|
|
|
3) (NH4)2SO4 |
4) CaCl2 |
|
5. |
Сильными электролитами являются ____. |
|
|
||||||
|
1) |
HI |
2) CuSO4 |
3) NH4OH |
4) Ca3(PO4)2 |
||||
6. |
Отношение числа молекул, диссоциирующих на ионы, к общему числу молекул |
||||||||
растворенного вещества, называется _____ диссоциации. |
|||||||||
|
1) |
коэффициентом |
|
|
3) |
показателем |
|
|
|
|
2) |
степенью |
|
|
|
4) |
константой |
|
|
7. |
В водном растворе гидролизу не подвергаются соли____. |
||||||||
|
1) |
K2SiO3 |
2) K2SO4 |
|
|
|
3) AlCl3 |
|
4) NaNO3 |
8. |
Среда водного раствора хлорида аммония____. |
|
|
||||||
|
1) |
слабощелочная |
3) |
нейтральная |
|
|
|||
|
2) |
кислая |
|
4) |
сильнощелочная |
|
|
||
9. |
Диссоциация по трем ступеням возможна в растворе________. |
||||||||
|
1) |
хлорида алюминия |
|
3) |
фосфата калия |
|
|
||
|
2) |
нитрата алюминия |
|
4) |
ортофосфорной кислоты |
||||
10. Ионы I-образуются при диссоциации____. |
|
|
|||||||
|
1) |
KIO3 |
2) KI |
|
|
3) C2H5I |
|
4) NaIO4 |
|
11. Лакмус краснеет в растворе соли _____ |
|
|
|
||||||
|
1) |
FeSO4 |
2) KNO3 |
|
|
|
3) NaCI |
|
4) Na2CO3 |
12. Вещество, при диссоциации которого образуются ионы Na+, H+, а также анионы SO42-
является___.
1) |
кислотой |
3) |
средней солью |
2) |
щелочью |
4) |
кислой солью |
13. Кислую среду имеет водный раствор____.
1) |
карбоната натрия |
3) |
иодида калия |
2) |
нитрата калия |
4) |
хлорида алюминия |
14. Сокращенное ионное уравнение Fe2+ + 2OH- =Fe(OH)2 соответствует взаимодействию веществ:
1) |
Fe(NO)3 и KOH |
3) Na2S и Fe(NO3)2 |
2) |
FeSO4 и LiOH |
4) Ba(OH)2 и FeCI3 |
15. Сокращенное ионное |
уравнение Ba2+ + SO42-- = BaSO4 соответствует взаимодействию |
|
веществ: 1) |
BaCI2 и K2SO4 |
3) Ba(OH)2 и H2SO4 |
2) |
BaO и H2SO4 |
4) BaSO4 и FeCI3 |
16. Среда водного раствора сульфата алюминия_____.
39
|
|
|
40 |
1) |
щелочная |
3) |
нейтральная |
2) |
кислая |
4) |
слабощелочная |
17. Наиболее слабым электролитом является____.
1) HF |
2) HCI |
3) HBr |
4) HI |
18. В качестве анионов только ионы ОН- образуются при диссоциации___.
1) CH3OH |
2) Zn(OH)Br |
3) NaOH |
4) CH3COOH |
19. Щелочную и кислую реакцию среды соответственно имеют растворы солей____.
1) |
Na2CO3 и Ba(NO3)2 |
3) FeCI3 и ZnSO4 |
2) |
Na2SiO3 и CuCI2 |
4) BaCI2 и Ca(NO3)2 |
20. Концентрация ионов Н + в чистой дистиллированной воде при 20˚С равно___ моль/л.
1) 7 |
2) 14 |
3) 10-7 |
4) 10-14 |
Кислотно - основное состояние ( КОС ) организма. Буферные системы крови
Буферные системы имеют большое значение в поддержании кислотно-основного равновесия организма. Внутриклеточные и внеклеточные жидкости всех живых организмов, как правило, характеризуются постоянным значением рН, которое поддерживается с помощью различных буферных систем. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8.
Кислотно-основное равновесие в крови человека обеспечивается водородкарбонатной, фосфатной и белковой буферными системами.
Нормальное значение рН плазмы крови составляет 7,4±0,05. Этому соответствует интервал значений активной кислотности [H+] от 3,7 до 4,0х10-8 моль/л. Так как в крови присутствуют различные электролиты - НСО3-, Н2СО3, Н2РO4--, НРO42--, белки, аминокислоты, это означает, что они диссоциируют в такой степени, чтобы активность а(Н+) находилась в указанном интервале.
ПЛАЗМА КРОВИ. Водородкарбонатная буферная система НСО3-/Н2СО3 состоит из угольной кислоты Н2СО3 и сопряженного основания НСО3-. Это наиболее важная буферная система крови. Ее особенность состоит в том, что один из компонентов -угольная кислота - образуется при взаимодействии растворенного в плазме СО2 с водой:
СО2(р) + H2O Н2СО3
Константа равновесия этой реакции:
[H2CO3]
К =
[ СО2]р
где [CO2] p - концентрация растворенного CO2. Между СО2 в альвеолах и водородкарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий:
|
+Н2О |
Атмосфера(1) [ СО2]г (2) [ СО2]р (3) Н2СО3 Н+ + НСО3- |
|
|
-Н2О |
воздушное пространство легких |
плазма крови |
В соответствии с уравнением Гендерсона-Гассельбаха рН водородкарбонатного буферного раствора определяется отношением концентрации кислоты Н2СО3 и соли NaНСО3
рН = рКа1(Н2СОз) + lg С(NаНСOз)/С(Н2СОз )
Согласно цепочке содержание Н2СОз определяется концентрацией растворенного CO2 , которая по закону Генри пропорциональна парциальному давлению CO2 в газовой фазе [СО2]р = КГр
40
41
(CO2). В конечном счете оказывается, что с(H2СОз) пропорциональна р(СО2), и выражение принимает вид:
рН = 6,36 +lg С(NаНСОз) – lg р(СО2), где 6,36 - отрицательный десятичный логарифм константы диссоциации угольной кислоты рКа (Н2СОз) с поправкой на константу Генри; р(СО2) - пропорциональное давление CO2 в альвеолярных легких.
Водороднокарбонатная буферная система действует как эффективный буфер при рН = 7,4. При поступлении в кровь кислоты - доноров Н+ равновесие 3 смещается влево по принципу ЛеШателье в результате того что Н+ связываются с НСОз- в молекулы Н2СОз. При этом концентрация Н2СОз повышается, а концентрация НСОз- соответственно понижается. Повышение концентрации Н2СОз в свою очередь приводит к смещению равновесия 2 влево. Это вызывает распад Н2СОз и увеличения концентрации CO2 , растворенного в плазме. В результате смещается равновесие 1 влево и давление CO2 в легких растет. Избыток CO2 выводится из организма. В результате описанных процессов водородкарбонатная система крови быстро приходит в равновесие с СО2 в альвеолах и эффективно обеспечивает поддержание постоянства рН плазмы крови. Ее буферная емкость по кислоте составляет Ва = 40 ммоль/л плазмы крови, а буферная емкость по щелочи Вв =1-2 ммоль/л плазмы крови.
Фосфатная буферная система HPО42-/H2PО4- состоит из слабой кислоты H2PО4- и сопряженного основания НРО42-. В основе ее действия лежит кислотноосновное равновесие:
Н2РО4- H+ + НР042-
Фосфатная буферная система способна сопротивляться изменению рН в интервале 6,2-8,2 т.е. обеспечивать значительную долю буферной емкости крови. Из уравнения Гендерсона-Гассельбаха для этой буферной системы следует, что в норме при 7,4 отношение концентрации соли (НРО4-2) и кислоты (H2PО4-) примерно составляет 3,5:
рН = 7,4 = 6,86 +lg |
R - CH - COO- + H+ R - CH - COO- |
С(НР042-)/С(Н2Р04-), |
|||
где 6,86 = рКа(H2PО4-) |
|
|
|
||
|
|
|
|||
Отсюда |
lg с(НР042- |
NH2 |
NH3+ |
)/С(Н2Р04-) = 7,4 - 6,86 |
|
белок основание |
белок соль |
||||
= 0,54 и |
С(HP042- |
)/С(H2P04-) = 3,5. |
|||
|
|
||||
Фосфатная буферная система имеет более высокую емкость по кислоте, чем по щелочи. Ва=1-2 ммоль/л, Вв=0,5 ммоль/л. Поэтому фосфатная система участвует в нейтрализации как кислых так основных продуктов метаболизма. В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем водороднокарбонатная буферная система.
Белковая буферная система состоит из «белка-соли» и «белка-основания».
Соответствующее кислотно-основное равновесие в среде, близкой к нейтральной, смещено влево и количество «белка-основания» преобладает.
Основную часть белка плазмы крови ( 90%) составляют альбумины и глобулины. Буферная емкость, определяется белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протон акцепторных групп. Эта система может нейтрализовать как основные так и кислые продукты. Однако, вследствие преобладания форм «белок-основание» ее буферная емкость значительно выше по кислоте и составляет для альбуминов Ва=10 ммоль/л, для глобулинов Ва=3 ммоль/л.
Буферная емкость аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связанно с тем, что почти все аминокислоты имеют значение рКа, очень далекое от рКа=7. Поэтому при физиологическом значении их мощность мала. Практически только одна аминокислота-гистидин (рКа=6) обладает значительным буферным действием, при значениях близких к рН плазмы крови.
41

42
Таким образом, мощность буферных систем плазмы крови уменьшается в направлении
Уменьшение мощности буферных систем
НСО3-/Н2СОз > белки > HP042-/H2P04- > аминокислоты
Эритроциты. Во внутренней среде эритроцитов в норме поддерживается постоянное рН=7,25. Здесь также действуют бикарбонатная, фосфатная и белковая буферные системы (гемоглобиноксигемоглобин), поддерживая постоянную рН внутри эритроцитов, эти системы обеспечивают поддержание рН в целом в плазме крови. Гемоглобиновая буферная система тесно связанна с бикарбонатной. Так, рН в эритроцитах равно 7,25, что меняет соотношение концентрации соли (НСО3-) и кислоты (Н2СОз), оно здесь несколько меньше, чем в плазме крови. Из уравнения Гендерсона - Гассельбаха для буферных систем первого типа следует :
7,25 = 6,4 +lg С(НСОз-)/ С(Н2СОз),
где lgС(НСОз-)/С(Н2СОз) = 0,85 и отношение концентраций равно С(НСОз-)/ С(Н2СОз) = 7/1. Фосфатная буферная система в клетках играет гораздо большую роль, чем в плазме. Прежде
всего это связанно с тем, что в эритроцитах неорганических фосфатов больше чем в плазме крови. Кроме того, большое значение в поддержании постоянного значения рН играют эфиры фосфорных кислот, главное фосфолипиды, составляющие основу мембран эритроцитов.
Таким образом, в поддержании постоянства кислотно-щелочного равновесия в крови участвует ряд буферных систем, обеспечивающих кислотно-основной гомеостаз организма.
Таблица 2 ЗНАЧЕНИЕ рН РАЗЛИЧНЫХ БИОЖИДКОСТЕЙ И ТКАНЕЙ ОРГАНИЗМА
Биожидкость |
РН (в норме) |
|
|
Сыворотка крови |
7,40±0,05 |
|
|
Слюна |
6,35-6,85 |
|
|
Чистый желудочный сок |
0,9-1,1 |
|
|
Моча |
4,8-7,5 |
|
|
Спинномозговая жидкость |
7,40±0,05 |
|
|
Сок поджелудочной железы |
7,5-8,0 |
|
|
Содержимое тонкого кишечника |
7,5-8,0 |
|
|
Желчь в протоках |
7,4-8,5 |
|
|
Желчь в пузыре |
5,4-6,9 |
|
|
Молоко |
6,6-6,9 |
|
|
Водянистая влага глаза (слезная жидкость) |
7,40±0,10 |
|
|
Кожа (внутриклеточная жидкость, различные слои) |
6,2-7,5 |
|
|
Печень (внутриклеточная жидкость) |
|
|
|
купфферовские клетки |
6,4-6,5 |
|
|
клетки по периферии долек |
7,1-7,4 |
|
|
клетки в центре долек |
6,7-6,9 |
|
|
Смещение значения рН крови в кислую область от нормальной величины рН , равной 7,4, называется ацидозом, а в щелочную область - алкалозом.
Оценка нарушений кислотно-основного состояния (КОС) организма
Кислотно-основное состояние (КОС) определяется соотношением кислот и оснований во внутренней среде организма. Поддержание КОС осуществляется физико-химическими
42
43
механизмами, обеспечивающими гомеостаз организма. Важнейшая роль в регуляции КОС принадлежит буферным системам крови (гидрокарбонатной, фосфатной, гемоглобиновой, белковой), немаловажную роль играют также физиологические процессы, происходящие в легких, почках, печени, желудочно-кишечном тракте. Среди органов, участвующих в регуляции КОС, ведущее место занимают легкие и почки. Через легкие удаляется избыток углекислого газа СО2, который образуется в процессе метаболизма углеводов, белков и жиров. Углекислый газ может также дополнительно выделяться легкими при разложении угольной кислоты - компонента гидрокарбонатной буферной системы, при увеличении в крови концентрации метаболитов кислой природы (органических гидрокси-, оксокислот). Почки участвуют в поддержании кислотноосновного состояния путем секреции (выведения) протонов и экскреции (задержке) бикарбонатов (ионов НСО3-).
На фоне различных заболеваний изменения абсолютных концентраций и соотношений между кислотами и основаниями могут быть связаны с отклонениями в метаболизме, либо обусловлены серьезными нарушениями в работе дыхательной системы (гипоили гипервентиляция легких). В связи с этим различают метаболические и дыхательные нарушения КОС.
В клинической практике для оценки кислотно-основного состояния используют следующие показатели:
1. Величина рН, представляет собой отрицательный логарифм концентрации протонов (Н+) в артериальной крови (рН= - lg Н+). рН является наиболее жестким показателем КОС, в норме ее значение соответствует рН=7,4 0,05 (7,35- 7,45), отклонение рН не должно превышать 0,1. Изменение значений рН до 0,3 считаются несовместимым с жизнью.
2.Парциальное давление (напряжение) углекислого газа - рСО2, который находится в плазме крови в равновесии с угольной кислотой Н2СО3, растворенной при 38 . Величина рСО2 представляет собой дыхательный компонент кислотно-основного гомеостаза и характеризует функциональное состояние дыхательной системы. В норме рСО2 = 4 ,7 - 6,0 кПа или 35 - 45 мм рт. ст.
3.Стандартные бикарбонаты (SB) отражают уровень бикарбонат-ионов НСО3- в плазме крови, полностью насыщенной кислородом. У здоровых лиц величина показателя составляет SB = 20-27 ммоль/л. Бикарбонат-ионы представляют собой сопряженные основания, поэтому их концентрация может влиять на показатель КОС, оценивающий общую емкость буферных оснований (ВВ) крови.
4.Буферные основания (ВВ) крови представляют собой сумму всех анионов крови, обладающих буферными свойствами, т. е. в основном бикарбонатов и белковых ионов, при условии полного насыщения крови кислородом при температуре 38° С. Величина ВВ отражает состояние метаболического компонента кислотно-основного состояния. У здоровых лиц ВВ= 44 - 52 ммоль/л.
5.Параметром КОС является величина ВЕ (base excess), характеризующая отклонение от нормы концентрации буферных оснований. Избыток оснований, обозначается (+) (BE), показывает превышение фактической концентрации буферных оснований по сравнению с нормой (норме соответствует ВЕ= от -2,5 до +2,5 ммоль/л). Отрицательные значения (-) ВЕ свидетельствуют о недостатке оснований или об избытке в организме кислот. При введении в кровь оснований, например бикарбоната (гидрокарбоната) натрия значения ВЕ могут быть приближены к показателям нормы. Положительные значения (+)ВЕ, напротив, показывают, что в организме присутствует избыток оснований и недостаток кислот. Изменения ВЕ являются первичными при метаболических нарушениях КОС.
Виды нарушений кислотно-основного состояния (КОС)
При многих заболеваниях в крови количество кислот или оснований может существенно отклоняться от нормы. Эти состояния вызывают напряжения в функционировании регуляторных систем (буферных систем крови, дыхательной и выделительной системы), которые уже не смогут
обеспечивать постоянство значений рН крови. При абсолютной или относительной
43
44
недостаточности механизмов гомеостаза могут происходить нарушения КОС, которые характеризуются развитием состояний ацидоза или алкалоза.
Под ацидозом понимают состояние, при котором в крови появляется абсолютный или относительный избыток кислот, при этом часто повышается концентрация водородных ионов, а значение рН по сравнению с нормой уменьшается (рН ≤7,35).
Алкалоз характеризуется абсолютным или относительным увеличением количества оснований и понижением концентрации водородных ионов, при этом значение рН по сравнению с нормой увеличивается (рН≥7,45).
По механизмам возникновения различают 4 вида нарушений КОС, каждый из которых может быть компенсированным и декомпенсированным.
Метаболический ацидоз. Встречается при диабете, почечной недостаточности, при различных видах кислородного голодания тканей, сопровождающегося образованием недоокисленных продуктов обмена, представляющих собой соединения кислой природы. Кислородное голодание, возникающее при нарушении кровообращения в результате массивной кровопотери, прогрессирующей сердечно-сосудистой недостаточности, приводит к возникновению метаболического ацидоза. Указанное нарушение КОС отмечается также при гнойных заболеваниях (перитонит, абсцесс и др.).
Метаболический ацидоз является наиболее тяжелой формой нарушений кислотноосновного состояния.
Основными признаками метаболического ацидоза являются: отрицательные значения величины (-) ВЕ, указывающей на низкий уровень оснований, снижение абсолютных значений SB и ВВ, низкое рСО2. При этом первичными, наиболее важными показателями, характеризующими метаболический характер нарушений КОС, являются ВЕ и ВВ, тогда как рСО2 отражает компенсаторную реакцию легких (респираторный или дыхательный компонент).
При компенсированной форме метаболического ацидоза в ответ на увеличение количества кислот в крови снижается парциальное давление углекислого газа - рСО2 и общий уровень углекислоты. Величина рН при этом сохраняет нормальные значения.
При декомпенсированных состояниях метаболического ацидоза значение рН становится меньше, чем 7,35. Клинически при декомпенсированном метаболическом ацидозе наблюдаются расстройства сердечной деятельности, глубокое шумное дыхание, нарастает гипоксия и гипоксемия. При снижении рН ниже 7,2 наступает коматозное состояние.
Коррекцию КОС при декомпенсированном метаболическом ацидозе осуществляют введением в кровь бикарбоната натрия NaHCO3, что приводит к увеличению концентрации бикарбонат-ионов ( показателя SB). Бикарбонат-ионы при взаимодействии с протонами, присутствующими в крови, образуют угольную кислоту, за счет ее разложения увеличится рСО2, а значение рН при связывании протонов может увеличиться до нормы. При проведении этой процедуры важно не ввести в кровь избытка бикарбонат-ионов, которое может спровоцировать состояние дыхательного алкалоза.
Дыхательный (респираторный, газовый) ацидоз. Наступает вследствие снижения обьема альвеолярной вентиляции (массивные пневмонии, бронхиальная астма, обструктивная форма эмфиземы легких, рак легкого, высокая концентрация СО2 во вдыхаемом воздухе). При компенсированной форме дыхательного ацидоза рН не изменяется за счет действия компенсаторных механизмов. Дыхательный ацидоз характеризуется увеличением парциального давления углекислого газа в крови (рСО2 выше 45 мм рт. ст.) (рСО2 является первичным (определяющим) показателем дыхательного ацидоза). При этом величина SB (уровень бикарбонат-ионов – НСО3-) и ВВ (буферноя емкость оснований), ВЕ (недостаток оснований) могут существенно не отличаться от нормы или быть снижены (показатель ВЕ со знаком « - »).
Недостаточность компенсаторных механизмов может приводить к развитию декомпенсированного дыхательного ацидоза, при котором значения рН уменьшаются до значений, более низких, чем в норме.
Компенсация дыхательного ацидоза происходит за счет эффективного действия буферных систем (гидрокарбонатной, гемоглобиновой), а также за счет включения почечного механизма
44
45
выведения протонов Н+ и задержки бикарбоната натрия (NaHСО3), что приводит к увеличению SB, ВВ, знак ВЕ сменяется на «+», рН увеличивается.
Механизм усиления легочной вентиляции и удаление протонов и СО2 практического значения не имеет, поскольку первичная легочная гиповентиляция обусловлена, как правило, тяжелой легочной патологией.
Метаболический алкалоз. Развивается в случаях потери кровью нелетучих кислот, возникает при рвоте, связанной со стенозом привратника, снижении концентрации хлорид-ионов при длительном приеме мочегонных препаратов (фуросемида, гипотиазида и др.), при интенсивном лечении кортикостероидами.
Компенсация при метаболическом алкалозе является неполной. Для частично компенсированного метаболического алкалоза характерно нормальные или несколько повышенные значения рН крови, отмечается избыток оснований (положительная величина ВЕ) (первичный, наиболее важный показатель метаболического алкалоза), увеличение ВВ, SB (концентрации стандартного бикарбоната), высокое парциальное давление СО2 в крови (рСО2).
Алкалоз может быть вызван применением экзогенных (привнесенных в организм) соединений, обладающих высокой основностью, например, наркотиков, алкалоидов (alkali – щелочеподобный). Передозировки наркотиков часто являются причиной летальных исходов по причине развития алкалоза.
Метаболический алкалоз легче предупредить, чем лечить. Компенсация метаболического алкалоза осуществляется за счет снижения объема альвеолярной вентиляции легких (гиповентиляции), которая может вызвать дыхательный ацидоз.
Дыхательный (респираторный, газовый) алкалоз. Развивается в случаях чрезмерного выделения СО2 из крови. Основными причинами дыхательного алкалоза являются: гипервентиляция при гипоксии и анемии, длительном плаче или криках. Дыхательный алкалоз наблюдают при органических или психических поражениях центральной нервной системы (учащенное дыхание на фоне возбуждения), перегревании, одышке, передозировке препаратов производных салициловой кислоты.
Для компенсированного дыхательного алкалоза характерно: нормальное значение рН крови, значительное уменьшение рСО2 (первичный показатель), компенсаторное уменьшение стандартного бикарбоната (SB), ВВ, дефицит оснований (-) ВЕ).
При декомпенсированном дыхательном алкалозе рН крови выше нормы, т.е. выше 7,45, а показатели SB и ВЕ могут иметь близкие к норме значения.
Компенсация дыхательного алкалоза осуществляется почками. Почки задерживают ионы Н+ и усиленно выделяют гидрокарбонат–ионы (НСО3-), что приводит к снижению значений SB, ВВ, уменьшению концентрации и появлению дефицита оснований - (-) ВЕ).
Для оценки КОС используют все указанные показатели. В таблице 1 представлен характер изменения параметров, используемых для диагностики основных нарушений КОС. Из табл. 1 видно, что значение рН не изменяется при компенсированных метаболическом и дыхательном ацидозе, а также дыхательном алкалозе.
Значение рН снижается при декомпенсированном дыхательном и метаболическом ацидозе, повышается при декомпенсированном дыхательном и метаболическом алкалозе.
Парциальное давление рСО2 снижается при компенсированном метаболическом ацидозе, компенсированном и декомпенсированном дыхательном алкалозе.
рСО2 повышается при компенсированном и декомпенсированном дыхательном ацидозе, частично компенсированном метаболическом алкалозе (умеренно).
рСО2 не изменяется при декомпенсированном метаболическом ацидозе, декомпенсированном метаболическом алкалозе.
Концентрация стандартных бикарбонатов (SB) уменьшается при компенсированном и декомпенсированном метаболическом ацидозе, компенсированном дыхательном алкалозе.
Показатель SB повышается при частично компенсированном и декомпенсированном метаболическом алкалозе, при компенсированном дыхательном ацидозе.
45
46
Уровень SB не изменяется при декомпенсированном дыхательном ацидозе, декомпенсированном дыхательном алкалозе.
О метаболической природе нарушений КОС однозначно свидетельствуют изменения показателя ВВ. При метаболическом ацидозе концентрация буферных оснований (ВВ) уменьшается по сравнению с нормой, а при метаболическим алкалозе, напротив, увеличивается.
Величина ВЕ имеет (+) значение лишь при метаболическом алкалозе и указывает на превышение количества оснований по сравнению с нормой. При всех остальных нарушениях ВЕ имеет отрицательные значения.
В периоде компенсации, повышение или понижение рСО2 при нормальных величинах рН и ВЕ характерно для соответствующих респираторных нарушений (дыхательный ацидоз или алкалоз).
Повышение или снижение ВЕ при компенсации и нормальных показателях рСО2 и рН соответствует метаболическим нарушениям кислотно-основного состояния (метаболическому алкалозу и ацидозу).
Приведенные выше данные показывают, что сопоставление параметров КОС с клинической картиной заболевания в большинстве случаев позволяет врачу достаточно надежно диагностировать характер нарушений даже в период их компенсации.
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
Характер изменений параметров кислотно-основного состояния организма |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
Пока- |
|
|
Ацидоз |
Алкалоз |
|
|||||
зате-ли |
Дыхательный |
|
Метаболический |
Дыхательный |
|
Метаболический |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При компенсированном состоянии N = (7,35-7,40) |
|
||||||
Значен |
|
|
|
|
|
|
|
|
|
|
норма |
|
|
норма |
норма |
|
|
(незначительно) |
|
||
ие рН |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
при декомпенсированном состоянии (7,19-6,80) |
|
|||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
рСО2 |
|
при компенсированном состоянии (N=35-45 мм рт. ст.) |
|
|||||||
|
|
|
|
|
|
|
(умеренно) |
|
||
|
|
при декомпенсированном состоянии (N=35-45 мм рт.) |
|
|||||||
|
|
|
|
норма или |
|
|
норма или |
|
||
SB |
|
при компенсированном состоянии (N=20-27 ммоль/л) |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
при декомпенсированном состоянии (N=20-27 ммоль/л) |
|
|||||||
|
норма |
|
|
|
норма |
|
|
|
|
|
ВВ |
|
при компенсированном состоянии (N=44-52 ммоль/л) |
|
|||||||
|
норма |
|
|
|
|
|
|
|
|
|
|
|
при декомпенсированном состоянии (N=44-52 ммоль/л) |
|
|||||||
|
норма |
|
|
|
норма |
|
|
|
|
|
ВЕ |
|
при компенсированном состоянии (N=0,0 2,5ммоль/л |
|
|||||||
|
норма |
|
|
|
норма |
|
|
|
|
|
|
|
при декомпенсированном состоянии (N=0,0 2,5ммоль/л) |
|
|||||||
|
( - ) |
|
|
( - ) |
норма или (-) |
|
( + ) |
|
||
Ситуационные задачи Задача 1. Больная О. страдает эмфиземой легких. При исследовании кислотно–основного состояния выявлено:
рН = 7,35 |
(N=7,40 0>0,05) |
рСО2 = 56 мм рт .ст. (N =35-45 мм рт. ст.) |
|
ВВ=50 ммоль/л |
(N = 44-52 ммоль/л) |
46
|
47 |
SB=29ммоль/л |
(N=20-27 ммоль/л) |
ВЕ=+ 8 ммоль/л |
(N=0,0 2,5ммоль/л) |
Какое нарушение кислотно-основного состояния имеется у больной?
Решение: Значение рН=7,35 соответствует состоянию компенсированного ацидоза. Так как заболевание сопровождается возрастанием (↑) рСО2, то это дыхательный (газовый) ацидоз в стадии компенсации, которая ложится на почки: в результате выведения почками протонов Н+ и задержки бикарбоната натрия (NaHСО3) произошло увеличение показателей ВВ, ВЕ, SB. Таким образом, у больной состояние компенсированного дыхательного ацидоза.
Задача 2. Больной М. доставлен в стационар в тяжелом состоянии. У больного после каждого приема пищи появляется боль в поджелудочной области, сопровождающаяся рвотой. При исследовании кислотно-основного состояния выявлено:
рН=7,55 |
(N=7,40 0>0,05) |
рСО2 =60 мм рт .ст. |
(N =35-45 мм рт. ст.) |
ВВ=54 ммоль/л |
(N = 44-52 ммоль/л) |
ВЕ=+18ммоль/л |
(N=0,0 2,5ммоль/л) |
SB=29 ммоль/л |
(N=20-27 ммоль/л) |
Какое нарушение кислотно-основного состояния имеется у больного?
Решение. Из анализа показателей КОС видно, что рН=7,55 превышает значения нормы, что свидетельствует о декомпенсированном состоянии алкалоза. Существенное увеличение значений показателей ВВ, SB и ВЕ и рСО2 свидетельствуют о метаболическом алкалозе. Таким образом, состояние больного М. характеризуется как метаболический алкалоз в декомпенсированной форме.
Задача 3. Больная Т. поступила в стационар с признаками сердечной недостаточности. При исследовании кислотноосновного состояния выявлено:
рН=7,35 |
(N=7,40 0>0,05) |
рСО2 =30 мм рт. ст. |
(N =35-45 мм рт. ст.) |
ВЕ= - 11,0 ммоль/л |
(N=-2,5 -+ 2,5ммоль/л) |
SB=15 ммоль/л |
(N=20-27 ммоль/л) |
ВВ= 40 ммоль/л |
(N = 44-52 ммоль/л) |
Какое нарушение кислотно-основного состояния имеется у больной ?
Решение. По значению рН крови у больной выявлен ацидоз, при этом нарушение КОС компенсировано. Парциальное давление рСО2 снижено, что, указывает на метаболический характер нарушений. Показатели SB и ВВ снижены, а ВЕ имеет отрицательное значение, по абсолютной величине существенно отличающееся от нормы. Совокупность показателей КОС свидетельствует о метаболическом ацидозе в стадии компенсации. Следовательно, нарушения КОС у больной Т. соответствуют компенсированной форме метаболического ацидоза.
Задача 4. В стационар поступил больной А. с сепсисом. Показатели КОС имеют значения:
рН=7,28 |
(N=7,40 0>0,05) |
рСО2=22 мм рт .ст. |
(N =35-45 мм рт. ст.) |
SB=11 ммоль/л |
(N=20-27 ммоль/л) |
ВЕ=-1ммоль/л |
(N=0,0 2,5ммоль/л) |
ВВ=40 ммоль/л |
(N = 44-52 ммоль/л) |
Какая форма нарушений кислотно-основного состояния выявлена у больного?
Решение. Видно, что значения рН крови по сравнению с нормой существенно снижены, что свидетельствует о декомпенсированном ацидозе. По сравнению с нормой снижено значение рСО2, что указывает на метаболический характер нарушений КОС. При этом снижены значения таких показателей как SB, ВВ, (-) ВЕ, характеризующих концентрацию и емкость буферных оснований крови. Таким образом, можно констатировать, что у больного А. наиболее тяжелая форма метаболического декомпенсированного ацидоза.
Занятие 1.1.5 ТЕМА: Химическая кинетика и катализ
47
48
ЦЕЛЬ: Изучить основные законы кинетики, усвоить представления о фармакокинетике. Экспериментально оценить влияние концентрации и температуры на скорость химической реакции.
ЗНАТЬ:
1.Понятие о скорости химической реакции, средняя скорость реакции в интервале, истинная скорость.
2.Классификации реакций, применяющихся в кинетике: реакции гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряжённые, цепные).
3.Молекулярность и порядок реакции. Закон действующих масс. Влияние различных факторов на скорость химической реакции. Зависимость скорости реакции от концентрации. Фармакокинетика.
4.Кинетические уравнения реакций нулевого, первого, второго порядков. Размерность константы скорости. Период полупревращений. Экспериментальные методы определения скорости и константы скорости реакции.
5.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации. Понятие о теории активных соударений и о теории переходного состояния.
6.Катализ. Катализаторы. Механизм их действия. Основы гомогенного и гетерогенного катализа. Энергетический профиль каталитической реакции.
7.Особенности каталитической активности ферментов. Уравнение Михаэлиса-Ментен и его анализ.
УМЕТЬ:
1.Самостоятельно пользоваться учебной и справочной литературой.
2.Пользоваться химической посудой и оборудованием (мерные пробирки, водяные бани, термометры, секундомер и т.д.).
3.Определять скорость химической реакции по изменению концентрации и температуры реагирующих веществ.
4.Строить зависимости скорости реакций от концентрации реагента и температуры.
5.Определять молекулярность и порядок реакций.
ВЛАДЕТЬ:
1.Навыками самостоятельной работы с учебной и справочной литературой.
2.Навыками безопасной работы в химической лаборатории.
3.Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №4 «Изучение зависимости скорости реакции от концентрации и температуры».
Основные уравнения по теме: «Химическая кинетика и катализ»
1. V |
C2 |
C1 |
|
|
C |
- уравнение для расчета средней скорости реакции |
||||||||||||||||||||||
t2 t1 |
t |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
2. |
V |
|
dC |
|
|
- |
|
|
|
|
расчет истинной скорости |
|||||||||||||||||
|
dt |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3. V = K×[A]a×[B]b |
- закон действующих масс |
|||||||||||||||||||||||||||
4. |
kI |
|
|
2,3 |
|
lg |
C0 |
|
- |
|
кинетическое уравнение для реакции первого порядка |
|||||||||||||||||
|
|
t |
C |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
5. |
|
|
|
|
2,3 |
lg |
|
C0 |
|
0,693 |
период полураспада для реакции первого порядка |
|||||||||||||||||
12 |
|
|
|
C0 |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
k I |
|
|
|
|
|
|
|
kI |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||
6. |
k |
|
|
1 |
|
|
C0 C |
|
|
|
- кинетическое уравнение для реакций второго порядка |
|||||||||||||||||
2 |
t |
C0 C |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
48
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
49 |
|||
7. 1 |
|
|
|
|
|
1 |
|
|
|
- период полураспада для реакций второго порядка |
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
2 |
k2 |
C0 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
t2 t1 |
|
|
|
|
|
|||
8. |
V |
|
V |
|
10 |
|
|
- |
уравнение Вант-Гоффа |
||||||||||||
t |
2 |
|
|
|
|
|
t1 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
9. lg |
k2 |
|
Ea (T2 |
T1 ) |
- |
уравнение Аррениуса |
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
k1 |
|
2,3RT1T2 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Еaкт |
|
|
|
|
|
|
|||||
10. k A e RT |
- |
|
уравнение Аррениуса |
||||||||||||||||||
11. Еакт |
|
2,3R(T1 T2 ) |
lg |
KT 2 |
- расчет энергии активации |
||||||||||||||||
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
T2 T1 |
|
|
KT1 |
||||||||
12. V |
Vmax [S ] |
|
- |
уравнение Михаэлиса - Ментен |
|||||||||||||||||
km [S ] |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Обучающие задачи
Задача 1. Гомогенная реакция 2NO + Cl2 = 2NOCl протекает по простому механизму. Как изменится скорость прямой реакции, когда концентрация оксида азота (II) увеличится в 2 раза?
Решение:
V = K [NO]2 [Cl2] обозначим [NO] = a, [Cl2] = b.
V1 = Ka2b, при увеличении концентрации [NO] = 2a, [Cl2] = b. V2 = K[2a]2 [b] = 4Ka2b
V2 |
|
4Ka 2 b |
4 |
|
V |
Ka 2 b |
|||
|
|
|||
1 |
|
|
|
Ответ: увеличится в 4 раза.
Задача 2. Константа скорости мономолекулярной реакции равна 8∙10-3 мин -1. Вычислите время, за которое начальная концентрация уменьшится на 1/4.
Решение:
k I |
|
2,3 |
lg |
C |
t |
2,3 |
lg |
C |
|
C х |
|
||||||
|
|
|
||||||
|
|
t |
|
k I |
C |
|||
Примем начальную концентрацию за 1, тогда Х=1/4=0,25, С-Х=1-0,25=0,75
t |
|
2,3 |
lg |
1 |
|
|
2,3 0,124 |
|
0,2852 |
35,65мин |
||
|
|
|
|
|
|
|
|
|||||
|
10 3 |
0,75 |
8 10 3 |
0,008 |
|
|||||||
8 |
|
|
|
|
|
|||||||
Ответ: 35,65 мин.
Задача 3. Денатурация некоторого вируса является процессом первого порядка с энергией активации 630 кДж/моль. Период полураспада при температуре 300С (303 К) равен 5ч. Определите константу скорости реакции при этой температуре. Вычислите период полураспада при 400(313
К).
Решение:
kI |
|
2,3 |
lg |
C0 |
t |
2,3 lg 2 |
|
t |
C |
k |
|||||
|
|
|
|
k |
2,3 lg 2 |
|
2,3 lg 2 |
0,138ч 1 |
|
t |
5 |
||||
|
|
|
lg |
k2 |
|
Ea (T2 T1 ) |
|
|
630 10 |
|
3,47 |
|||||
k |
2,3RT T |
2,3 8,31 10 3 303 313 |
|||||||||||
|
|
|
|
|
|
||||||||
1 |
|
|
1 |
2 |
|
|
|
|
|
|
|||
lg |
k2 |
|
3,47 |
|
|
|
k2 |
103,47 2951 |
|
||||
k1 |
|
|
|
k1 |
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
49

|
|
|
50 |
|
|
|
K2 = 2951× 0,138 = 407,2 ч-1 ; |
t2 |
|
2,3 lg 2 |
0,00179час |
или 6,12 сек |
|
407,2 |
||||||
|
|
|
|
|
Ответ: К2 = 407,2 ч-1 2 = 6,12 сек
Задача 4. Количество свинца 206Рb, содержащегося в образце урановой руды из Восточной Сибири, эквивалентно (в молях) 41,6% урану ( 238U). Принимая во внимание, что весь свинец происходит из урана (период полураспада урана равен 4,5х109 лет), вычислите примерный возраст образца урановой руды.
Решение: |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
2,3 |
lg |
|
C0 |
|
0,693 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
12 |
|
|
kI |
|
|
|
|
C0 |
|
kI |
|
|||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
k |
|
|
0,693 |
|
|
|
0,693 |
|
0,154 10 9 лет 1 |
||||||||
|
|
|
|
|
|
||||||||||||
1 |
|
|
1 |
|
|
|
|
4,5 |
109 лет |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Возраст образца |
|
|
|
|
|||||||||||||
t |
2,3 |
lg |
C0 |
|
2,3 |
lg |
|
1,0 |
|
3,5миллиарда лет |
|
C x |
0,154 10 9 |
|
0,416 |
||||||
|
k |
|
1,0 |
|
||||||
|
1 |
|
|
|
|
|
|
|
|
|
Ответ: 3,5 миллиарда лет
Задачи для самостоятелього решения Задача 1. Как изменится скорость прямой реакции 2СО(г) + О2(г) ↔ 2 СО2(г) при увеличении концентрации СО в 3 раза.
Ответ: увеличится в 9 раз Задача 2.Константа скорости гидролиза атропин-основания при 400С равна 0,316с-1.Массовая доля
атропин-основания в растворе была 2,5%. Спустя какое время значение массовой доли останется равным 0,1%?
Ответ: 10,175 с
Задача 3. Из 1 кг сахарозы при превращении её в глюкозу и фруктозу в присутствии воды и фермента, сахарозы за 5 часов осталось 0,6 кг. Какое количество сахарозы останется через 2ч. 20 мин. Определите время полураспада.
Ответ: 79%, 6,8 часа.
Задача 4. При авариях на АЭС появляется радиоактивный изотоп йода 131I. За какое время этот изотоп распадётся на 99%? Период полупревращения 131I равен 8,054 сут.
Ответ: через 53,5 сут.
Задача 5. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий-192. Какая часть введённого радионуклида останется в опухоли через 90 суток, если его распад подчиняется кинетическому уравнению 1-го порядка? Период полураспада иридия-192 составляет 74,08 суток.
Ответ: 43%
Задача 6. Во сколько раз уменьшится скорость окисления глюкозы при гипотермии, если температура тела падает с 36,60С до 270С, температурный коэффициент данной реакции равен 1,3.
Ответ: в 1,29 раза
Задача 7. При повышении температуры от 250С до 450С скорость реакции возросла в 7 раз. Определить температурный коэффициент реакции.
Ответ: γ=2,65
Задача 8. Денатурация вируса – реакция первого порядка с энергией активации 630 кДж/моль. Период полупревращения при 300С равен 5 ч. Рассчитайте период полупревращения при 370С.
Ответ: 63 с
Задача 9. В 1952 г в организм человека попал радионуклид стронций-90. В каком году его останется 40%. Период полураспада 90Sr=28,7 года.
Ответ: в 1990 г
50
51
Тестовые вопросы
1. При 0 С гранула железа растворяется в соляной кислоте за 20 мин. Если температурный коэффициент реакции равным 2, то такой же по массе кусочек железа растворится при 20 С
за _____ минут.
1) 5 2) 12 3) 60 4) 10
2. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 200С до 500С скорость реакции____.
1) |
увеличивается в 8 раз |
3) уменьшается в |
2 раза |
2) |
увеличивается в 6раз |
4)уменьшается в 4 |
раза |
3. Температурный коэффициент реакции равен 3. Во сколько раз увеличивается скорость реакции при повышении температуры на 200С?
1) в 1,5 раза |
|
2) в 3 раза |
3) в 6 раз |
|
|
4) в 9 раз |
|
|
|
|
|||||||||||||||||
4. Кинетическое уравнение для реакций I-го порядка имеет вид: |
|
|
|
|
|||||||||||||||||||||||
1) |
k |
|
|
2,3 |
lg |
C0 |
|
|
|
3) |
k |
|
k |
|
|
|
|
|
|
|
|
|
|||||
I |
|
t |
C |
I |
II |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
2,3 |
|
|
C0 |
|
|
|
|
|
|
kI |
|
8,31 t |
|
|
|
|
|
||||||
2) |
kI |
ln |
|
|
|
4) |
ln |
C0 |
|
|
|
|
|
|
|||||||||||||
t |
C |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
C |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
5. Кинетическое уравнение для реакций II-го порядка имеет вид: |
|
|
|
||||||||||||||||||||||||
1) |
kII |
(2,3 t) lg |
C0 |
|
|
|
|
|
3) kII |
kI |
|
|
|
||||||||||||||
C |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
kII |
|
1t |
C С |
|
|
|
|
|
4) k II |
|
8,31 t |
|||||||||||||||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2) |
|
|
|
|
|
|
|
|
|
C0 |
|
||||||||||||||||
|
C С |
|
|
|
|
|
|
ln |
|||||||||||||||||||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
6. Согласно закону Вант-Гоффа при повышении температуры на 10ºС скорость химической
реакции возрастет в______. |
|
|
|
1) 5-6 раз |
2) 2-4 раза |
3) 10 раз |
4) 1,75 раза |
7.Энергия активации – это ____.
1)кинетическая энергия
2)потенциальная энергия
3)энергия, образующаяся при столкновении молекул
4)избыточная энергия, которую необходимо передать 1 моль вещества, чтобы перевести все молекулы в активное состояние
8.Как изменится скорость химической реакции при увеличении температуры на 20ºС? При температурном коэффициенте равном 4________.
1)возрастет в 16 раз 3) сначала увеличится в 3 раза, затем уменьшится в 1,5 раза
51
52
2) уменьшится в 2 раза |
4) не изменится |
9. Катализаторы, ускоряющие скорость химической реакции, это____.
1) |
ингибиторы |
3) |
антиоксиданты |
2) |
инициаторы |
4) |
окислители |
10.Принято выделять следующие виды катализа______.
1)гомогенный 3) мономолекулярный
2) гетерогенный |
4) нулевой |
11. В организме роль катализаторов выполняют_____.
1) |
жирные кислоты |
3) |
ферменты |
2) |
витамины |
4) |
ДНК и РНК |
12. При увеличении температуры на 50ºС скорость химической реакции возрастет в 32 раза.
Чему равен температурный коэффициент реакции?
1) ¾ |
2) 8×10-2 |
3) 2 |
4) 5,08 |
13. Реакция разложения Н2О2 в водном растворе протекает как реакция I-го порядка. Период полураспада составляет 15,86 мин. Какое время потребуется для разложения 99% взятого количества Н2О2 – ?
1) 11 часов |
2) 1 сутки |
3) 50 мин 34 сек |
4) 106,96 мин |
14. При 60ºС вещество «Х» подвергается термическому разложению по уравнению I-го порядка с константой скорости 0,05 мин-1. Сколько времени нужно нагревать раствор при
60ºС, чтобы исходная концентрация вещества равная 0,1 моль/л уменьшилась до 0,01
моль/л?
1) 34 сек 2) 1 час 58 мин |
3) 46 мин |
4) 2 сут |
15.Порядок и молекулярность для простых реакций_____,
1)совпадают;
2)молекулярность в 2 раза больше порядка реакции;
3)порядок реакции в 1,5 раза больше молекулярности;
4)это зависит от условий процесса
16.Вещество, изменяющее скорость химической реакции и остающееся после этого в неизменном состоянии и количестве называется _____.
1) |
промежуточным продуктом реакции |
3) |
катализатором |
2) |
восстановителем |
4) |
продуктом реакции |
17. К особенностям ферментативного катализа относят:______.
1) |
высокую избирательность; |
3) |
оптимальные значения рН и T; |
2) |
высокую каталитическую активность; |
4) |
верны все варианты |
52
