
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
H─Cl (степень окисления хлора равна –1, валентность – I),
O═C═O (степень окисления углерода равна +4, валентность – 4).
В то же время в пероксиде водорода Н─О─О─Н степень окисления кислорода равна –1, а его валентность – 2; в молекуле азота N≡N степень окисления его атомов равна 0, а валентность – 3.
Зная электронное строение атома элемента, можно охарактеризовать его валентные возможности. Как правило, они определяются числом электронных орбиталей, которые этот атом использует для образования химических связей. Так, атом водорода всегда проявляет валентность, равную единице (у него всего одна орбиталь). В то же время большинство элементов второго периода могут проявлять переменную валентность. В любом случае, у этих элементов максимальная валентность не может быть больше четырех, так как на внешних электронных слоях их атомов имеется всего по 4 орбитали.
У атомов элементов третьего периода в связи с появлением d-под-уровня валентные возможности увеличиваются, так как в результате распаривания 3р- и 3s-электронных пар число неспаренных электронов может изменяться от четырех до семи.
4. Геометрия молекулярных частиц с ковалентным типом связей. Понятие о стериохимии. Факторы, определяющие пространственное строение молекул. Концепция гибридизации атомных орбиталей. Связывающие и несвязывающие электронные пары. Модель отталкивания валентных электронных пар. Пространственное строение молекул типа АХ2, АХ3, АХ4, АХ6. Делокализация π-связей и многоцентровые связи.
1. с. 60–66; 2. с. 127–135; 4. с. 75–81; 6. с.80–89; 8. с. 126–132. 11. с. 114–118;
Раздел химии, изучающий пространственное строение молекул, называетсястереохимией.
В общем случае геометрическая форма молекулярной частицы определяется валентными углами. Поскольку -связи располагаются в тех же областях межъядерного пространства, что и -связи, и влияют только на длину и прочность связи между атомами, геометрическая форма молекул определяется, в основном, пространственной направленностью -связей.
Устойчивому состоянию молекулы соответствует ее геометрическая форма с минимально возможным значением потенциальной энергии. С одной стороны, чем более полно перекрываются электронные облака атомов, тем больше энергии выделяется при образовании связей между ними. С другой стороны, чем больше удалены друг от друга внешние электронные облака атомов, тем слабее их взаимное отталкивание и тем меньше потенциальная энергия молекулы. Поэтому пространственная форма молекулы, отвечающая минимуму ее потенциальной энергии, является результатом совместного влияния тенденции к образованию возможно более прочных связей и тенденции к максимальной удаленности друг от друга электронных пар внешнего электронного слоя атома. В соответствии с этим, для объяснения пространственной структуры молекул в рамках метода валентных связей используют два подхода.
Первый основан на предположении, что геометрия молекулы определяется условием максимального притяжения атомных ядер к области повышенной электронной плотности, поэтому направленность химической связи должна соответствовать максимальному перекрыванию взаимодействующих электронных облаков. Построенная на основе этих представлений концепция называется методом гибридизации атомных орбиталей.
Другой подход основан на предположении, что устойчивому состоянию молекулы отвечает такое пространственное расположение электронных облаков валентного слоя каждого атома, при котором их взаимное отталкивание минимально. Этот подход получил название метода отталкивания электронных пар валентной оболочки (ОЭПВО).
Согласно концепции гибридизации атомных орбиталей, в образовании ковалентных связей участвуют не «чистые», а так называемые гибридные, усредненные по форме и размерам (а следовательно, и по энергии) орбитали. Число таких орбиталей равно числу исходных «негибридных» орбиталей. Гибридные орбитали более вытянуты в пространстве, что обеспечивает их более полное перекрывание с орбиталями соседних атомов.
Пространственная ориентация гибридных орбиталей центрального атома определяет геометрическую форму молекулы. Так, при комбинации одной s- и одной p-орбиталей возникают две sp-гибридные орбитали, расположенные симметрично под углом 180о. Соответственно, связи, образуемые этими орбиталями, также располагаются под углом 180о. Например, sp-гибридизация орбиталей атома бериллия проявляется в молекуле BeCl2, которая вследствие этого имеет линейную форму:
Cl─Bе─Cl.
Комбинация трех орбиталей (одной s- и двух p-типа) приводит к образованию трех sp2-гибридных орбиталей, расположенных в одной плоскости под углом 120о (например, в молекуле BF3).
Комбинация четырех орбиталей (одной s- и трех p-типа) приводит к sp3-гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырем вершинам тетраэдра, т.е. под углом 109о 28´ (атом углерода в молекуле CH4).
Комбинация шести орбиталей (одной s-, трех р- и двух d-орбиталей) приводит к образованию шести sp3d2-гибридных орбиталей, ориентированных в пространстве под углом 90о друг к другу (атом серы в молекуле SF6).
Основные характеристики указанных типов гибридизации приведены в таблице:
|
Исходные орбитали |
Число гибридных орбиталей |
Тип гибриди-зации |
Валентный угол |
Пространственная конфигурация |
|
s+p |
2 |
sp |
180o |
линейная |
|
s+2p |
3 |
sp2 |
120o |
треугольная |
|
s+3p |
4 |
sp3 |
109о28´ |
тетраэдрическая |
|
s+3p+2d |
6 |
sp3d2 |
90o |
октаэдрическая |
В реальных молекулярных частицах валентные углы часто отличаются от углов, соответствующих определенным типам гибридизации. Основными причинами таких отклонений являются следующие:
1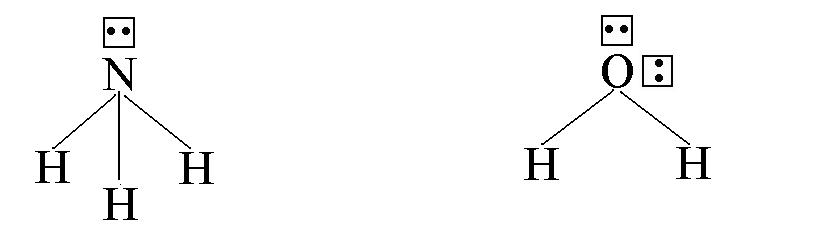 .
Не все гибридные орбитали участвуют в
образовании связей, часть из них являютсянесвязывающими.
Электронные пары, находящиеся на этих
орбиталях, также называются несвязывающими
(или
неподеленными).
Например, у атома азота в молекуле NH3
одна пара электронов – несвязывающая,
а в молекуле H2O
у атома кислорода – две пары электронов
являются несвязывающими:
.
Не все гибридные орбитали участвуют в
образовании связей, часть из них являютсянесвязывающими.
Электронные пары, находящиеся на этих
орбиталях, также называются несвязывающими
(или
неподеленными).
Например, у атома азота в молекуле NH3
одна пара электронов – несвязывающая,
а в молекуле H2O
у атома кислорода – две пары электронов
являются несвязывающими:
Связывающая электронная пара локализована между двумя атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Вследствие этого отталкивающее действие несвязывающей пары (НП) проявляется в большей мере, чем связывающей пары (СП). По степени взаимного отталкивания электронные пары располагаются согласно следующему ряду: (НП↔НП) > (НП↔СП) > (СП↔СП).
2. На геометрию молекулы также оказывает влияние электроотрицательность лигандов – атомов, связанных с центральным атомом. Чем более электроотрицателен лиганд, тем сильнее он сжимает электронное облако связывающей пары и притягивает его к себе. Следовательно, тем в меньшей степени проявляется эффект отталкивания между связывающими парами и происходит уменьшение валентных углов.
3. Электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи (двойной или тройной) занимает больший объем пространства, чем одинарной, и поэтому обладает большим отталкивающим действием. Например, в молекуле COF2, имеющей плоскостное строение (sp2-гибридизация орбиталей атома углерода), угол связи
F─C─O больше угла связи F─C─F.
Нужно отметить, что различие между -связью и сочетающимися с ней одной или двумя -связями проявляется только в прочности связи, но не в направлении ее образования. Пространственное расположение атомов друг относительно друга определяется только валентными углами между -связями.
Гибридные орбитали вследствие особенностей их геометрической формы не могут принимать участие в образовании π-связей. Следовательно, π-связи всегда образованы только негибридными орбиталями.
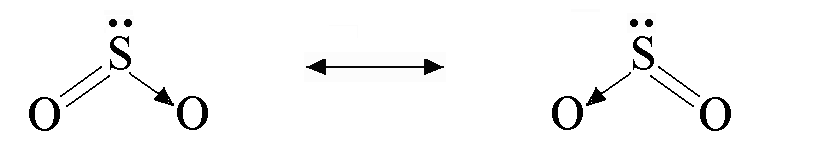 Строение
многих молекул нельзя изобразить только
одной валентной схемой с точной
локализацией кратной связи, поскольку
истинное их строение оказывается
промежуточным между несколькими его
вариантами, каждый из которых отражается
отдельной схемой. Например, строение
молекулы SO2можно изобразить двумя
равнозначными (их часто называют
резонансными) валентными схемами:
Строение
многих молекул нельзя изобразить только
одной валентной схемой с точной
локализацией кратной связи, поскольку
истинное их строение оказывается
промежуточным между несколькими его
вариантами, каждый из которых отражается
отдельной схемой. Например, строение
молекулы SO2можно изобразить двумя
равнозначными (их часто называют
резонансными) валентными схемами:
П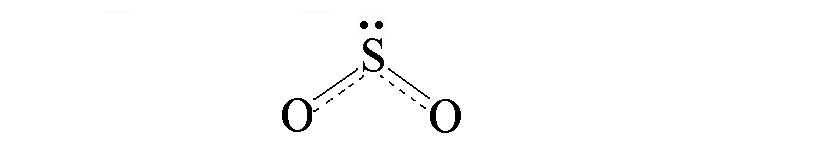 оскольку
в этой молекуле оба атома кислорода
равноценны (и, следовательно, равноценны
обе связи S—O), свойства молекулы лучше
передает графическая формула с
делокализованной π-связью:
оскольку
в этой молекуле оба атома кислорода
равноценны (и, следовательно, равноценны
обе связи S—O), свойства молекулы лучше
передает графическая формула с
делокализованной π-связью:
где пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями S—O. Другими словами, эта электронная пара принадлежит не двум, а трем атомам и, следовательно, образованная ею связь является трехцентровой.
Примеры частиц с многоцентровыми (делокализованными) π-связями: HNO3, C6H6, CO32–.
5. Основы метода молекулярных орбиталей (МО). Основные положения. Схема расположения орбиталей по энергии. Связывающие и разрыхляющие молекулярные орбитали в двухатомных молекулах элементов 1 и 2 периодов. Энергетическая диаграмма. Порядок заселения МО электронами. Порядок (кратность) связи.
1. с. 66–70; 2. с. 135–143; 4. с. 52–70; 6. с. 60–63, с. 66–73; 8. с. 133–138. 11. с. 118–126.
С позиций метода молекулярных орбиталей (ММО) молекула рассматривается как единое целое, где каждый электрон принадлежит всей молекуле в целом и движется в поле всех ее ядер и электронов, т. е. находится в орбитали, охватывающей всю молекулу. Такая орбиталь называется молекулярной орбиталью (МО).
Совокупность всех МО молекулы рассматривается как ее электронная конфигурация. Описать молекулу согласно ММО – значит определить тип ее орбиталей, их энергию и выяснить характер распределения электронов по орбиталям в порядке возрастания их энергии.
