
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
VIII. Комплексные соединения
1. Основные положения координационной теории.Валентная и координационная насыщенность и возможность образования комплексных соединений. Строение комплексного соединения: внутренняя и внешняя сферы, комплексный ион, комплексообразователь, лиганды. Координационное число и степень окисления комплексообразователя. Заряд комплексного иона. Катионные, анионные и нейтральные комплексы. Хелатные и внутрикомплексные соединения. Комплексы с макроциклическими лигандами. Многоядерные комплексы.
1. с. 160–162; 4. с. 97–99; 5. с. 107–108; 6. с. 483–491; 8. с. 169–172; 11. с. 367–370.
Комплексными (координационными) называются соединения, в узлах кристаллических решеток которых находятся комплексные частицы, способные к самостоятельному существованию в растворах.Эти частицы образованы за счет координации электронодефицитным атомом или катионом (акцептором электронов) электронейтральных частиц или анионов (доноров электронов).
Согласно координационной теории А. Вернера, в состав любого комплексного соединения (КС) входит сложная частица, состоящая из центрального атома (комплексообразователя), вокруг которого располагаются (координируются) нейтральные молекулы или анионы, называющиеся лигандами. Число координированных лигандов чаще всего равно 6, 4 или 2. Координация («удерживание») лигандов около центрального атома осуществляется за счет образования химических связей. Число связей, которые образует один лиганд с комплексообразователем, называется дентатностью лиганда. В соответствии с этим различают моно-, ди-, три-, тетра-, пента- и гексадентатные лиганды. Общее число химических связей, которое комплексообразователь образует с лигандами, называется координационным числом комплексообразователя.
Комплексообразователь (чаще всего – катион металла), связанный с лигандами, образуют внутреннюю сферу комплекса. В формулах координационных соединений ее заключают в квадратные скобки. Все, что находится за квадратными скобками, составляет внешнюю сферу комплекса.
В зависимости от знака заряда внутренней сферы различают:
Анионные КС, например K[Zn(H2O)(CN)3], где внутренняя сфера [Zn(H2O)(CN)3]– – анион;
Катионные КС, например, [Cu(NH3)4]SO4, в которых внутренняя сфера [Cu(NH3)4]2+ – катион;
Катионно-анионные КС, например, [Cu(NH3)4][Zn(CN)4], состоящие из двух внутренних сфер, одна из которых – катион, а другая – анион;
Нейтральные КС, не имеющие внешней сферы, например, [Pt(NH3)2Cl2]0.
Заряд внутренней сферы комплекса всегда равен алгебраической сумме зарядов центрального иона и лигандов.
Особую группу составляют хелатные (клешневидные) комплексные соединения, в которых атомы комплексообразователей и атомы лигандов образуют циклические группировки, состоящие чаще всего из 5 или 6 атомов. К таким соединениям относятся, например, внутрикомплексные соединения.
Внутрикомплексные соединения – хелатные соединения, в которых каждый лиганд связан с комплексообразователем двумя ковалентными связями, одна из которых образована по обменному, а другая – по донорно-акцепторному механизму. Такие соединения широко распространены в живой природе. Важнейшими из них являются, например, гем крови и хлорофилл.
2. Принципы современной номенклатуры комплексных соединений. Характер химической связи в комплексных соединениях. Донорно-акцепторное взаимодействие. Факторы, определяющие комплексообразующую способность атомов по их положению в таблице периодической системы. Понятие об основных положениях теории координационной связи.
1. с. 162–167; 4. с. 97; 5. с. 109–110; 7. с. 279–281; 8. с.172–175; 11. с. 370–375.
Названия комплексообразователей
В случае катионных КС используют русское название комплексообразователя в родительном падеже, например, Сu2+ – меди(II), Fe3+ – железа(III).
В случае анионных КС используют корень латинского названия комплексообразователя и суффикс «ат», например, Сu2+ – купрат(II), Fe3+ – феррат(III).
В случае нейтральных КС используют русское название комплексообразователя в именительном падеже, например, Сu2+ – медь(II), Fe3+ – железо(III).
Названия лигандов
Названия нейтральных лигандов: Н2О – «аква», NH3 – «аммин», СО – «карбонил», NO – «нитрозил».
Названия лигандов-анионов.
Если латинское название аниона заканчивается суффиксом «ид», его заменяют на букву «о»: F– – фторо, СN– –циано, S2– – тио, OH– – гидроксо и т. д. Исключение: Н– – гидридо.
Если
латинское название аниона заканчивается
на «ат» или «ит», то к нему добавляется
буква «о»:
![]() – сульфато,
– сульфато,
![]() –
сульфито,
–
сульфито,
![]() – нитрато
и т. д.
Исключение:
– нитрато
и т. д.
Исключение:
![]() – нитро (без
суффикса «ит»).
– нитро (без
суффикса «ит»).
Для обозначения числа одинаковых лигандов во внутренней сфере комплекса в качестве приставок перед их названиями используют греческие числительные: ди; три; тетра; пента; гекса и т. д. Приставку моно не употребляют. Название внутренней сферы записывают в одно слово.
Названия КС
Порядок названия комплексных соединений аналогичен порядку названий обычных солей, т. е. сначала указывается анион в именительном падеже, а затем катион в родительном падеже. Формулы комплексов читаются строго справа налево, соблюдая указанный в них порядок расположения лигандов. Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II);
K[Zn(H2O)(CN)3] – трицианоаквацинкат калия;
[Cu(NH3)4][Zn(H2O)(CN)3] – трицианоаквацинкат тетраамминмеди(II);
[Pt(NH3)2Cl2] – дихлородиамминплатина(II).
Для объяснения строения комплексных соединений используют различные теоретические подходы – метод валентных связей, метод молекулярных орбиталей, теорию кристаллического поля и теорию поля лигандов.
3. Устойчивость комплексных ионов.Диссоциация комплексных ионов. Константа нестойкости комплексов. Понятие о двойных солях. Сравнительная характеристика смешанных и двойных солей с комплексными соединениями. Использование комплексообразования для растворения трудно растворимых электролитов.
1. с. 170–171; 2. с. 581–584; 4. с. 179–181; 5. с. 110–112; 8. с. 177–182; 11. с. 387–391.
При растворении кристаллического КС в воде его кристаллическая решетка разрушается, а координационная сфера и внешнесферные ионы гидратируются дипольными молекулами воды. Этот процесс протекает по механизму диссоциации сильных электролитов, например:
Na3[Co(NO2)6] → 3Na++ [Co(NO2)6]3–.
Распад комплексного соединения на внутреннюю и внешнюю сферы называется первичной диссоциацией КС.
Образующиеся при первичной диссоциации комплексные ионы далее подвергаются диссоциации, но уже по типу слабых электролитов. Они диссоциируют обратимо и постадийно, постепенно отщепляя частицы лигандов, например:
1-я стадия: [Co(NO2)6]3– ↔ [Co(NO2)5]2– + NO2–;
2-я стадия: [Co(NO2)5]2– ↔ [Co(NO2)4]– + NO2– и т. д.
Каждой из этих стадий соответствует своя константа равновесия, называемая константой диссоциации комплексного иона по данной стадии. Однако, поскольку эти постадийные константы диссоциации отличаются между собой незначительно, принято приводить суммарное уравнение вторичной диссоциации:
[Co(NO2)6]3– ↔ Со3+ + 6NO2–.
Константу равновесия такого процесса называют общей константой нестойкости Kнест комплексного иона:
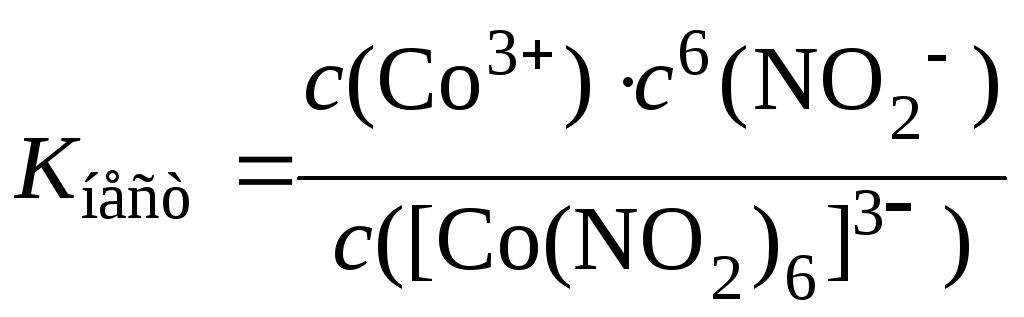 .
.
Величина, обратная константе нестойкости комплексного иона, называтся константой его устойчивости Kуст.:
![]() .
.
Чем меньше Kнест, тем больше Kуст комплексного иона, тем он устойчивее в растворе и наоборот.
4. Роль комплексообразования в биологических процессах.Медико-биологическая роль комплексных соединений. Металлоферменты, металлолигандный баланс и его нарушения. Химические основы применения в медицине и фармации.
1. с. 162–163; 2. с. 568–570; 5. с. 113; 8. с. 188–189.
Комплексных соединений значительно больше, чем всех других неорганических веществ. Многие из них распространены в природе и играют исключительную роль в процессах фотосинтеза, дыхания, биологического окисления.
Ионы Mg2+ как комплексообразователи входят в состав хлорофилла, который способствует фотосинтезу:
6СО2
+ 6Н2О
![]() С6Н12О6
+ 6О2.
С6Н12О6
+ 6О2.
Ионы Fe2+ в виде хелатных комплексов входят в состав гемоглобина, который обратимо связывает вдыхаемый кислород и переносит его к тканям организма.
В состав биологических катализаторов – ферментов входят комплексообразователи: Co3+, Mo3+, Cu2+, Zn2+ и Mg2+. Присутствие, например, кобальта в виде комплексных соединений в организме резко повышает интенсивность основного обмена веществ и активизирует синтез мышечных белков.
