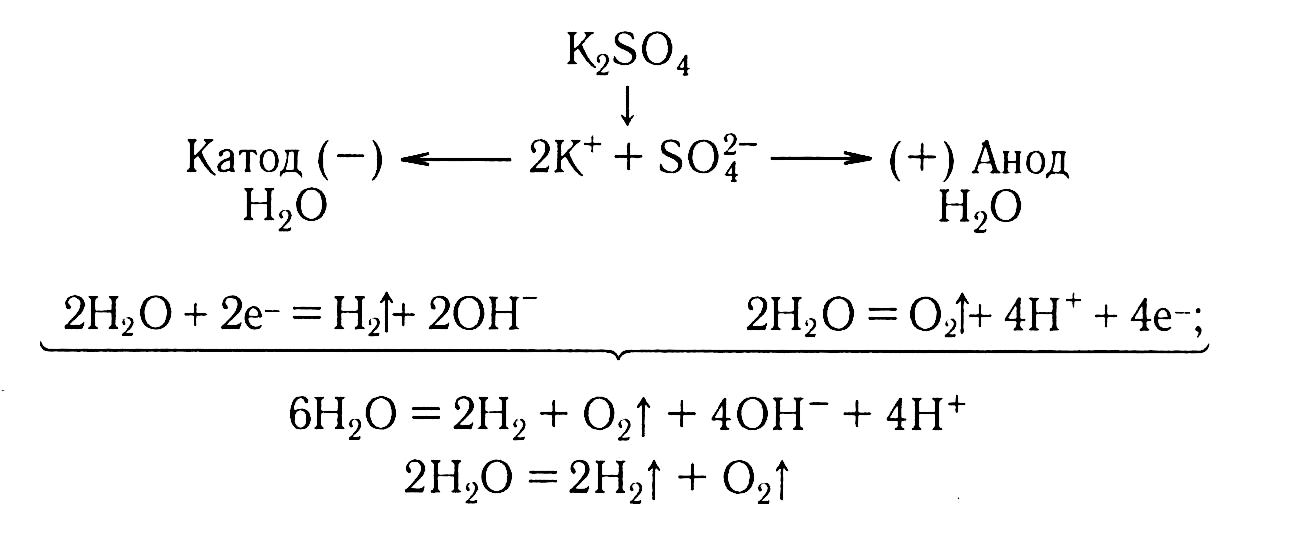- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
1. Оценить окислительно-восстановительные свойства веществ.
Из нескольких веществ более сильными восстановительными свойствами обладает то вещество, которому соответствует полуреакция с более низким значением потенциала. И наоборот: более сильными окислительными свойствами обладает то вещество, которому соответствует полуреакция с более высоким значением потенциала.
2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал полуреакции с участием используемого окислителя будет больше потенциала полуреакции с участием используемого восстановителя.
3. Определить направление протекания реакции.
Любая ОВР всегда протекает в том направлении, в котором осуществляется полуреакциия с более высоким значением потенциала. Этому направлению соответствует положительное значение ЭДС реакции. Однако необходимо помнить, что в данном направлении реакция протекает практически необратимо при ЭДС, большей либо равной 0,4 В. Если же разность потенциалов оказывается меньше 0,4 В, то ОВР протекает обратимо и направление реакции определяется условиями ее проведения.
4. Выбрать наиболее вероятную реакцию из нескольких возможных.
Из всех возможных ОВР наиболее вероятной будет та реакция, которой соответствует максимальное значение (ЭДС).
5. Рассчитать значение константы химического равновесия данной реакции.
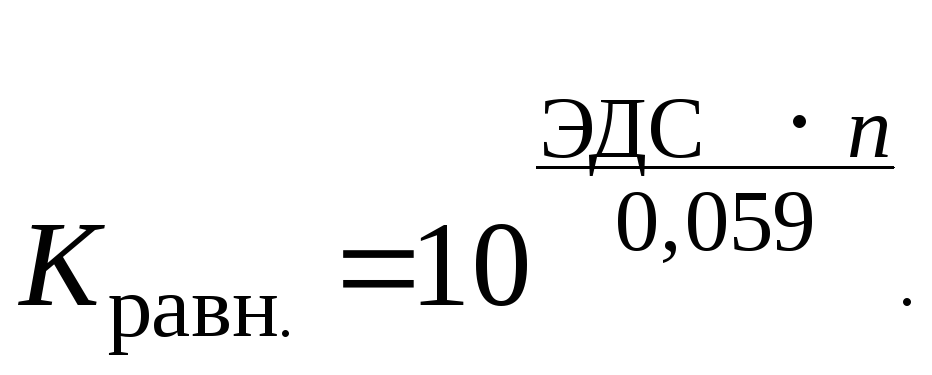 Величина
константы равновесия ОВР связана с
значением её ЭДС уравнением:
Величина
константы равновесия ОВР связана с
значением её ЭДС уравнением:
В этом уравнении n – наименьшее кратное чисел электронов, отданных восстановителем и принятых окислителем.
6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
Окислительно-восстановительная реакция протекает в том направлении, в котором осуществляется полуреакция с более высоким значением потенциала. Поэтому факторы, влияющие на величину потенциала, оказывают влияние и на направление протекания ОВР. К таким факторам относятся:
1) Концентрация потенциалопределяющих ионов;
2) Величина рН раствора;
3) Температура раствора;
4) Величина ПР малорастворимого продукта реакции;
5) Величина константы нестойкости образующегося комплексного иона.
3. Окислительно-восстановительные процессы с участием электрического тока. Электролиз расплавов и водных растворов электролитов. Электролиз с инертными и активными электродами. Схемы процессов на электродах. Получение неорганических веществ и их очистка при помощи электрического тока. Химические источники тока.
1. с. 155–159; 2. с. 285–295;; 4. с. 236; 6. с. 285–287; 11. с. 350–358.
Электролиз – электрохимический окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплавы или растворы электролитов.
При электролизе энергия электрического тока превращается в химическую энергию и при этом осуществляется процесс, обратный происходящему в гальваническом элементе.
Обратите внимание, что заряды электродов при электролизе противоположны зарядам электродов в гальваническом элементе. Поэтому:
Катод – отрицательно заряженный электрод, соединённый с отрицательным полюсом источника тока. На его поверхности протекают процессы катодного восстановления. Катод всегда изготавливается из инертных материалов (графит, платина, золото, иридий и др.)
А нод
– положительно
заряженный электрод.
На его поверхности всегда протекают
процессы анодного окисления. Анод может
быть изготовлен как из инертных материалов
(«инертный» или «нерастворимый» анод),
так и из металлов, способных в ходе
электролиза переходить в раствор
(«активный» или «растворимый» анод).
нод
– положительно
заряженный электрод.
На его поверхности всегда протекают
процессы анодного окисления. Анод может
быть изготовлен как из инертных материалов
(«инертный» или «нерастворимый» анод),
так и из металлов, способных в ходе
электролиза переходить в раствор
(«активный» или «растворимый» анод).
П
Рис.6.
Схема
процесса электролиза расплава хлорида
кальция
Процессы на катоде.
В расплавах электролитов на катоде всегда происходит восстановление катионов металлов по схеме: Меn+ + ne— = Me0 .
В водных растворах электролитов характер процессов на катоде определяется природой катионов:
а)
Катионы H+
: 2Н+
+ 2![]() =
Н2;
=
Н2;
б)
Катионы [Li+
– Al3+
] и катионы NH4+:
2Н2О
+ 2![]() = Н2
+ 2ОН–;
= Н2
+ 2ОН–;
в)
Катионы [Bi3+
– Au3+]:
Меn+
+ n![]() = Me0;
= Me0;
г) Катионы [Mn2+ – Pb2+]: одновременно восстанавливаются катионы металлов и молекулы воды.
Процессы на инертном аноде.
В расплавах электролитов:
а)
анионы ОН–
: 4ОН–
– 4![]() = О2
+ 2Н2О;
= О2
+ 2Н2О;
б)
галогенид-анионы Гал –
: 2 Гал –
– 2![]() =
=
![]() ;
;
в)
сульфид- и селенид-анионы Э2–
: Э2–
– 2![]() = Э0;
= Э0;
В водных растворах электролитов:
а)
анионы ОН–:
4ОН–
– 4![]() = О2
+ 2Н2О;
= О2
+ 2Н2О;
б)
анионы Гал –
кроме F–:
2 Гал –
– 2![]() =
=
![]() ;
;
в)
сульфид- и селенид-анионы Э2–:
Э2–
– 2![]() = Э0;
= Э0;
г) анионы кислородсодержащих неорганических кислот и анионы F–:
2H2O
– 4![]() = O2
+ 4H+;
= O2
+ 4H+;
д)
анионы карбоновых кислот: 2RCOO–
– 2![]() = R2
+ 2CO2.
= R2
+ 2CO2.
При электролизе с растворимым анодом происходит его окисление по схеме:
Ме0
– n![]() = Men+.
= Men+.
Образующиеся при этом катионы переходят в раствор и восстанавливаются на катоде. Таким образом, электролиз с растворимым анодом заключается в переносе металла с анода на катод.
Пример. Составим схемы процессов, протекающих на электродах при электролизе раствора хлорида натрия и общее уравнение процесса:
П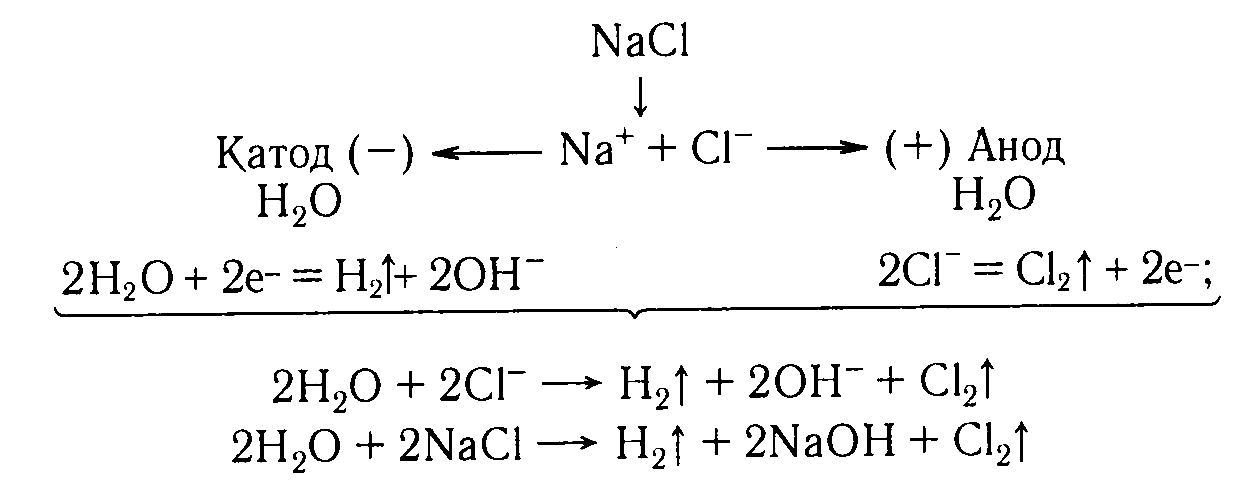 ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата меди(II) и общее уравнение
процесса:
ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата меди(II) и общее уравнение
процесса:
П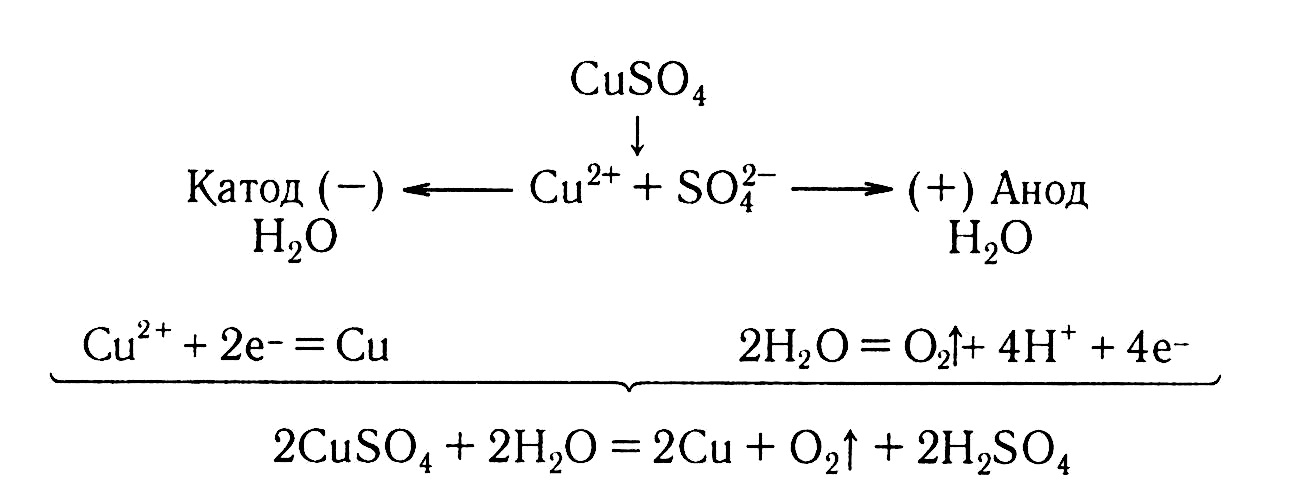 ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата калия и общее уравнение
процесса.
ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата калия и общее уравнение
процесса.