
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
Взаимосвязь важнейших соединений углерода:
C + Al
 Al4C3;
Al4C3;Al4C3 + HCl → CH4+ AlCl3;
C + H2
 CH4;
CH4;CH4 + O2
 CO2
+ H2O;
CO2
+ H2O;Al4C3 + O2
 CO2
+ Al2O3;
CO2
+ Al2O3;C + O2
 CO2;
CO2;C + CaO
 CaC2
+ CO;
CaC2
+ CO;C + H2
 С2H2;
С2H2;CaC2 + H2O → С2H2 + Ca(OH)2;
CaC2 + O2
 CO2
+ CaO;
CO2
+ CaO;С2H2 + O2
 CO2
+ H2O;
CO2
+ H2O;CH4
 С2H2
+ H2;
С2H2
+ H2;CO2 + NaOH → Na2CO3 + H2O;
Na2CO3 + HCl → CO2 + NaCl + H2O;
CO2 + NaOH → NaHCO3 + H2O;
NaHCO3
 Na2CO3
+ CO2
+ H2O;
Na2CO3
+ CO2
+ H2O;H2CO3
 CO2
+ H2O;
CO2
+ H2O;CO2 + H2O (охл.)
 H2CO3;
H2CO3;H2CO3 + NaOH → NaHCO3 + H2O;
NaHCO3 + HCl (разб., охл.) → H2CO3 + NaCl;
Na2CO3 + HCl (разб., охл.) → H2CO3 + NaCl;
H2CO3 + NaOH → Na2CO3 + H2O;
Na2CO3 + CO2 + H2O → NaHCO3;
См. № 16;
Na2CO3 + H2C2O4 → Na2 C2O4 + CO2 + H2O;
NaHCO3 + HCOOH → HCOONa + CO2 + H2O;
HCOONa
 Na2C2O4
+ H2;
Na2C2O4
+ H2;Na2C2O4
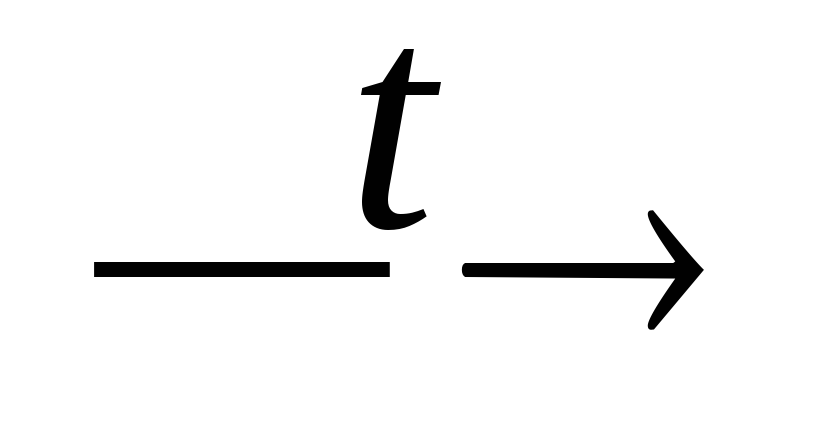 Na2CO3
+ CO;
Na2CO3
+ CO;HCOONa(крист.) + H2SO4 (конц.)
 СО↑ +NaHSO4
+ H2O;
СО↑ +NaHSO4
+ H2O;CO + NaOH(распл.)
 HCOONa;
HCOONa;СO + Cl2
 COCl2;
COCl2;COCl2
 CO + Cl2;
CO + Cl2;CO + Fe
 Fe(CO)5;
Fe(CO)5;Fe(CO)5
 CO + Fe;
CO + Fe;COCl2 + H2O → CO2 + HCl;
CO2 + C
 CO
COСO + O2
 CO2;
CO2;C + O2 (недост.)
 СО;
СО;СО
 C + CO2.
C + CO2.
XIII. Металлы
Общая характеристика металлов. Положение в периодической системе. Особенности строения атомов. Кристаллическая структура металлов. Особенности металлической связи. Проводники, полупроводники и диэлектрики. Физические и химические признаки металличности. Общая характеристика валентных состояний металлов главных и побочных подгрупп. Закономерности изменения свойств гидроксидов металлов и периодах и подгруппах периодической системы. Природные соединения металлов. Руды. Принципы их обогащения. Общие методы получения металлов и их очистки. Роль металлов в жизнедеятельности растительных и животных организмов.
1 с. 84-87; 2 с. 513-526; 11 с. 397-402, 560-574;
Металлы главных подгрупп
1. Щелочные металлы. Общая характеристика элементов. Строение атомов. Характер связи в соединениях. Проявляемые степени окисления. Физические и химические свойства простых веществ. Положение в ряду напряжений металлов. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Их получение, применение. Калийные удобрения. Роль натрия и калия в биологических объектах.
1 с. 173-185; 2 с. 543-551; 4 с. 461-470; 6 с. 451-457; 7 с. 496-498, 501-509; 8 с. 202-217; 9 с. 80-84; 11 с. 486-489.
Щелочными металлами принято называть химические элементы группы IA, а также образуемые ими простые вещества, за исключением водорода.
Конфигурация внешней электронной оболочки атомов щелочных металлов – ns1. На внешнем энергетическом слое их атомы имеют единственный электрон и во всех соединениях проявляют степень окисления +1.


