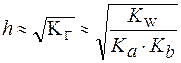- •37 Оглавление
- •Атом. Представление о строении атома. Электроны, протоны, нейтроны
- •Представление о современной квантово-механической модели атома. Характеристика состояния электронов в атоме с помощью набора квантовых чисел, их трактовка и допустимые значения
- •Последовательность заполнения энергетических уровней и подуровней электронами в многоэлектронных атомах. Принцип Паули. Правило Гунда. Принцип минимума энергии.
- •Энергия ионизации и энергия сродства к электрону. Характер их изменения по периодам и группам периодической системы д.И.Менделеева. Металлы и неметаллы.
- •Электроотрицательность химических элементов. Характер изменения электроотрицательности по периодам и группам периодической системы д.И.Менделеева. Понятие степени окисления.
- •Основные типы химической связи. Ковалентная связь. Основные положения метода валентных связей. Общее представление о методе молекулярных орбиталей.
- •Два механизма образования ковалентной связи: обычный и донорно-акцепторный.
- •Ионная связь как предельный случай поляризации ковалентной связи. Электростатическое взаимодействие ионов.
- •11.Металлические связи. Металлические связи как предельный случай делокализации валентных электронных орбиталей. Кристаллические решетки металлов.
- •12. Межмолекулярные связи. Взаимодействия Ван-дер-Ваальса – дисперсионное, диполь-дипольное, индуктивное). Водородная связь.
- •13. Основные классы неорганических соединений. Оксиды металлов и неметаллов. Номенклатура этих соединений. Химические свойства основных, кислотных и амфотерных оксидов.
- •14. Основания.Номенклатура оснований. Химические свойства оснований. Амфотерные основания, реакции их взаимодействия с кислотами и щелочами.
- •15. Кислоты.Бескислородные и кислородные кислоты. Номенклатура (название кислот). Химические свойства кислот.
- •16. Соли как продукты взаимодействия кислот и оснований. Типы солей: средние (нормальные), кислые, основные, оксосоли, двойные, комплексные соли. Номенклатура солей. Химические свойства солей.
- •17. Бинарные соединения металлов и неметаллов. Степени окисления элементов в них. Номенклатура бинарных соединений.
- •18. Типы химических реакций: простые и сложные, гомогенные и гетерогенные, обратимые и необратимые.
- •20. Основные понятия химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных процессах.
- •22. Влияние температуры на скорость химической реакции. Энергия активации.
- •23. Химическое равновесие. Константа равновесия, ее зависимость от температуры. Возможность смещения равновесия химической реакции. Принцип Ле-Шателье.
- •36. А) Стандартный водородный электрод. Кислородный электрод.
- •37. Уравнение Нернста для расчета электродных потенциалов электродных систем различных типов. Уравнение Нернста для водородного и кислородного электродов
- •3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
- •I – величина тока
- •49. Кислотно-основной метод титрования.Расчеты по закону эквивалентов. Методика титрования. Мерная посуда в титриметрическом методе
23. Химическое равновесие. Константа равновесия, ее зависимость от температуры. Возможность смещения равновесия химической реакции. Принцип Ле-Шателье.
В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия. При его наступлении она не может больше совершать полезную работу, поэтому термодинамическим критерием установления равновесия является следующее уравнение:
∆G = 0
Таким образом, любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Причем движущей силой данного процесса является изменение изобарно-изотермического потенциала системы ∆G. Чем ∆G меньше, тем дальше система находится от состояния равновесия и тем более она реакционноспособна
Равновесие может существовать только для обратимых реакций.
Если реакция осуществляется в газовой фазе, то установлено, что ∆G образования 1 моля газа при его равновесном парциальном давлении p(отличном от 1) равна
∆Gобр= ∆G°298∙RTlnp
Для реакций, протекающих в растворе, ∆G образования вещества рассчитывается аналогично:
∆Gобр= ∆G°298∙RTlnC
где C– равновесная молярная концентрация растворенного вещества
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
![]() (6.5)
(6.5)
Константа равновесия показываетво сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия– это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Принцип Ле Шателье: Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
24. Реакции без участия и с участием электронов. Ионно-обменные и окислительно-восстановительные реакции.
Ионные реакции– это химические процессы, которые протекают в водном растворе с участием ионов электролитов.
Такие реакции могут протекать как с изменением так и без изменения степени окисления:
3Cu0 + 8HN +5O3 (разб.) = 3Сu +2(NO3)2 + 2N +2O| +4H2O
3Cu0 + 8H + +2NO3 - = 3Сu2+ + 2NO| +4H2O
NaOH + HCl = NaCl + H2O
H+ + OH- = H2O
В последнем случае реакции называются реакциями двойного обмена (или обменными реакциями)
Реакции обмена- реакции, происходящие между ионами - частицами, у которых все электроны спарены. Это реакции с ионным механизмом. Если ионы связываются в молекулы полярных соединений или в ионные кристаллы, то обратная реакция невозможна. Поэтому многие реакции ионного обмена необратимы, идут до конца.
Реакции в растворах электролитов идут, когда участвующие во взаимодействии ионы полностью или частично уходят из сферы реакции (в виде осадка, газа или слабого электролита). Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
Реакции, в результате которых изменяется степень окисления элементов, называются окислительно-восстановительными.
25. Окислительно-восстановительные реакции. Окислительные и восстановительные способности металлов, неметаллов и их ионов. Составление уравнений окислительно-восстановительных реакций методом электронно-ионного баланса.
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Метод электронного баланса основан на определении общего числа электронов, перемещавшихся от восстановителя к окислителю. Для составления уравнения окислительно-восстановительной реакции необходимо, прежде всего, знать химические формулы исходных веществ и получающихся продуктов. Исходные вещества нам известны, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. Участие воды в реакции выясняется при составлении уравнения.
При составлении уравнения окислительно-восстановительной реакции необходимо соблюдать следующую логическую последовательность операций: рассмотрим реакцию взаимодействия Sb2S5и HNO3.
1. Устанавливаем формулы веществ, получающихся в результате реакции: Sb2S5+ HNO3= H3SbO4+NO+H2SO4.
2. Определяем степени окисления элементов, которые изменили ее в процессе реакции
Sb2S2-5 + HN5+O3 = H3SbO4+N2+O+H2S6+O4.
3.Определяем изменения, происшедшие в значениях степени окисления и устанавливаем окислитель и восстановитель.
В данной реакции степень окисления атомов серы S2-повысилась с 2- до 6+; следовательно, S2-является восстановителем. А степень окисления атомов азота N5+понизилась с 5+ до 2+; следовательно, N5+является окислителем. На основании этого составляем схему электронного баланса реакции:
N5+ + 3e N2+ ¦ 40 окислитель, процесс восстановления
S2-- 40e S6+¦ 3 восстановитель, процесс окисления
Пользуясь правилом электронного баланса, определяем общее число перемещающихся электронов нахождения наименьшего кратного. В данном случае оно равно 120.
4. Находим основные коэффициенты, то есть коэффициенты при окислителе и восстановителе
3 Sb2S5 + 40 HNO3 = H3SbO4 + NO + H2SO4.
5. Согласно закону сохранения массы расставляем коэффициенты в правой части уравнения (продукты реакции) перед окисленной и восстановленной формами:
3 Sb2S5 + 40 HNO3 = H3SbO4 + 40 NO + 15 H2SO4.
6. Проверяем число атомов каждого элемента (кроме водорода и кислорода) в исходных веществах и продуктах реакции и подводим баланс по этим элементам, расставляя коэффициенты:
3 Sb2S5 + 40 HNO3 = 6 H3SbO4 + 40 NO + 15 H2SO4.
7. Проверяем число атомов водорода в левой и правой частях уравнения и определяем число участвующих в реакции молекул воды
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4.
8. Проверяем сумму атомов кислорода в левой и правой частях уравнения. Если баланс по кислороду сходится, то уравнение реак-ции составлено правильно.
Все вышеописанные операции производятся последовательно с одним и тем же уравнением и переписывать реакцию несколько раз не имеет смысла. Уравнение реакции окисления сульфида сурьмы азотной кислотой, с учетом схемы электронного баланса, запишется следующим образом:
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4.
26. Способы выражения количественного состава раствора: массовая, молярная и нормальная концентрация, моляльность.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора, т.е.
![]()
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
![]()
Молярность измеряется в моль/л и показывает, сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называетсяодномолярным(1М), если 0,1 моль вещества –децимолярным(0,1М), если 0,01 моль вещества –сантимолярным(0,01М), если 0,001 моль вещества –миллимолярным(0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
![]()
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
![]()
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
![]()
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах),т.е.
![]()
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает, сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалента вещества, такой раствор называетсяоднонормальным (1н), если 0,1 моль вещества –децинормальным(0,1н), если 0,01 моль вещества –сантинормальным(0,01н), если 0,001 моль вещества –миллинормальным (0,001н).
27. Растворимость. Равновесие в гетерогенных системах. Произведение растворимости малорастворимых неорганических веществ. Условия образования и растворения осадков.
Раствори́мость— способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Равновесия между различными фазами одной системы называют фазовыми, а описывают эти фазовые равновесия посредством фазовых диаграмм или диаграмм состояния. Фазовая диаграмма позволяет установить условия равновесия между числом фаз, числом компонентов и числом степеней свободы (вариантностью) системы.
Фаза (Ф) – гомогенная (однородная по химическому составу и термодинамическим свойствам) часть системы, отделенная от других частей поверхностью раздела. Так, два нерастворимых друг в друге твердых вещества, как и две несмешивающиеся жидкости, образуют две фазы.
Компоненты (К) – химически индивидуальные вещества, наименьшее число которых достаточно для образования фаз системы.
Число компонентов определяется количеством индивидуальных веществ в системе за вычетом числа возможных между ними обратимых взаимодействий. Например, система из трех индивидуальных веществ H2O, H2, O2будет двухкомпонентной, поскольку для образования всех фаз достаточно любых двух веществ:
|
|
|
|
По числу компонентов системы делятся на одно-, двух-, трех- и многокомпонентные.
Степени свободы (С) – число параметров (температура, давление, состав системы), которые можно произвольно менять без изменения числа фаз в системе.
Правило фаз Гиббса: в изолированной равновесной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз:
|
|
|
Произведение растворимости(ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
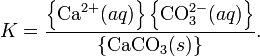
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+и n анионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
28. Водные растворы неэлектролитов. Давление насыщенного пара разбавленного раствора, температура кипения и температура кристаллизации разбавленных растворов. Осмотическое давление разбавленных растворов.
Неэлектролитами называются вещества, растворы которых не проводят электрический ток.Неэлектролиты– это вещества с неполярной или малополярной ковалентной связью, в растворах они находятся в виде молекул.
Разбавленные растворы неэлектролитов проявляют коллигативные свойства, то есть такие свойства и закономерности, которые зависят только от количества частиц в растворе (концентрации) и не зависят от природы этих частиц.
Первый закон Рауля.
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]() ,
,
где РA0– давление пара чистого растворителя, РA – давление пара растворителя над раствором, ХB – мольная доля растворенного вещества.
Этот закон можно выразить в другом виде:
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
![]() .
.
Второй закон Рауля. Изменение температуры кристаллизации и температуры кипения раствора
Замерзание растворов можно охарактеризовать
величиной понижения температуры
замерзания ΔТзам, равной разности
между температурой замерзания чистого
растворителя![]() и
температурой начала кристаллизации
раствора Tзам:
и
температурой начала кристаллизации
раствора Tзам:
ΔTзам.= T0зам.–.
Понижение температуры замерзания раствора ΔTзампрямо пропорционально моляльной концентрации раствора:
![]() ,
,
где Kкрио–криоскопическая постоянная растворителя– определяется природой растворителя (для воды Kкрио =1,86), В – растворенное вещество, A растворитель
Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении.
Повышение температуры кипения растворов
нелетучих веществ ΔTкип =
Tкип –![]() пропорционально
понижению давления насыщенного пара
и, следовательно, прямо пропорционально
моляльной концентрации раствора.
Коэффициент пропорциональности E есть
эбулиоскопическая постоянная растворителя
(для воды Е=0,52), не зависящая от природы
растворенного вещества.
пропорционально
понижению давления насыщенного пара
и, следовательно, прямо пропорционально
моляльной концентрации раствора.
Коэффициент пропорциональности E есть
эбулиоскопическая постоянная растворителя
(для воды Е=0,52), не зависящая от природы
растворенного вещества.
ΔTкип= ECмл= Е![]() .
.
В общем виде второй закон Рауля:
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Второй закон Рауля является следствием из первого; данный закон справедлив только для бесконечно разбавленных растворов.
Осмотическое давлениепрямо пропорционально молярной концентрации раствора (СМ) и абсолютной температуре (Т). Эта зависимость дается уравнением Вант-Гоффа:
Росм=СМRT,
где R – универсальная газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в м3, то R=8,3144∙103Дж∙моль-1∙К-1; Т – абсолютная температура.
Поскольку СМ=n/V, то уравнение Вант-Гоффа аналогично уравнению Менделеева-Клапейрона, которое характеризует газовое состояние вещества:
РосмV=nRT или![]() ,
,
где n – число молей растворенного
вещества; V – объем раствора. Заменяя
СМв выражении Р=СМRT его
выражением по формуле для молярной
концентрации![]() ,
где m – масса растворенного вещества;
М – молярная масса растворенного
вещества, получим формулу, удобную для
вычисления молярной массы растворенного
вещества.
,
где m – масса растворенного вещества;
М – молярная масса растворенного
вещества, получим формулу, удобную для
вычисления молярной массы растворенного
вещества.
29. Водные растворы электролитов. Сильные и слабые электролиты. Константа и степень диссоциации.
Количественная характеристика диссоциации электролитов называется степенью диссоциации(обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекаетнеобратимо (до конца), и степень превращения растворенного вещества в ионы полная.
Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего веществаcд к общей концентрации веществаcB в растворе):
α = cд/cB
всегда меньше единицы, но больше нуля (0 < α < 1).
В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4
![]() H+
+ H2PO4− (α = 23,5%)
H+
+ H2PO4− (α = 23,5%)
H2PO4−
![]() H+
+ HPO42− (α = 3*10−4%)
H+
+ HPO42− (α = 3*10−4%)
HPO42−![]() H+
+ PO43− (α = 2*10−9%)
H+
+ PO43− (α = 2*10−9%)
Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.
Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
В разбавленных растворах сильных кислот HnA их гидроанионы Hn-1A не существуют. Например, в случае серной кислоты:
H2SO4 = H+ + [HSO4−] (α1 → 1)
[HSO4−] = H+ + SO42− (α2 → 1)
H2SO4 (разб.) = 2H+ + SO42−
В концентрированных растворах содержание гидроанионов (иногда - и исходных молекул) становится заметным:
H2SO4
(конц.)
![]() H+
+ HSO4−
(α1 <
1)
H+
+ HSO4−
(α1 <
1)
HSO4−![]() H++SO42−(α2< α1< 1)
H++SO42−(α2< α1< 1)
(суммировать уравнения стадий обратимой диссоциации нельзя!)
При нагревании значения 1 и 2 возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Электролитическая диссоциация — обратимый равновесный процесс. Поэтому для диссоциации, так же как и для других, можно записать выражение для константы равновесия.
В общем виде диссоциация электролита AnBm происходит по уравнению:
AnBm nAm++mBn- (1)
Следовательно, константа равновесия будет равна:
K=[Am+]n[Bn-]m/[AnBm]
где константа равновесия К называется константой диссоциации KD, [Am+], [Bn- ] и [AnBm] — соответствующие концентрации, выраженные в моль/л.
Константа диссоциации зависит только от температуры, но не зависит от концентрации раствора.
Помимо константы диссоциации, существует еще одна количественная характеристика поведения электролита в растворе.
Степень диссоциации — это отношение числа молекул, распавшихся на ионы, к общему числу растворившихся молекул.
a=n/N,
где n — число молекул, распавшихся на ионы, а N —общее число растворенных молекул. Поскольку n£N, то соответственно соответственно 0<a<1 (или в процентах: 0<a<100%).
По степени диссоциации электролиты
разделяются на слабые, средние и
сильные. Если
значение a близко к нулю (или к 0% ), то это
значит, что диссоциации нет, и такие
электролиты называют слабыми. Еслиa®1
(или a®100%), то говорят, что диссоциация
полная, а электролит — сильный.
Если
значение a близко к нулю (или к 0% ), то это
значит, что диссоциации нет, и такие
электролиты называют слабыми. Еслиa®1
(или a®100%), то говорят, что диссоциация
полная, а электролит — сильный.
Сильными электролитами являются многие хорошо растворимые кислоты, имеющие молекулярное строение: серная, хлороводородная, азотная, хлорная, бромоводородная и др. Сильными электролитами являются также все ионные соединения (все соли и гидроксиды), даже если они плохо растворимы, поскольку они не могут существовать в растворе в молекулярном виде.
Слабые электролиты — это такие кислоты, как сернистая» борная, уксусная и большинство органических кислот, и вода.
Степень диссоциации, в отличие от константы диссоциации, зависит от концентрации. Чем меньше концентрация, тем выше значение а. Эта зависимость выполняется для всех электролитов (сильных и слабых), имеющих молекулярное строение. Степень диссоциации ионных электролитов от концентрации не зависит, т.к. для них всегда а = 1.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞— значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
30. Электролитическая диссоциация воды. Константа диссоциации воды. Ионное произведение воды.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−илиH2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
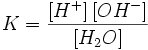
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды
равна 1,8Ч10−16моль/л. Уравнение (1) можно
переписать как: ![]() Обозначим
произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56
моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Обозначим
произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56
моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так как Kв — константа, при добавлении
к раствору кислоты (ионов H+), концентрация
гидроксид-ионов OH− будет падать и
наоборот. В нейтральной среде [H+] = [OH−]
= ![]() моль/л.
При концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной.
моль/л.
При концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной.
Электролитическая диссоциация воды. Водородный показатель рН
Вода представляет собой слабый амфотерный электролит:
Н2О Н+ + ОН-или, более точно:2Н2О Н3О+ + ОН-
Константа диссоциации воды при 25оС
равна: ![]() Такое
значение константы соответствует
диссоциации одной из ста миллионов
молекул воды, поэтому концентрацию воды
можно считать постоянной и равной 55,55
моль/л (плотность воды 1000 г/л, масса 1 л
1000 г, количество вещества воды
1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55
моль/л). Тогда
Такое
значение константы соответствует
диссоциации одной из ста миллионов
молекул воды, поэтому концентрацию воды
можно считать постоянной и равной 55,55
моль/л (плотность воды 1000 г/л, масса 1 л
1000 г, количество вещества воды
1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55
моль/л). Тогда
![]()
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW:
![]()
Так как диссоциирована лишь ничтожная доля молекул воды, то равновесную концентрацию недиссоциированных молекул, равную 55,6 моль/л, можно считать постоянной. Произведение двух постоянных величин K[Н2О] можно представить в виде одной константы:
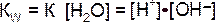
Константа Кw, равная произведению концентраций ионов Н+ и ОН-, величина постоянная при данной температуре, получила названиеионное произведение воды.
31. Водородный показатель рН среды для растворов электролитов. Шкала рН. Формулы для расчета рН для сильных и слабых кислот и оснований.
Концентрация катионов водорода [H+] обычно выражается очень малыми величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который названводородным показателем, и обозначаетсярН:
рН = –lg [H+], где[H+]- молярная концентрация ионовH+. Следовательно: [H+]= 10–pH
Если реакция среды нейтральная, то [H+] = 10–7[моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7[моль/л], и рН<7. Если среда щелочная, то [H+]<10–7[моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН):
рОН = –lg [ОH-], где[ОH-] - молярная концентрация ионовОH-. А также показатель константы воды: рКВ= –lg КВ. Логарифмируя ионное произведение воды, получаем выражение: –lg [H+][OH–] = –lg 10–14и далее:pH + pOH = 14.
1. Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4) протекает практически полностью, можно считать: [H+] = Скисл., где Скисл- молярная концентрация кислоты.
HNO3H+ + NO3– (сильная кислота - сильный электролит)
Расчет рН сильной кислоты проводят по уравнению
рН = - lgаН+ = - lgfН+[H+], гдеаН+ - активная концентрация, моль/л.
2. При расчете рН слабых электролитов обычно принимают ионную силу раствора (I)равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
HNO2 H+ + NO2–(слабая кислота - слабый электролит)
Концентрация ионов водорода в растворе слабых кислот определяют по закону разведения Оствальда:

,где α – степень диссоциации кислоты, Скисл– молярная концентрация кислоты, Ккисл– константа диссоциации кислоты, характеризует силу кислоты: чем меньше константа диссоциации, тем слабее кислота.
Расчет рН в растворах сильных и слабых оснований
1. Диссоциация сильного основания (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2) протекает практически полностью:
NaOH Na+ + OH–(сильное основание - сильный электролит)
Можно считать, что [ОH-] = Сщел, где Сщел- молярная концентрация сильного основания (щелочи). Расчет рН раствора сильного основания проводят по схеме: рОН = - lgаОН- = - lgfОН-[ОH-]; рН = 14 – рОН.
2. Диссоциация слабого основания протекает незначительно, частично:
NH3∙H2O NH4+ + OH–(слабое основание - слабый электролит)
Молярную концентрацию гидроксид – ионов [ОH-] в растворе слабого основания рассчитывают по закону разведения Оствальда:
, где α – степень диссоциации основания, Сосн–
молярная концентрация основания, Косн– константа диссоциации основания, характеризует силу основания: чем меньше константа диссоциации, тем слабее основание.
ШКАЛА ПХ
0 до 7 – основание
7 до 14 - кислота
32. Диссоциация сильных электролитов. Активность ионов в растворах. Коэффициент активности. Представление об ионной силе растворов.
Сильные электролиты— химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Йонная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI), гидроксиды щелочных и щёлочноземельных металлов (NaOH, KOH, Ba(OH)2); большинство солей.
Активность (ионов)— эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называетсякоэффициентом активности: γ = a/c.
Ионная сила раствора— мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
 ,
,
где cB— молярные концентрации отдельных ионов (моль/дм^3),zBзаряды ионов.
33. Гидролиз солей. Количественные характеристики процесса гидролиза. Факторы, влияющие на процесс гидролиза. Расчеты рН гидролиза солей различной природы.
Типы гидролиза солей
Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей.
Любую соль можно представить, как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей.
Гидролиз по анионуидет, если соль образована катионом сильного основания и анионом слабой кислоты. Например, соль СН3СООNa образована сильным основанием NaOH и слабой одноосновной кислотой СН3СООН. Гидролизу подвергается ион слабого электролита СН3СОО–.
Гидролиз по катионуидет, если соль образована катионом слабого основания и анионом сильной кислоты. Например, соль CuSO4 образована слабым двухкислотным основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием в качестве промежуточного продукта основной соли.
Гидролиз по катиону и анионуидет, если соль образована катионом слабого основания и анионом слабой кислоты. Например, соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой СН3СООН. Гидролиз идет по катиону NH4+ и аниону СН3СОО–.
Количественно гидролиз можно охарактеризовать при помощи константы гидролиза (КГ)истепени гидролиза (h).
Константа гидролиза (KГ) - это отношение ионного произведения воды (Kw) к константе диссоциации слабого основания или слабой кислоты, образующих данную соль.
Частное от деления одной постоянной величины на другую есть также величина постоянная. Поэтому KГ- величина постоянная, которая характеризует способность соли подвергаться гидролизу. ЗначениеKГзависит от природы соли, температуры ине зависитот концентрации раствора.
1. Для солей типа NH4Cl:
|
|
(1) |
Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
2. Для солей типа CH3COONa:
|
|
(2) |
Чем слабее кислота, тем в большей степени подвергаются гидролизу соли, образованные этой кислотой.
3. Для солей типа NH4CN:
|
|
(3) |
Чем слабее кислота и основание, образующие соль, тем в большей степени протекает гидролиз соли.
4. Для солей типа Na2CO3(две ступени гидролиза):
|
|
(4) |
|
|
(4´) |
Так как ![]() ,
следовательно,
,
следовательно,![]() .
Таким образом, по первой ступени гидролиз
солей всегда протекает в большей степени.
.
Таким образом, по первой ступени гидролиз
солей всегда протекает в большей степени.
Степень гидролиза (h) - отношение количества гидролизованной соли к общему количеству растворенной соли, обычно выражаемое в процентах.
Если, например, в воде было растворено
2 моль соли, а гидролизу подверглось
0,01 моль, то ![]() .
.
Степень гидролиза зависит от многих факторов:
1. В первую очередь, она зависит от химической природы составляющих данную соль ионов. Так, в растворах CH3COONa и NaCN с молярными концентрациями 0,1 моль/л при 250С степень гидролиза солей различна:
h(CH3COONa) = 0,01%, a h(NaCN) = 1,5%.
Это объясняется различной силой кислот, составляющих соли:
![]()
![]()
![]() .
.
Таким образом:
Чем слабее кислота (основание), образующие соль, тем выше степень гидролиза.
2. Степень гидролиза сильно меняется c изменением температуры раствора соли. Действительно, процесс гидролиза является эндотермическим, поэтому:
Чем выше температура, тем больше степень гидролиза.
3. Степень гидролиза зависит от концентрации раствора:
Чем меньше концентрация раствора соли, тем больше степень гидролиза.
Степень гидролиза может быть выражена через константу гидролиза:
1. Для солей типаNH4Cl:
|
|
(5) |
2. Для солей типаCH3COONa:
|
|
(6) |
3. Для солей типаNH4CN:
|
|
(7) |
Таким образом, степень гидролиза солей, образованных слабой кислотой и слабым основанием, практически не зависит от концентрации раствора соли.
34. Электродный потенциал. Возникновение скачка потенциала на межфазной границе. Понятие об электродной системе и электродной реакции.
Электродный потенциал-относительная величина т.к. измеряется относительно эталона, за эталон принимается водородный электрод
Скачек потенциала
При протекании электрохимической реакции на поверхности электродов 1 род образуется положительный или отрицательный заряд относительно прилегающего слоя раствора, который называется скачек потенциала. Этот скачек измерить сложно, поэтому вводят понятие электродный потенциал
35. Электродные системы, их классификация. Оx- и red- определяющие частицы в электродных системах разного типа.
1 родасостоит из металлического электрода – проводника опущенного в водный раствор электролита, который имеет также катионы этого металла . (Металл опущен в раствор своей соли). Электрод проводник –RED, а его катион -OX
2 родасостоит из электрода проводника металла, покрытого малорастворимым соединением, имеющим те же анионы этого металла, и опущен в раствор электролита, содержащий одноименные анионы малорастворимого соединения. В электродах второго рода окисленной формой является малорастворимое соединение (МА), восстановленной – атом металла (М) и анион раствора (АZ-).
Неметаллические электроды
Неметаллические электроды - системы состоящие из электрода проводника не участвующего в электродной реакции, а являющиеся поставщиками электронов для электродной реакции. Если в неметаллическом электроде частицы OXиREDявляются ионами, то такие электроны называютсяредокси. Если одна из потенциалоопределяющих частиц- газ, то такие электроды называютсягазовыми.
36. Понятие о стандартном равновесном электродном потенциале. Таблица стандартных электродных потенциалов. Электрохимический ряд напряжений металлов и его использование для оценки электрохимической активности металлов.

 .
. .
. .
.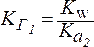
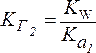
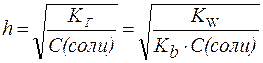 .
.