
2 семестр / Медь реферат1
.docxМИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«МАИ – Московский авиационный университет» (МАИ)
Институт №2
«Аэрокосмические конструкции, технологии и системы управления»
Кафедра
«Общая химия, физика и химия композиционных материалов»
РЕФЕРАТ
Медь
по дисциплине
«ХИМИЯ»
Студент:
Фамилия И.О.
Группа:
Полный номер группы
Преподаватель:Каслина Н.А.
Фамилия И.О.
Отметка о выполнении (защиты) работы
Дата (защиты работы)
Москва 20
Содержание:
-
Вступление 2
-
Положение Cu в Периодической таблице Д.И. Менделеева 3
-
Проявляемые степени окисления Cu в соединениях 3
-
Местоположение Cu в электрохим. ряду напряжений металлов 3
-
Оценка red активности Cu и ox/red способности соединений 3
-
Поведение Cu в компактном состоянии в различных средах 4
-
В атмосфере сухого воздуха 4
-
В воде 4
-
Взаимодействие с неокисл. кислотами 4
-
Взаимодействие с окисл. кислотами 5
-
Взаимодействие с растворами и расплавами 6
-
-
Возможные процессы электрохимической коррозии 6
-
Вступление
Медь является одним из главных химических элементов. В чистом виде медь представляет собой красновато-оранжевый металл с высокой тепло- и электропроводностью. Она применяется для производства широкого ряда изделий, включая электрические провода, кухонную посуду, трубы, автомобильные радиаторы и многое другое. Медь также используется в качестве пигмента и консерванта для красок, бумаги, тканей и дерева. Совместно с цинком медь применяется для производства латуни, а с оловом - для производства
-
Положение в Периодической таблице Д.И. Менделеева
Медь (Cuprum), Сu — химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Порядковый номер 29, атомная масса 63,54. Распределение электронов в атоме меди 1s2 2s2 2p6 3s2 3p6 3d10 4s1
-
Проявляемые степени окисления в соединениях
В соединениях медь проявляет две степени окисления: +1 и +2.
-
Местоположение в электрохимическом ряду напряжений металлов
Ряд напряжений используется на практике для сравнительной [относительной] оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе. В этом ряду медь стоит правее водорода, что делает её слабым восстановителем, а также означает её неспособность взаимодействовать при стандартных условиях с водными растворами кислот-неокислителей.
|
Металл |
Катион |
φ0, В |
Реакционная способность |
Электролиз (на кат.): |
|
Cu |
Cu2+ |
+0,338 |
Низкая реакционная способность |
Выделение металла в чистом виде |
-
Оценка red активности меди и ox/red способности соединений
Исходя из данных таблицы стандартных потенциалов и выводов, сделанных в п.п.2,3,4 можно говорить о меди, как о металле с выраженной окислительной способностью (с повышением степени окисления возрастают окислительные свойства соединений меди), химическая активность невелика.
-
Поведение меди в компактном состоянии в различных средах
-
В атмосфере сухого воздуха
-
По
соотношению Пиллинга - Бедвортса
 .
Следовательно на поверхности металла
образуется сплошная и плотная пленка,
которая предохраняет металл от дальнейшего
окисления.
.
Следовательно на поверхности металла
образуется сплошная и плотная пленка,
которая предохраняет металл от дальнейшего
окисления.

(Однако при 400–500°С образуется оксид двухвалентной меди:
2Cu + O2 = 2CuO
А при температуре выше 1000°С получается оксид меди (I):
4Cu + O2 = 2Cu2O.)
-
В воде
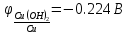
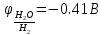

C водой не взаимодействуют металлы, которые в ряду напряжения металлов стоят правее водорода, т.к. медь является слабым восстановителем

-
Взаимодействие с неокисл. кислотами




Медь
не реагирует с
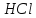 и
и
 ,
т.к. стоит правее водорода, поэтому не
в состоянии заместить ион водорода в
растворе кислоты.
,
т.к. стоит правее водорода, поэтому не
в состоянии заместить ион водорода в
растворе кислоты.
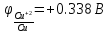
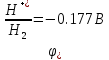
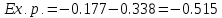
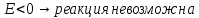
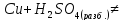
-
Взаимодействие с окисл. кислотами

 для
серы в таблице не найдено, следовательно,
ищем возможность протекания реакции в
справочных материалах:
для
серы в таблице не найдено, следовательно,
ищем возможность протекания реакции в
справочных материалах:

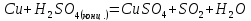

Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O – горячий концентрат,
Cu + H2SO4 → CuO + SO2↑ + H2O – холодный концентрат;
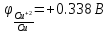
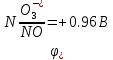
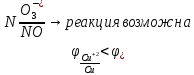
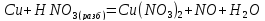
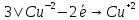
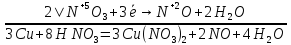
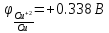
6
ице)338=−0.561пленка, которая предохраняет
металл от дальнейшего
окисления
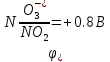
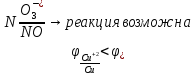
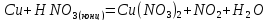


6.5 Взаимодействие с растворами и расплавами
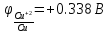
+0,338 B > -0,83 B, следовательно металл устойчив к растворам щелочей.
Реакция с расплавами также не протекает.
-
Возможные процессы электрохимической коррозии
Электрохимическая коррозия при контакте железа с медью.
В коррозионной гальванической паре железо (φ0 = -0.44 В) является анодом, оно окисляется, а медь (φ0 = +0.34 В) является катодом; на меди происходит восстановление окислителя, содержащегося в окружающей среде.
В нейтральной среде (рН = 7), во влажной атмосфере с доступом кислорода:


A (-): Fe/ O2, H2O /Cu :(+) K

OH
Анод: 2|Fe – 2e = Fe2+ (окисление)
Катод: 1|O2 + 2H2O + 4e = 4OH- (восстановление)
Окислению всегда подвергается более активный металл. На поверхности меди – менее активного металла происходит кислородная деполяризация, т.е. восстановление кислорода в присутствии воды с образованием ОН--групп.
Молекулярное уравнение коррозии:
2Fe + O2 + 2H2O = 2Fe(OH)2
В местах контакта железных и медных деталей образуется Fe(OH)2, последний окисляется кислородом воздуха до Fe(OH)3.
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
На воздухе Fe(OH)3 может частично или полностью дегидратироваться с образованием FeOOH и затем Fe2O3.
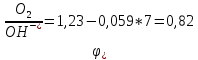
E
х.р.=
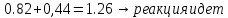
В водном нейтральном растворе (рН = 7), не содержащем растворенного кислорода, на катоде (меди) восстанавливаются молекулы воды
Анод: Fe – 2e = Fe2+ (окисление)
Катод: 2H2O + 2e = H2 + 2OH-(восстановление)
Молекулярное уравнение коррозии
Fe + 2H2O = Fe(OH)2 + H2

Eх.р.=
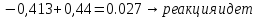
В водном растворе кислоты (рН < 7):


OH
A (-): Fe/ H2SO4 /Cu :(+) K

Анод: Fe – 2e = Fe2+ (окисление)
Катод: 2H+ + 2e = H2 (восстановление)
На поверхности меди (катоде) происходит восстановление ионов водорода, то есть водородная деполяризация.
Молекулярное уравнение коррозии
Fe
+ H2SO4 =
FeSO4 +
H2
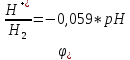
Eх.р.=

Продуктом коррозии является растворимая соль FeSO4.
При контакте железа с медью усиливается разрушение железа вследствие электрохимической коррозии, т. к. железо более активный металл, чем медь (в электрохимическом ряду напряжений металлов железо стоит левее меди).)
