
2 семестр / 1
.docx1.
Расчет рН в растворах сильных кислот и оснований.
Расчет рН в растворах сильных одноосновных кислот и оснований проводят по формулам:
рН = - lg Cк
рН =14 + lg Со
Где Cк , Со –молярная концентрация кислоты или основания, моль/л
Пример 1. Вычислить рН, рОН, Н+ , ОН- в 0.01М HCl.
Решение. Соляная кислота относится к сильным кислотам, поэтому можно принять концентрацию ионов водорода равной концентрации кислоты Н+ =0.01моль/л. Значение рН вычисляется по формуле ( 1) и равно рН= -lg 0.01 =2. Концентрацию гидроксид-ионов можно найти, зная величину ионного произведения воды:
ОН- =10-14/Н+ = 10-14/0.01 = 10-12
Значение рOH = -lg 10-12 =12
Кроме того величину рОН можно найти из известного равенства (3 )
рН + рОН = 14
Расчет рН в растворах слабых кислот и оснований
Расчет рН в растворах слабых одноосновных кислот и оснований проводят по формулам
рН = 1/2 (рКк – lgCк)
рН = 14 - 1/2( рКО - lg CО)
Пример2.1. Вычислить рН 0.03 М раствора NH4OH после смешивания его с водой в соотношении 1:2.
Решение. После смешивания 0.03М раствора аммиака с водой, его концентрация уменьшится в три раза. Подставляя в формулу (5) значение рК(NH4OH )= 4.76 и концентрацию раствора после разбавления ,получим :
рН = 14 – 1/2 (4.76- lg 0.01) = 10.62
Пример 2.2 Вычислить рН при сливании 100мл соляной кислоты с Т=0.07300г/мл со 100мл раствора соляной кислоты с Т (HCl/NaOH ) =0.004000г/мл.
Решение. Значение рН после сливания двух растворов будет определяться суммарной концентраций ионов водорода, которая находится по формуле (6) :
( СмV)1 + ( СмV)2 = ( СмV)3 (6),
где V3 =V1 + V2
Молярная концентрация ионов водорода в первом растворе находится по формуле СМ (HCl )= Т(HCl )1000/М(HCl )=0.073001000/36.5 = 2.0 моль/л; во втором растворе по формуле : СМ(HCl )=f СН(HCl ); f=1;
СН(HCl )= Т(HCl/NaOH )1000/МЭ(NaOH) =0.0040001000/40 =0.01моль/л. Молярная концентрация ионов водорода в растворе, полученном после сливания и вычисленная по формуле (6) равна. См = 0.105 моль/л, рН = -lg0.105 =0.98
Пример 2.3 . Как изменится рОН 200мл 0.01М NH4OH при добавлении к нему 100 мл 0.03М раствора NaOH ?
Решение . Вычислим значение рН раствора аммиака в первоначальном растворе по формуле (5): рН =14 –1/2 (4.76 – lg0.01) =10.62. Значение рОН в таком растворе рОН=3.38, а концентрация гидроксид ионов равна ОН- =10-3.38 =0.00046 моль/л, т.е. на два порядка меньше ,чем концентрация гидроксид-ионов в растворе NaOH. Поэтому значение рОН раствора , полученного при сливании будет в основном определяться концентрацией сильного электролита NaOH с учетом разбавления за счет добавления раствора аммиака .
Значение рОН = -lg1000.03/300 =2
2.
Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, αС = [X+] моль/л, и αC = [Y–] моль/л.
Если электролит сильный (α = 1), концентрация каждого из ионов просто равна исходной концентрации электролита. Например, в 1 литре 0,1 М раствора NaCl содержится 0,1 моль ионов Na+ и 0,1 моль ионов Cl–.
К физическому смыслу произведения αС можно прийти и другим путем. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы:
HCN ![]() H+ + CN–
H+ + CN–
Напомним, что в выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. Напомним также, что n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H+] и n1 = [CN–]. В этом случае:

Отсюда следует, что
[H+] = Cα, [CN–] = Cα.
Итак, мы приходим к тому же выводу: чтобы получить концентрацию любого из ионов в растворе, достаточно общую концентрацию вещества С умножить на коэффициент α – степень его диссоциации.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:

Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:
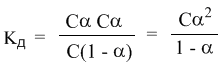
Или, в другой записи:
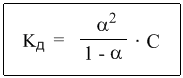
Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются надва иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.
Однако в случае слабых электролитов величина (1 – α) очень мало отличается от единицы. Действительно, если α = 0,01, то (1 – 0,01) = 0,99, т.е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде:
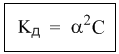
Константа диссоциации, как и любая константа равновесия, при данной температуре постоянна. Поэтому, если уменьшается концентрация вещества (раствор разбавляют), то для сохранения постоянства константы диссоциации должна возрастать величина α. Посмотрите опыт из Единой коллекции цифровых образовательных ресурсов: при разбавлении концентрированной уксусной кислоты раствор начинает слабо проводить ток (лампочка слегка накаляется). Это означает, что при разбавлении возрастает степень диссоциации слабого электролита. Наоборот, чем концентрирование раствор, тем меньше степень диссоциации α.
Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10–5. Поскольку электролит слабый (Кд много меньше 1), можно воспользоваться законом разбавления для слабых электролитов: К = α2С. Отсюда:
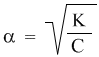
Подставляя в эту формулу численные значения, получим:

