
- •37 Оглавление
- •Атом. Представление о строении атома. Электроны, протоны, нейтроны
- •Представление о современной квантово-механической модели атома. Характеристика состояния электронов в атоме с помощью набора квантовых чисел, их трактовка и допустимые значения
- •Последовательность заполнения энергетических уровней и подуровней электронами в многоэлектронных атомах. Принцип Паули. Правило Гунда. Принцип минимума энергии.
- •Энергия ионизации и энергия сродства к электрону. Характер их изменения по периодам и группам периодической системы д.И.Менделеева. Металлы и неметаллы.
- •Электроотрицательность химических элементов. Характер изменения электроотрицательности по периодам и группам периодической системы д.И.Менделеева. Понятие степени окисления.
- •Основные типы химической связи. Ковалентная связь. Основные положения метода валентных связей. Общее представление о методе молекулярных орбиталей.
- •Два механизма образования ковалентной связи: обычный и донорно-акцепторный.
- •Ионная связь как предельный случай поляризации ковалентной связи. Электростатическое взаимодействие ионов.
- •11.Металлические связи. Металлические связи как предельный случай делокализации валентных электронных орбиталей. Кристаллические решетки металлов.
- •12. Межмолекулярные связи. Взаимодействия Ван-дер-Ваальса – дисперсионное, диполь-дипольное, индуктивное). Водородная связь.
- •13. Основные классы неорганических соединений. Оксиды металлов и неметаллов. Номенклатура этих соединений. Химические свойства основных, кислотных и амфотерных оксидов.
- •14. Основания.Номенклатура оснований. Химические свойства оснований. Амфотерные основания, реакции их взаимодействия с кислотами и щелочами.
- •15. Кислоты.Бескислородные и кислородные кислоты. Номенклатура (название кислот). Химические свойства кислот.
- •16. Соли как продукты взаимодействия кислот и оснований. Типы солей: средние (нормальные), кислые, основные, оксосоли, двойные, комплексные соли. Номенклатура солей. Химические свойства солей.
- •17. Бинарные соединения металлов и неметаллов. Степени окисления элементов в них. Номенклатура бинарных соединений.
- •18. Типы химических реакций: простые и сложные, гомогенные и гетерогенные, обратимые и необратимые.
- •20. Основные понятия химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных процессах.
- •22. Влияние температуры на скорость химической реакции. Энергия активации.
- •23. Химическое равновесие. Константа равновесия, ее зависимость от температуры. Возможность смещения равновесия химической реакции. Принцип Ле-Шателье.
- •36. А) Стандартный водородный электрод. Кислородный электрод.
- •37. Уравнение Нернста для расчета электродных потенциалов электродных систем различных типов. Уравнение Нернста для водородного и кислородного электродов
- •3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
- •I – величина тока
- •49. Кислотно-основной метод титрования.Расчеты по закону эквивалентов. Методика титрования. Мерная посуда в титриметрическом методе
20. Основные понятия химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных процессах.
Химическая кинетика –изучает скорость химической реакции и зависимость ее от различных факторов, а также механизм протекания химических реакций.
Скоростью химической реакции называют число элементарных актов реакции, происходящих в единицу времени.
Скорость химической реакции зависит от:
1) концентрации реагирующих веществ;
2) температуры;
3) присутствия катализаторов;
4) природы реагирующих веществ;
5) степени измельчения твердого вещества;
6) перемешивания, если вещества находятся в растворенном состоянии.
Vист =![]()
Средняя скорость каждой реакции определяется изменением молярной концентрации реагирующих в-в за промежуток времени. (моль/(литр*с))
21. Влияние концентрации на скорость химической реакции. Закон действующих масс.
Закон действующих масс показывает зависимость скорости хим. реакц. от концентрации реагир. в-в.
Скорость хим. реакт. Прямо пропорциональна произв. конц. реагирующих в-в, взятых в степенях их стехиометрических коэф.
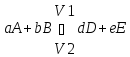


Для газовых реакций можно пользоваться
парциальным давлением.
Закон справедлив
только для ГОМОГЕННЫХсистем. Если
система гетерогенная, то скор. Реакц.
Зависит от пов-ти раздела(степени
давления) твердой фазы.![]()

22. Влияние температуры на скорость химической реакции. Энергия активации.
При повышении температуры увеличивается запас внутренней энергии молекул. Всё большее их число становятся активными. Как следствие этого, возрастает доля эффективных соударений между молекулами за единицу времени, а значит и скорость химической реакции.
При повышении температуры концентрации исходных веществ в реакционной смеси практически не изменяются. Значит, увеличение скорости реакции в соответствии с главным кинетическим уравнением должно быть связано с возрастанием её константы скорости.
Голландский учёный Вант-Гофф опытным путём определил, что для химических реакций (имеющих нормальный тип зависимости скорости от температуры) при повышении температуры на каждые 10 градусов величина константы скорости возрастает в 2-4 раза. Причём для каждой химической реакции это число является постоянным и может принимать из указанного интервала как целочисленные (2, 3, 4) значения, так и дробные. Оно определяется экспериментально, называетсятемпературным коэффициентом скорости химической реакции или коэффициентом Вант-Гоффа и обозначается греческой буквой γ:
γ = ![]()
где kТ – константа скорости химической реакции при температуре, равной Т; kT+10 – константа скорости химической реакции при температуре, повышенной, по сравнению с исходной, на 10 градусов.
Энергию активации химической реакции (Еа) по физическому смыслу можно определить как тот избыток энергии, по сравнению со средней энергией неактивных молекул исходных веществ в реакционной системе при данной температуре, который им нужно сообщить, чтобы столкновения между ними привели к химической реакции.
Минимальный запас энергии, которым должны обладать молекулы для вступления в ту или иную реакцию, можно рассматривать как своеобразный энергетический барьер этой реакции.
Причём, чем он выше, тем меньшее число молекул способно его преодолеть. Зная общее число молекул в системе и величину энергии активации для данной реакции, количество таких активных молекул можно рассчитать по закону Максвелла-Больцмана
Na = No∙
где Na – число активных молекул, No– общее число молекул.
