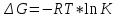1 семестр / Коллоквиум 2
.docx
-
Химическая кинетика – это наука, изучающая скорости химических реакций, зависимость их от различных факторов.
-
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Химические реакции, протекающие полностью в одной фазе, называются гомогенными химическими реакциями. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
-
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства Средняя скорость каждой реакции определяется изменением молярной концентрации реагирующих веществ за данный промежуток времени


K – Константа скорости для газовых реакций можно писать парциальное давление.
S – площадь твердой фазы P – парциальное давление газа
-
Закон действующих масс (ЗДМ) показывает зависимость скорости химической реакции от концентрации реагирующих веществ. Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятой в степени стехиометрических коэффициентов.


 Закон
справедлив только для гомогенных
систем. Если система гетерогенна, то
скорость реакции зависит от поверхности
раздел (степени дробления твердой
фазы)
Закон
справедлив только для гомогенных
систем. Если система гетерогенна, то
скорость реакции зависит от поверхности
раздел (степени дробления твердой
фазы)


-
Константа скорости зависит от температуры и природы реагирующих веществ.
-
Молекулярность реакции определяется числом частиц одновременно участвующих в акте химических превращений. Реакции бывают: - Мономолекулярными – термический распад молекул простого вещества

 -
Бимолекулярными – наиболее
распространены. В них участвуют две
молекулы
-
Бимолекулярными – наиболее
распространены. В них участвуют две
молекулы

 -
Тримолекулярные – встречаются
реже, поскольку вероятность одновременного
соударения достаточно мала.
-
Тримолекулярные – встречаются
реже, поскольку вероятность одновременного
соударения достаточно мала.
 Порядок
реакций (n)
отражается суммой показателей степеней
(стехиометрических коэффициентов в
уравнениях ЗДМ) при концентрациях
выражения ЗДМ
Порядок
реакций (n)
отражается суммой показателей степеней
(стехиометрических коэффициентов в
уравнениях ЗДМ) при концентрациях
выражения ЗДМ


 Порядок
реакции либо равен молекулярности,
либо(в большинстве случаев) меньше
её. Причины расхождения между
молекулярностью и порядком реакции
различны:
1. При условии большого
избытка одного из реагирующих веществ
по сравнению с другими его концентрациями
2.
Если реакция протекает в несколько
стадий (фаз)
Порядок
реакции либо равен молекулярности,
либо(в большинстве случаев) меньше
её. Причины расхождения между
молекулярностью и порядком реакции
различны:
1. При условии большого
избытка одного из реагирующих веществ
по сравнению с другими его концентрациями
2.
Если реакция протекает в несколько
стадий (фаз)γ – температурный коэффициент
-
Зависимость Скорости реакции от Температуры определяется правилом Вант-Гоффа: При повышении температуры на каждые 10 градусов, скорость большинства реакций увеличивается в 2 – 4 раза. Математическое выражение:

-
Энергия активации – энергия, которую надо сообщить молекулам (частицам(реагирующим веществам)), чтобы они превратились в активные.
 Для
того, чтобы столкновение реагирующих
веществ привело к химической реакции,
необходимо, чтобы в нём принимали
участие молекулы с повышеным запасом
энергии, по сравнению с со среднией
величиной энергии молекул. Такие
молекулы получили название
активных.
Зависимость между константой
скорости реакции, энергией активации
и температурое дает уравнение Аррениуса.
Для
того, чтобы столкновение реагирующих
веществ привело к химической реакции,
необходимо, чтобы в нём принимали
участие молекулы с повышеным запасом
энергии, по сравнению с со среднией
величиной энергии молекул. Такие
молекулы получили название
активных.
Зависимость между константой
скорости реакции, энергией активации
и температурое дает уравнение Аррениуса.K – константа скорости реакции К0 – эмпирическая постоянная для реакции/постоянная Аррениуса, предэкспоненциальный множитель e – экспонента. Основывается на нат. Лог. R – газовая постоянная T – абсолютная температура
-
Уравнение Аррениуса:
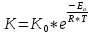 Для
расчёта энергии активации необходимо
иметь данные по значению констант
скорости реакций при различных
температурах
Для
расчёта энергии активации необходимо
иметь данные по значению констант
скорости реакций при различных
температурах


-
Вещества, изменяющие скорость химических процессов называются катализаторами(или ингибиторами) Катализаторы бывают твёрдые, жидкие, газообразные Их состав к концу реакции остается без изменений. Изменение скорости химических реакций в присутствии катализатора называется катализмом. Различают катализ: гомогенный (катализатор и реагирующие вещества находятся в одном агрегатном состоянии) и гетерогенный (когда имеется граница раздела фаз) Действие катализатора объясняется тем, что при его участии возникают неустойчивые промежуточные соединения (активированные комплексы, распад которых приводит к образованию реакции, при этом энергия активации понижается и активными становятся некоторые молекулы, энергия, которых была недостаточна для осуществления реакции в отсутствие катализаторов) Следовательно, общее число активных молекул увеличивается и скорость реакции повышается.
-
T1=273 T2=313 V*16 DT=313-273=40 16=X40/10=2
-




-
2A+B=A2B CA*2 CB/2 V1=K*CA2*CBb=1 V2= K*2CA2*CBb/2=2
-
2H2+O2=2H2O V1=1 V2=1/8

-
 Понятие
химическое равновесие применимо
только в обратимых процессах
(протекающих в прямом и обратном
направлении)
Химическим равновесием
называют такое состояние системы, при
котором скорость прямой реакции =
скорости обратной (кинетическое
условие равновесия)
Термодинамическое
условие равновесия:
Изменеие
энтальпии, энтропии, энергии Гиббса =
0
Понятие
химическое равновесие применимо
только в обратимых процессах
(протекающих в прямом и обратном
направлении)
Химическим равновесием
называют такое состояние системы, при
котором скорость прямой реакции =
скорости обратной (кинетическое
условие равновесия)
Термодинамическое
условие равновесия:
Изменеие
энтальпии, энтропии, энергии Гиббса =
0


 (равно, или близко к 0)
Также
характеризуется постоянным для данных
условий соотношением равновесных
концентраций всех веществ, участвующих
в реакции (Cравн).
(равно, или близко к 0)
Также
характеризуется постоянным для данных
условий соотношением равновесных
концентраций всех веществ, участвующих
в реакции (Cравн). -
О состоянии равновесия говорит Константа равновесия (К), величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов. с жидкостями: aA+bB=dD+eE
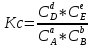 С – мольная концентрация
с газами:
С – мольная концентрация
с газами:
 P
– парциальное давление. Только для
газов!
P
– парциальное давление. Только для
газов! -
 Kp=
Kp= Kc=
Kc=
-

 Если
реакция гетерогенна, то в выражение
константы равновесия не входят
(принимаются за 1) твёрдые вещества и
индивидуальные жидкости (такие как
Н2O)
Если
реакция гетерогенна, то в выражение
константы равновесия не входят
(принимаются за 1) твёрдые вещества и
индивидуальные жидкости (такие как
Н2O)
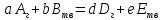

 Константа равновесия зависит только
от температуры и от природы реагирующих
веществ.
Константа равновесия зависит только
от температуры и от природы реагирующих
веществ. -
При изменении условий равновесие нарушается. Через некоторое время в системе опять наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. В общем случае направления смещения равновесия определяются правилом Ле Шателье: Если на систему, находящуюся в равновесии оказать внешне воздействие в виде изменения концентрации, температуры, давления, то равновесие смещается в сторону той реакции, которая способна это воздействие уничтожить.
-
а) При увеличении концентрации исходных веществ, равновесие смещается в сторону продуктов реакции, при уменьшении – в сторону исходных веществ. б) При повышении давления, равновесие смещается в сторону веществ, занимающих меньший объем, при уменьшении – в сторону веществ, занимающих больший объем (только для газов) Na2+3H2=2NH3 (1+3=2) При увелич. влево, при уменьш. Вправо в) При увеличении температуры, равновесие смещается в сторону эндотермических реакций (dH>0), при понижении – в сторону экзотермических (dH<0)
-
а) 1) -> 2) - б) 1) -> 2) <-
-
P T повысить C
-
1) -> 2) <-> 3) <-> 4) ->
-
NO2=0,006 NO=0,024

-