
1 семестр / Таллий 2
.docxОГЛАВЛЕНИЕ
1.ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ 2
2.СТЕПЕНИ ОКИСЛЕНИЯ 2
3.ПОЛОЖЕНИЕ 2
4.ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ ТАЛЛИЯ 4
5.ПОВЕДЕНИЕ ТАЛЛИЯ В КОМПАКТНОМ СОСТОЯНИИ В РАЗЛИЧНЫХ СРЕДАХ 4
-
ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ
Та́ллий — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), шестого периода, атомный номер 81. Обозначается символом Tl (лат. Thallium). Относится к группе тяжёлых металлов. Простое вещество таллий — мягкий металл серебристо-белого цвета с голубоватым оттенком.
-
СТЕПЕНИ ОКИСЛЕНИЯ
В химических соединениях таллий может проявлять степень окисления +1 и +3; возможно образование соединений, в состав которых он входит одновременно в двух степенях окисления. Однако соединения, в которых таллий одновалентен, более устойчивы по сравнению с трехвалентными, поэтому он имеет большое сходство со щелочными металлами, образуя аналогичные соединения, в частности хорошо растворимые в воде гидроксиды, растворимые нитраты, карбонаты; аналогично щелочным металлам таллий (при степени окисления +1) входит в состав квасцов, шенитов, образует полисульфиды, полииодиды. Многие соединения одновалентного таллия, как и щелочных металлов, изоморфны.
В то же время подобно Ag, Cu, Аu, Hg, одновалентный таллий дает малорастворимые в воде галогениды, сульфиды и др.; при этом галогениды таллия подобно галогенидам серебра светочувствительны.
Для окисления одновалентных соединений таллия до трехвалентных используют очень сильные окислители: царскую водку, перманганат калия, хлор, бром и др. Соединения трехвалентного таллия легко восстанавливаются в кислых растворах сероводородом, сульфатами и другими восстановителями,
На воздухе металлический таллий быстро темнеет и покрывается черной пленкой оксида Т120, которая замедляет процесс дальнейшего окисления.
-
ПОЛОЖЕНИЕ
Таллий + находится между Индием и Кобальтом, имея отрицательную разность потенциалов. Стоит слева от водорода, следовательно, имеет хорошую восстановительную способность.
|
In3+, In [Индий] |
In3+ + 3e → In |
-0.343 |
|
Tl+, Tl [Таллий] |
Tl+ + e → Tl |
-0.336 |
|
Co2+, Co [Кобальт] |
Co2+ + e → Co |
-0.227 |
Таллий 3+ находится между Родием 2+ и Родием 3+, имея положительную разность потенциалов.
|
Rh2+, Rh [Родий] |
Rh2+ + 2e → Rh |
+0.600 |
|
Tl3+, Tl [Таллий] |
Tl3+ + 3e → Tl |
+0.741 |
|
Rh3+, Rh [Родий] |
Rh3+ + 3e → Rh |
+0.758 |
-
ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ ТАЛЛИЯ
На основе данных пунктов 1, 2 и 3 можно сказать, что восстановительной способностью обладает только Таллий со степенью окисления +1. Так как чаще всего встречается степень окисления +1, в дальнейшем степень окисления +3 рассматриваться не будет.
-
ПОВЕДЕНИЕ ТАЛЛИЯ В КОМПАКТНОМ СОСТОЯНИИ В РАЗЛИЧНЫХ СРЕДАХ
5.1
В атмосфере сухого воздуха
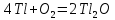
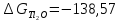
5.2 В воде

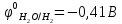
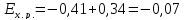
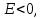 следовательно,
реакция не протекает.
следовательно,
реакция не протекает.
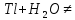
5.3 С неокислительными кислотами
HCl
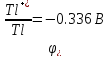
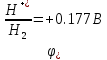
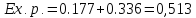
E > 0, следовательно, реакция возможна
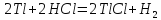
H2SO4
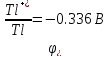
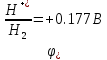
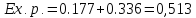
E > 0, следовательно, реакция возможна
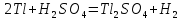
5.4 С окислительными кислотами
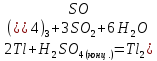
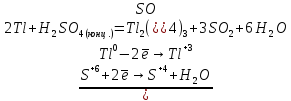
2Tl + 6H2SO4 = Tl2(SO4)3 + 3SO2↑ + 6H2O – горячий концентрат,
Tl + H2SO4 → Tl2O + SO2↑ + H2O – холодный концентрат;
Tl + 8HNO3 = 3TlNO3 + 2NO + 4Н2O разбавленная Tl + 4HNO3 = Tl(N03)2 + 2N02+ 2Н20 концентрированная
