
Rabochaya_tetrad_Khimia
.pdfМИНОБРНАУКИ РОССИИ
––––––––––––
Федеральное государственное бюджетное образовательное учреждение высшего образования «Омский государственный технический университет»
ХИМИЯ
Учебное текстовое электронное издание локального распространения
Омск Издательство ОмГТУ
2016
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Сведения об издании: 1, 2 |
© ОмГТУ, 2016 |
Составители: Н. А. Воронкова, Л. Н. Котова, А. А. Мирошниченко, Е. Г. Шубенкова, Т. В. Скрипко, О. А. Федяева, Е. В. Миронова
Химия : метод. указания к лаб.-практ. работам / Минобрнауки России, ОмГТУ : [сост.: Н. А. Воронкова и др.]. – Омск : Изд-во ОмГТУ, 2016.
Методические указания к лабораторно-практическим работам представлены в виде рабочей тетради по основным разделам лекционного курса дисциплины «Химия», включая следующие темы: основные классы неорганических соединений, строение атома и химическую связь, растворы, энергетику, кинетику и равновесие химических процессов, окислительно-восстановительные и электрохимические реакции. Для студентов всех направлений и форм обучения, изучающих дисциплину «Химия».
Рекомендовано редакционно-издательским советом Омского государственного технического университета
© ОмГТУ, 2016
2
1 электронный оптический диск
Оригинал-макет издания выполнен в Microsoft Office Word 2007 с использованием возможностей Adobe Acrobat X.
Минимальные системные требования:
процессор Intel Pentium 1,3 ГГц и выше;
оперативная память 256 Мб;
свободное место на жестком диске 260 Мб;
операционная система Microsoft Windows XP/Vista/7;
разрешение экрана 1024×576 и выше;
акустическая система не требуется;
дополнительные программные средства Adobe Acrobat Reader 5.0 и выше.
Редактор К. В. Муковоз
Компьютерная верстка О. Г. Белименко
Сводный темплан 2016 г. Подписано к использованию 25.08.16.
Объем #,# Мб.
–––––––––––––––––
Издательство ОмГТУ.
644050, г. Омск, пр. Мира, 11; т. 23-02-12 Эл. почта: info@omgtu.ru
3
ВВЕДЕНИЕ
При изучении химии большое значение имеют лабораторно-практи- ческие занятия. Правильно поставленный эксперимент позволяет проследить закономерности химических процессов, исследовать влияние различных факторов на то или иное явление, запомнить свойства веществ, а также способствует выработке методологии химического мышления и некоторых элементарных приемов работы в химической лаборатории.
Данное издание актуализирует самостоятельную работу студента и мотивирует к проработке лекционного материала. Кроме того, материал, изложенный в издании, поможет студентам в проведении опытов, иллюстрирующих основные представления и законы химической науки.
Лабораторные работы по химии охватывают основные разделы программы курса «Химия», включая следующие темы: строение вещества, химическую связь, энергетику химических процессов, химическую кинетику и равновесие, растворы, окислительно-восстановительные и электрохимические процессы.
Выполнение лабораторных работ открывает путь к непосредственному контакту с процессами, явлениями и лабораторным оборудованием, что важно как в плане закрепления и более глубокого осмысления теоретического материала, так и в плане приобретения практических навыков.
Вопросы, рассмотренные в издании, служат для быстрого предлабораторного контроля знаний студентов по лекционному курсу.
4
ЛАБОРАТОРНО-ПРАКТИЧЕСКАЯ РАБОТА № 1 ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель: изучить кислотно-основные свойства и методы получения типичных представителей основных классов неорганических соединений.
1.Получение и изучение свойств оксида магния
1.Предскажите свойства оксида магния по положению магния в ПСЭ:
а) группа ___________________________________________________, б) подгруппа ________________________________________________,
в) принадлежность к металлам или неметаллам __________________,
г) высшая степень окисления __________________________________,
д) кислотно-основной характер оксида магния ___________________.
2.Запишите уравнения реакций:
а) окисления магния кислородом воздуха:
Mg + O2 → _________________________________________________,
б) образования нерастворимого гидроксида магния при взаимодействии его оксида с водой (слабый электролит):
MgO + H2O → ______________________________________________.
Гипотеза: __________________________________________________
________________________________________________________________
Методика выполнения
Оксид магния получается путем сжигания металлического магния в кислороде воздуха. Подготовьте часовое стекло. Небольшую стружку магния захватите пинцетом и внесите в пламя спиртовки. Когда магний загорится, вынесите его из огня, пламя спиртовки погасите. Наблюдайте процесс горения магния, соблюдая меры предосторожности. Полученному оксиду дайте остыть и поместите его на часовое стекло. С помощью пипетки внесите несколько капель дистиллированной воды и перемешайте стеклянной палочкой. В образовавшуюся суспензию погрузите кусочек красной лакмусовой бумажки. Изменился ли цвет лакмуса?
5
Отметьте наблюдения:
а) интенсивность горения магния ______________________________, б) цвет пламени ____________________________________________,
в) хорошо ли оксид магния растворяется в воде? __________________
г) как изменилась окраска лакмуса в растворе гидроксида магния ____
_______________________________________________________________.
Вывод: _____________________________________________________
________________________________________________________________
2.Получение и изучение свойств оксида углерода (IV)
1.Предскажите свойства оксида углерода (IV) по положению углерода в ПСЭ:
а) группа ___________________________________________________, б) подгруппа ________________________________________________,
в) принадлежность к металлам или неметаллам ___________________,
г) высшая степень окисления __________________________________,
д) кислотно-основной характер оксида углерода (IV) ______________.
2.Запишите уравнения реакций:
а) получения оксида углерода (IV) при взаимодействии хлороводородной (соляной) кислоты с карбонатом кальция
HCl + CaCO3 → _____________________________________________,
б) взаимодействия оксида углерода (IV) с водой
CO2 + H2O → _______________________________________________.
Гипотеза: __________________________________________________
________________________________________________________________
Методика выполнения:
Получение оксида углерода (IV) можно провести в аппарате Киппа или в миниатюрном приборе (рис. 1). Прибор позволяет получать небольшие количества оксида углерода (IV) при погружении трубки с карбонатом кальция в соляную кислоту. По окончании опыта пробку со вставленной в нее нужно трубкой вынуть из конической колбы и поместить в стакан.
6
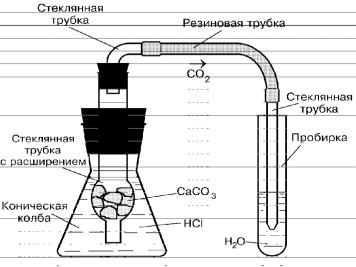
Пропускайте оксид углерода (IV) (как показано на рис. 1) в пробирку с водой 20–30 с. Опустите кусочек синей лакмусовой бумаги в водный раствор оксида углерода (IV).
Рис. 1. Прибор для получения оксида углерода (IV)
Отметьте наблюдения:
а) цвет раствора оксида углерода (IV) в воде_____________________, б) изменился ли цвет лакмуса? Если да, то на какой цвет? __________
Вывод: _____________________________________________________
________________________________________________________________
3.Установление химического характера оксида цинка
1.Предскажите свойства оксида цинка по положению цинка в ПСЭ:
а) группа ___________________________________________________, б) подгруппа _______________________________________________,
в) принадлежность к металлам или неметаллам __________________,
высшая степень окисления ___________________________________,
кислотно-основной характер оксида ____________________________.
2.Запишите уравнения реакций:
а) взаимодействие оксида цинка с соляной кислотой
ZnO + HCl → _______________________________________________,
7
б) взаимодействие оксида цинка с концентрированным раствором гидроксида натрия
ZnO + NaOH → _____________________________________________.
Гипотеза: __________________________________________________
________________________________________________________________
Методика выполнения:
В две пробирки поместите небольшое количество (на кончике микрошпателя) порошка оксида цинка. В одну пробирку внесите 10 капель разбавленной хлороводородной (соляной) кислоты, а в другую – такое же количество концентрированного раствора гидроксида натрия. Наблюдайте растворение оксида цинка. Если растворение в гидроксиде натрия пойдет очень медленно, нагрейте пробирку или увеличьте его количество (опыт проводить в вытяжном шкафу).
Отметьте наблюдения:
а) хорошо ли растворяется оксид цинка в растворе соляной кислоте?
_______________________________________________________________
б) хорошо ли растворяется оксид цинка в концентрированном раство-
ре гидроксида натрия ____________________________________________.
в) где выше скорость растворения оксида цинка: в кислоте или в гид-
роксиде натрия? _________________________________________________
Вывод: _____________________________________________________
________________________________________________________________
4.Получение нерастворимых в воде оснований
1.Какие элементы (металлы или неметаллы) образуют нерастворимые
вводе основания? ________________________________________________
2.Положение этих элементов в ПСЭ:
а) семейство элементов ______________________________________, б) группы __________________________________________________, в) подгруппы _______________________________________________,
г) степени окисления элементов в гидроксидах ___________________.
8
3. Запишите уравнения реакций:
а) получения гидроксида железа (III) при взаимодействии хлорида железа (III) с раствором гидроксида натрия
FeCl3 + NaOH → ____________________________________________,
б) получение гидроксида меди (II) при взаимодействии сульфата меди (II) с раствором гидроксида натрия
CuSO4 + NaOH → ___________________________________________,
в) растворение гидроксидов железа (III) и меди (II) в соляной кислоте
Fe(OH)3 + HCl → ____________________________________________, Cu(OH)3 + HCl → ___________________________________________;
г) получение гидроксида алюминия
AlCl3 + NaOH(изб) → __________________________________________,
д) подтвердить амфотерный характер гидроксида алюминия
Al(OH)3 + HCl → ____________________________________________, Al(OH)3 + NaOH(изб) → _______________________________________.
Гипотеза: __________________________________________________
________________________________________________________________
Методика выполнения:
1) В две пробирки влить по 1 мл раствора солей: хлорида железа (III) и сульфата меди (II). В каждую из пробирок прилить несколько капель разбавленного раствора гидроксида натрия.
Отметьте наблюдения:
а) выпадают ли осадки _______________________________________, б) цвет осадков _____________________________________________.
Вывод: _____________________________________________________
________________________________________________________________
2) К полученным в опыте 4 нерастворимым гидроксидам железа (III) и меди (II) прилить разбавленный раствор соляной кислоты.
9
Отметьте свои наблюдения:
а) растворяются ли осадки ____________________________________, б) цвет растворов ___________________________________________.
3) В пробирку налить 2–3 мл раствора хлорида алюминия и прибавить к нему раствор гидроксида аммония (3–4 мл). Содержимое пробирки разделить на две части. В одну из пробирок при взбалтывании прилить по каплям раствор соляной кислоты до полного растворения осадка. Во вторую пробирку прилить раствор гидроксида натрия также до полного растворения осадка.
Отметьте наблюдения
а) растворился ли осадок в соляной кислоте ______________________
_______________________________________________________________,
б) растворился ли осадок в растворе гидроксида натрия ____________
_______________________________________________________________, в) цвет раствора ____________________________________________.
Вывод: _____________________________________________________
________________________________________________________________
5.Получение и химические свойства кислот
1.Какие элементы (металлы или неметаллы) образуют кислоты
_______________________________________________________________.
2.Основность кислоты – это __________________________________.
3.Какие кислоты образуют кислые соли ________________________.
4.Степени окисления элементов в кислотах _____________________.
5.Запишите уравнения реакций: а) получение уксусной кислоты
(СН3СОО)2Са + H2SO4 → _____________________________________,
б) взаимодействие соляной кислоты с силикатом натрия
HCl + Na2SiO3 → ____________________________________________,
в) взаимодействие серной кислоты с оксидом меди (II)
H2SO4 + CuO → _____________________________________________.
10
