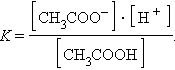- •1.Атомно-молекулярная теория Ломоносова.
- •V2 и Vэ(2) – объем и эквивалентный объем 2-го вещества.
- •2.Стехиометрические законы химии
- •3.Скорость химических реакций
- •5.Химическое равновесие
- •104, То реакция необратима
- •6.Тепловые эффекты химических реакций. Энтальпия. Закон Гесса.
- •7.Энтропия. Свободная энергия Гиббса. Термодинамический критерий направленности химического процесса.
- •11.Растворение как физико-химический процесс. Химическая теория растворов Менделеева.
- •9.Концентрация растворов. Растворимость, насыщенные и ненасыщенные растворы.
- •10.Идеальные растворы
- •11.Электролиты и неэлектролиты. Электролитическая диссоциация
- •13.Ионное произведение воды
- •14.Кислотно-основные свойства веществ.Кислоты, основания и соли с точки зрения теории элд
- •17.Электронная теория окисления-восстановления
- •18.Электродные потенциалы.Гальванический элемент
- •17. Многоэлектонные атомы и периодический закон.
- •21.Квантовые числа. Принцип Паули, принцип наименьшей энернии, правило Гунда
- •24.Метод молекулярных орбиталей
- •25.Ионная связь как одна из составляющих реальной химической связи
13.Ионное произведение воды
Чистая
вода очень плохо проводит электрический
ток, но все же обладает измеримой
электрической проводимостью, которая
объясняется небольшой самодиссоциацией
воды на катионы водорода и гидроксид-анионы
Н2О=Н+
+ ОН-.
Константа ионизации воды
 .
Так как вода – очень слабый электролит,
то концентрация недиссоциированных
молекул может быть принята равной общему
количеству молей в 1л воды [H2O]=1000/18=55,56
моль/л. Тогда k[H2O]=[Н+]
[ОН-]
или [Н+]
[ОН-]=1,8∙10-16
∙ 55,56=10-14.
Величина [Н+]
[ОН-]=10-14
называется
ионным произведением воды.
.
Так как вода – очень слабый электролит,
то концентрация недиссоциированных
молекул может быть принята равной общему
количеству молей в 1л воды [H2O]=1000/18=55,56
моль/л. Тогда k[H2O]=[Н+]
[ОН-]
или [Н+]
[ОН-]=1,8∙10-16
∙ 55,56=10-14.
Величина [Н+]
[ОН-]=10-14
называется
ионным произведением воды.
Важность этой величины (ионного произведения воды) состоит в том, что она сохраняет свою величину (является однозначной) для водных растворов любых веществ.
При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид-ионов, поскольку при данной температуре (22°С) ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная картина. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [Н+]>10-7, в щелочных [Н+]<10-7, в нейтральных [Н+]=10-7.
Концентрация водородных ионов и водородный показатель
водородный
показатель рН – это отрицательный
десятичный логарифм концентрации
водородных ионов.
 .
Тогда для нейтральной среды
.
Тогда для нейтральной среды
 ,
для кислых растворов рН<7, для щелочных
рН>7.
,
для кислых растворов рН<7, для щелочных
рН>7.
Понятие об индикаторах
Для определения рН используют кислотно-щелочные индикаторы, которые представляют собой слабые органические кислоты и основания, имеющие различную окраску в диссоциированной и молекулярной формах
14.Кислотно-основные свойства веществ.Кислоты, основания и соли с точки зрения теории элд
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
|
|
|
|
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
|
|
|
|
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
|
|
|
Рисунок 6.7 |
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Перемножив константы сопряженных кислот и оснований, получим
|
|
|
|
Заменив
активности ![]() и
и ![]() на
равновесные концентрации, получим
на
равновесные концентрации, получим
|
|
|
|
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
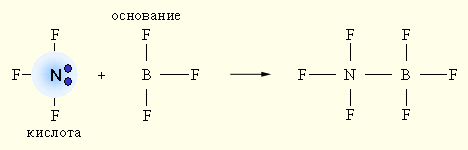
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары: NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
|
|
|
|
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
|
|
|
|
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
|
|
|
|
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
|
|
|
|
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
|
|
|
|
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
|
|
K1 : K2 : K3 = 1 : 10–5 : 10–10. |
|
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
|
|
|
|
и для этой реакции
|
|
|
|
Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
|
|
|
|
или
|
|
|
|
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (NH3∙H2O и NH4Cl):
|
|
|
|
или
|
|
|
Амфолиты
Амфотерные электролиты (амфолиты) – это вещества, которые одновременно могут проявлять и кислотные, и основные свойства.
К амфотерным относятся две группы веществ:
1. вещества, у которых и кислотные, и основные свойства определяются одной и той же функциональной группой – ОН. К таким веществам можно отнести Zn(OH)2, Al(OH)3:


2. вещества, у которых кислотные и основные свойства определяются наличием разных функциональных групп. К таким вещества относятся аминокислоты типа NH2RCOOH. В водных растворах жирные аминокислоты полностью или частично переходят в форму: NH3+RCOO- - это ион, несущий одновременно и положительный и отрицательный заряд.
15.Обменные реакции между ионами
Реакции в растворах электролитов протекают между ионами, на которые диссоциируют растворенные вещества. При этом не изменяются степени окисления элементов.
Не все ионные обменные реакции необратимы. Ионные обменные реакции идут до конца в том случае, если в результате реакции образуется:
-нерастворимое соединение, выпадающее в осадок;
-газообразное вещество;
-слабый электролит (вода, слабое основание или слабая кислота).
-- Уравнения реакций такого типа более правильно писать не в молекулярной, а в ионно-молекулярной форме. В этих уравнениях указывают ионы, на которые распадаются молекулы сильных электролитов. Малорастворимые вещества, выделяющиеся из раствора в виде осадка, газообразные соединения и слабые электролиты в этих уравнениях пишут в молекулярном виде. Кроме того, существует краткая ионная форма записи уравнения реакции, отображающая сущность реакции, протекающей в растворе электролита.
Произведение растворимости
Абсолютно нерастворимых веществ нет. Большинство твердых веществ обладают ограниченной растворимостью. В насыщенных растворах электролитов малорастворимых веществ в состоянии динамического равновесия находятся осадок и насыщенный раствор электролита. Например, в насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие: BaSO4(т)⇄ Ba2+(р)+SO(р).
Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия: Kp= [Ba2+] [SO].
Эта величина называется произведением растворимости малорастворимого вещества (ПР). Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере ПР(BaSO4) = [Ba2+] [SO].
Произведение растворимости характеризует растворимость малорастворимого вещества при данной температуре: чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора.
Реакции нейтрализации
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в резуль–тате которых образуются соль и вода.
Рассмотрим различные типы реакций нейтрализации.
1. Нейтрализация сильного основания сильной кис–лотой:
КОН + HNO3 – KNO3 + Н2O.
Молекулярно-ионное уравнение такой реакции Н+ + OН- > Н2O
и отрицательное значение энергии Гиббса ?G° пока–зывают, что равновесие практически смещено в сто–рону образования воды.
Общим случаем реакции нейтрализации является взаимодействие кислот и оснований, различающихся по силе (степени диссоциации). Эти реакции не дохо–дят до конца вследствие протекания обратной реакции гидролиза соли.
2. Нейтрализация слабой кислоты сильным основа–нием:
![]()
или в молекулярно-ионном виде:
![]()
В данном случае реакция нейтрализации обратима. Обратима и реакция нейтрализации слабого основа–ния сильной кислотой:
![]()
или в молекулярно-ионном виде:
![]()
а также – слабого основания слабой кисло–той:
![]()
или в молекулярно-ионном виде:
![]()
В данных системах равновесие сильно смещено вправо, так как вода значительно более слабый элек–тролит, чем синильная кислота, аммиак и уксусная ки–слота
16.Гидролиз солей
Гидролиз – это ионно-обменная реакция между водой и растворенным в ней веществом. Здесь будем рассматривать гидролиз солей.
Каждую соль можно представить как продукт нейтрализации кислоты основанием, т. е. каждая соль образована какой-то кислотой и каким-то основанием.
Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой; слабым основанием и сильной кислотой; слабой кислотой и слабым основанием.
Гидролиз – это обратимый равновесный процесс. В реакциях гидролиза знак равенства заменяют знаком обратимости - двумя противоположно направленными стрелками.
Соли, образованные многоосновными кислотами или многоатомными основаниями гидролизуются ступенчато, образуя на первой ступени кислые или основные соли. Вторая ступень идет в гораздо меньшей степени, чем первая.
1. Гидролиз соли, образованной сильным основанием и слабой кислотой (I ступень):
Na2CO3+ HOH⇄NaHCO3+ NaOH;
2Na++ C+ HOH⇄HCO3-+ 2Na++ OH-;
C+HOH⇄ HCO3- +OH-.
В ходе реакции образуется кислая соль. Краткая ионная форма записи показывает, что в реакции принимает участие анион, поэтому говорят, что в этом случае происходит гидролиз по аниону. В результате гидролиза образуется избыток гидроксид-ионов, поэтому раствор карбоната натрия имеет щелочную реакцию со значением рН > 7.
2. Гидролиз соли, образованной слабым основанием и сильной кислотой (I ступень):
ZnCL2+HOH⇄ZnOHCl+HCl;
Zn2+ + 2Cl-+HOH⇄ZnOH++ 2Cl- +H+;
Zn2++HOH⇄ZnOH+.
В этом случае происходит гидролиз по катиону. В результате гидролиза образуется избыток ионов водорода, поэтому раствор соли имеет кислую реакцию со значением рН < 7.
3.Гидролиз соли, образованной слабым основанием и слабой кислотой:
CH3COONH4+ HOH⇄CH3COOH + NH4OH;
CH3COO-+ NH4++ HOH⇄CH3COOH + NH4OH.
В этом случае гидролиз происходит как по аниону, так и по катиону. Реакция раствора практически нейтральна и значение рН близко к 7.
Количественной характеристикой протекания реакции гидролиза является константа равновесия (Кp). Для реакции гидролиза карбоната натрия по первой ступени можно написать выражение константы равновесия
.
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая K·[H2O] = ., получим выражение для константы гидролиза:
Степень гидролиза, т. е отношение числа молекул, подвергшихся гидролизу, к общему числу молекул, как правило, невелика. Причиной этого является то, что вода – очень слабый электролит, поэтому равновесие реакции гидролиза смещено в сторону исходных веществ.
В разбавленных растворах соли гидролизуются сильнее. При повышении температуры степень гидролиза увеличивается.
Для подавления гидролиза нужно использовать концентрированные растворы при низких температурах, а также добавлять к раствору один из продуктов гидролиза: кислоту или щелочь.
Соли, образованные слабой многоосновной кислотой и слабым многоатомным основанием, гидролизуются необратимо, например, Al2S3,Cr2S3:
Al2S3+ 6HOH = 2Al(OH)3↓ + 3H2S↑.
Эти и подобные им соли не существуют в растворах.