
Лабораторные работы по теме Молекулярная физика. Номера 67, 70, 71, 78
.pdf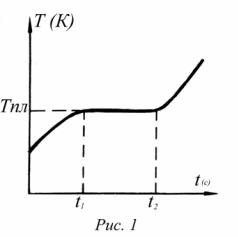
12.Как рассчитать изменение энтропии? Выведите формулу Клаузиуса. Чему равно изменение энтропии в процессе плавления?
13.Дайте формулировку второго закона термодинамики.
14.Как определяется температура металла в данной работе? 15.Расскажите об устройстве, назначении термопары и принципе ее
работы.
16.Расскажите порядок выполнения работы.
ОПИСАНИЕ МЕТОДА ВЫЧИСЛЕНИЯ И ИЗМЕНЕНИЯ ЭНТРОПИИ
В термодинамике под фазой понимают совокупность частей термодинамической системы, одинаковых по всем физическим и химическим свойствам.
Различными фазами, в частности, являются агрегатные состояния какого-либо вещества: газообразное, жидкое, твердое. Так, различные фазы воды - это пар, жидкая вода и лед, причем каждая кристаллическая форма льда образует особую фазу.
Необходимо подчеркнуть, что, говоря о твердом состоянии как об особой фазе вещества, имеют в виду лишь твердое кристаллическое состояние, характеризующееся правильным расположением атомов, образующих пространственную решетку, в этом проявляется так называемый дальний порядок. Аморфные тела не имеют кристаллической решетки, их относят к переохлажденным жидкостям.
Кроме дальнего порядка, у атомов твердого тела имеется ближний порядок, проявляющийся в том, что у каждого атома в зависимости от его сорта и вида кристаллической решетки всегда имеется определенное число ближайших соседних атомов. Таким образом, в отличие от жидкостей, молекулам которых присущ ближний порядок, у атомов твердого тела имеются ближний и дальний порядки. Обычно кристаллические твердые тела существуют в виде поликристаллов, таковы, например, все металлы.
Процессы, при которых вещество переходит из одной фазы в другую, называются фазовыми переходами.
Различают фазовый переход первого и второго рода. Фазовые превращения, сопровождающиеся поглощением или выделением теплоты, называют фазовыми переходами первого рода. Такой переход всегда изотермичен, при чем температура перехода зависит от давления. Типичными фазовыми переходами первого рода являются испарение жидкости, плавление твердого тела и обратные им процессы.
Фазовыми переходами второго рода называют переходы, не связанные с поглощением или выделением теплоты. Примером такого перехода может служить превращение ферромагнетика в парамагнетик в точке Кюри.
Вданной работе изучается фазовый переход первого рода на примере процессов плавления и кристаллизации.
Если кристаллическому телу сообщить тепло, то вначале температура тела будет расти за счет увеличения колебательной энергии частиц. При этом амплитуда колебаний увеличивается и объем тела растет. Происходит тепловое расширение кристаллов.
При определенной температуре амплитуды колеблющихся частиц становятся соизмеримыми с расстояниями между частицами в кристаллической решетке. Сообщаемое телу тепло идет на разрушение кристаллической решетки, нарушается дальний порядок расположения частиц, и вещество переходит в жидкое состояние, характеризующееся ближним порядком. Свойства вещества меняются скачкообразно.
Процесс перехода вещества из твердого состояния в жидкое называется плавлением. Процесс плавления происходит при постоянной для данного давления температуре и соответствует одновременному существованию твердой и жидкой фазы. Количество тепла, необходимое для превращения единицы массы твердого тела в жидкость при температуре плавления, называется удельной теплотой плавления.
Вотличие от кристаллов при нагревании твердых аморфных тел не наблюдается скачкообразного изменения свойств. В определенном интервале температур происходят постепенное размягчение тел, то есть по существу аморфные твердые тела и жидкости различаются лишь степенью подвижности частиц. Таким образом, аморфные тела не имеют определенной температуры плавления.
Когда процесс плавления кристаллического тела заканчивается и все вещество перейдет в жидкое состояние, температура начнет снова повышаться. Ход кривой нагревания твердого тела в зависимости от времени показан на рис.1.
21 |
22 |
Процесс, обратный процессу плавления, т.е. процесс перехода вещества из жидкого в твердое состояние, называется кристаллизацией. Кристаллизация протекает следующим образом: при охлаждении жидкости до температуры кристаллизации (равной температуре плавления) начинается рост кристаллов около случайно находящихся в жидкости твердых частиц, пузырьков газа, местных сгущений, служащих центрами кристаллизации, и образуется твердая фаза. При этом упорядочивается движение частиц жидкости и увеличивается время их колебаний вокруг определенных положений равновесия.
Постепенно переходы от одного положения равновесия к другому прекращаются и ближний порядок расположения частиц переходит в дальний. Процесс кристаллизации происходит при постоянной температуре, равной температуре плавления. При образовании кристаллической решетки выделяется теплота, при этом удельная теплота кристаллизации равна удельной теплоте плавления.
Поскольку фазовый переход 1-го рода связан с поглощением или выделением некоторого количества теплоты, то в точке перехода происходит скачкообразное изменение величин, характеризующих тепловое состояние тела.
Каждое состояние системы можно рассматривать как с макроскопической точки зрения так и с микроскопической. С макроскопической точки зрения состояние тела определяется совокупностью макропараметров: объем, температура, давление. При этом макропараметры получаются в результате усреднения соответствующих величин, характеризующих отдельные молекулы. Например, абсолютная температура определяется средним значением кинетической энергии поступательного движения молекулы, а давление – средней силой взаимодействия молекул со стенками сосуда. В результате теплового движения скорости и координаты отдельных молекул со временем изменяется, но среднее значение скорости молекул при достижении системой равновесия остается постоянным. Значит, одно и то же макросостояние (одни и те же р, V, Т) можно реализовать различными способами или, говорят, различными микросостояниями.
Вообще, любое макроскопическое состояние системы с определенными значениями параметров представляет собой непрерывную смену близких микросостояний, отличающихся друг от друга распределением одних и тех же молекул по координатам и скоростям. Количество таких непрерывно сменяющих друг друга микросостояний, реализующих данное макросостояние, прямо связано со степенью беспорядочности этого макросостояния.
23
Распределение молекул в пространстве также, как и распределение их скоростей – явления случайные. Но при заданных условиях (р, V, T) то или иное распределение характеризуется определенной математической вероятностью. В статистической физике для определения вероятности реализации определенного состояния системы пользуются понятием статистического веса или термодинамической вероятности W . Термодинамической вероятностью называют число микрораспределений молекул по координатам и скоростям, соответствующих данному макросостоянию.
Термодинамическая вероятность W характеризует степень внутреннего беспорядка в системе. Состояние, полностью упорядоченное, осуществляется единственным образом и имеет минимальное значение W = 1. Равновесное состояние системы является наиболее вероятным и потому термодинамическая вероятность равновесного состояния максимальна.
Всякий естественный процесс развивается так, что замкнутая система переходит из менее вероятного состояния в более вероятное, так, что степень беспорядка в ней увеличивается. Температуры тел сами собой выравниваются, газы перемешиваются, устанавливается равновесие. С помощью термодинамической вероятности можно характеризовать направление процессов. В замкнутой системе возможны лишь такие процессы, при которых степень беспорядка не уменьшается.
Другой величиной, которая также указывает на направление процессов, является энтропия S (в переводе на русский язык энтропия - способность к превращению). Количественную связь между энтропией и термодинамической вероятностью установил в 1875 г. Больцман.
S = k lnW ,
где k - постоянная Больцмана.
Энтропия S также как и термодинамическая вероятность характеризует степень беспорядка в системе и является функцией состояния системы, т.е. ее изменение ∆S = S2 − S1 не зависит от пути перехода из со-
стояния I в состояние II.
Найдем изменение энтропии системы при переходе ее из одного состояния в другое.
Пусть идеальный газ находится при постоянной температуре и расширяется в пустоту. Тогда распределение по скоростям, согласно закону Максвелла, не меняется и, как показывает точный статистический расчет, число распределений N молекул по объему
W ≈V N .
Следовательно
S = k lnW = kN lnV +const .
24

При расширении газа в пустоту энтропия системы изменится
∆S = S |
2 |
− S = kN ln |
V2 |
= |
m |
R ln |
V2 |
. |
(1) |
|
|
|
|||||||
|
1 |
V1 |
|
M |
|
V1 |
|
||
|
|
|
|
|
|
||||
Так как V2 >V1 , то ∆S > 0 , т.е. энтропия увеличилась. ∆S - есть ко-
личественная мера возрастания беспорядка в системе, увеличение степени хаотичности в ней.
Расширение газа в пустоту – процесс необратимый, и энтропия при протекании такого процесса возросла.
Такого же изменения объема можно было добиться в результате изотермического процесса, но при этом системе надо сообщить количество тепла
Q = A = |
m |
RT ln |
V2 |
. |
(2) |
M |
|
||||
|
|
V |
|
||
|
|
1 |
|
|
|
Сравнивая (1) и (2), находим
∆S = ∆QTобр .
Этот результат Клаузиус записал в виде dS = dQTобр .
Т.е. возрастание энтропии системы численно равно количеству тепла, сообщенного телу в элементарном квазистатическом (обратимом) процессе, деленному на абсолютную температуру тела.
Подчеркнем, что, вычисляя изменение энтропии при любом реальном переходе из одного состояния в другое, мы должны "мысленно" совершать переход обратимо, и полученный результат будет верен, каким бы ни был реальный переход. Это возможно сделать потому, что энтропия есть функция состояния и не зависит от пути перехода в это состояние.
Понятие энтропии позволяет сформулировать закон, указывающий направление процессов в замкнутой системе
Второй закон термодинамики. Энтропия замкнутой системы не
может убывать
∆S ≥ 0 .
Для фазовых переходов первого рода изменение энтропии можно рассчитать по формуле Клаузиуса:
∆S = ± ∆QTобр ,
где ∆Q = λm , λ - удельная теплота плавления, m - масса тела;
25
T - температура фазового перехода по шкале Кельвина.
Знак плюс соответствует плавлению, которое сопровождается поглощением телом теплоты, знак минус - кристаллизации, которая сопровождается выделением теплоты.
Таким образом, при плавлении твердого тела изменение его энтропии положительно. Это показывает, что энтропия жидкости больше, чем твердого тела: ∆S > 0 . Сообщение телу тепла приводит к усилению теплового движения его атомов, т.е. к увеличению хаотичности движения, а тем самым – к увеличению статистического веса.
Для определения температуры плавления и кристаллизации строят кривые нагревания и охлаждения металла. Для построения кривых определяют температуру металла через равные промежутки времени с помощью термопары. Термопара представляет собой два проводника из разных металлов или сплавов (в данной работе хромель-алюминь), спаянных концами.
Принцип работы термопары состоит в следующем. Из-за различной по величине работы выхода электронов Aвых в месте спая
металлов I и II возникает контактная разность
потенциалов. Если AвыхI > AвыхII , то (рис.2) ме-
талл I зарядится отрицательно, а металл II - положительно, что соответствует появлению контактной разности потенциалов ϕ1 −ϕ2 ,
которая зависит от разности работ выхода в месте контакта. Работа выхода зависит от
температуры. Если температуры спаев I и II одинаковы, то тока в замкнутой цепи, состоящей из двух металлов, не будет. Если спаи имеют разную температуру, то в замкнутой цепи возникает термоэлектродвижущая сила ε, прямо пропорциональная разности температур спаев ε =α∆T , где α - коэффициент пропорциональности, зависящий от свойств данной пары металлов и численно равный термоэлектродвижущей силе, возникающей в данной термопаре при разности температур спаев, равной единице.
Для выполнения работы собирается установка, состоящая из тигля с оловом, который помещается на электроплитке. Для изменения температуры спай термопары опускают в олово, а свободные концы проводников присоединяют к зажимам потенциометра, так что они имеют комнатную температуру.
Термоэлектродвижущую силу ε измеряют с помощью потенциометра, в основе работы которого лежит метод компенсации ЭДС.
26
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
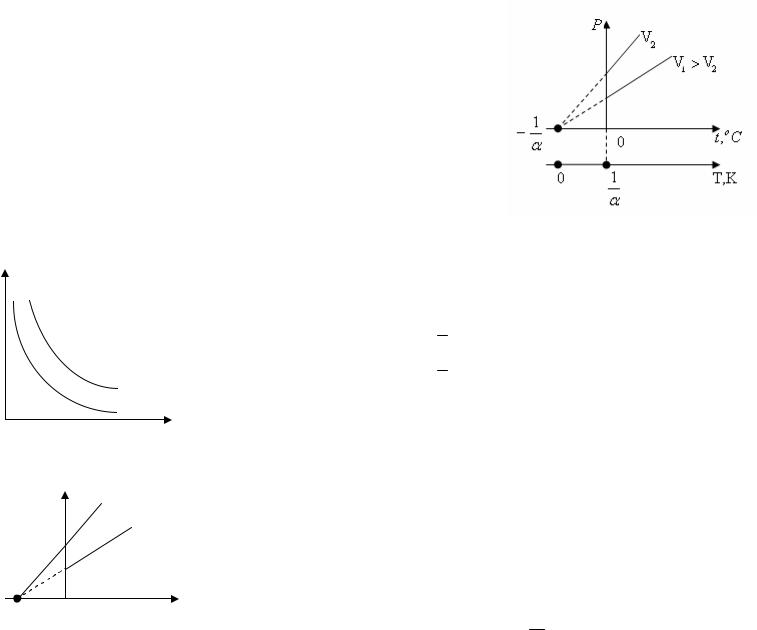
1.Производят подготовку потенциометра к измерениям, регулируя его рабочий ток. Для этого переключатель II (рис.3) ставят в положение “К” (контроль) и ручной “Регулировка тока” устанавливают стрелку гальванометра Г на нуль.
2.Включают электроплитку.
3.Присоединяют концы термо-
пары к зажимам А и Б потенциометра и производят пробное измерение термоэлектродвижущей силы. Переместив переключатель II в положение “И” (измерение), ручной "Р" устанавливают стрелку гальванометра на нуль. Значение термоэлектродвижущей силы в милливольтах указывается стрелкой на шкале III. Если стрелка гальванометра уйдет за пределы шкалы, надо поменять местами концы термопары, присоединенные
кзажимам.
4.Через 2-3 минуты после включения плитки пускают секундомер и производят измерения термоэлектродвижущей силы через каждые 30 секунд.
5.После получения ряда одинаковых значений термоэлектродвижущей силы, что соответствует процессу плавления, продолжают измерения в течение еще 2-3 минут после окончания процесса плавления.
6.Результаты измерений записывают в таблицу № 1.
Таблица № 1
|
Плавление |
|
|
Кристаллизация |
|
|||
Время, |
Термо |
Разность |
Темпера- |
Время, |
|
Термо |
Разность |
Темпера- |
|
ЭДС |
темпера- |
тура |
|
|
ЭДС |
темпера- |
тура |
|
|
тур |
|
|
|
|
тур |
|
(секунды) |
(мВ) |
(оС) |
(оС) |
(секунды) |
|
(мВ) |
(оС) |
(оС) |
50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7.Выключают плитку и продолжают измерение термоэлектродвижущей силы в процессе охлаждения.
8.Пользуясь графиком градуировки термопары, приложенным к
работе, находят разности температур ∆Т между температурой спая, находящегося в металле, и температурой зажимов потенциометра, равной комнатной температуре. Вычисляют температуру металла по формуле T =Tкомн. + ∆T предварительно определив температуру Tкомн. .
Полученные результаты заносят в таблицу № 1.
9. Строят на миллиметровой бумаге графики зависимости температуры металла от времени при нагревании и охлаждении.
10.По графику определяют температуру плавления и кристаллизации металла и по формуле вычисляют изменение энтропии
∆S = ± λTm ,
где знак "плюс" для плавления, знак "минус" для кристаллизации
27 |
28 |
ПРИЛОЖЕНИЕ № 1
Основные определения и законы молекулярно-кинетической теории идеальных газов
Идеальный газ - это газ, удовлетворяющий следующим условиям:
1)собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2)между молекулами газа отсутствуют силы взаимодействия;
3)столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Состояние данной массы газа m характеризуют параметры: давление p, объём V, температура T. Связь между термодинамической температурой T и температурой по стоградусной шкале Цельсия имеет вид
T = t + 273,15.
Закон Бойля-Мариотта |
P |
|
|
|
|
Для данной массы газа при по- |
|
|
|
||
стоянной температуре |
произведе- |
|
|
|
|
ние давления газа на его объём есть |
|
|
|
|
|
величина постоянная |
|
|
|
|
|
pV = const , |
|
|
|
|
|
при |
|
|
|
|
|
T , m = const . |
|
|
|
T2 |
> T1 |
Процесс, протекающий при по- |
|
|
|||
стоянной температуре, |
называется |
|
|
T1 |
|
изотермическим. |
|
|
|
|
|
|
|
|
|
|
V |
Закон Гей-Люссака |
|
|
|
|
|
Объём данной массы газа при |
|
|
|
|
|
постоянном давлении |
изменяется |
|
|
V |
|
линейно с температурой: |
|
|
P2 |
|
|
V =V0 (1+αt) , |
|
|
|
||
|
|
P1 |
> P2 |
||
при |
|
|
|
||
p, m = const . |
|
|
|
|
|
Процесс, протекающий при по- |
|
|
|
|
|
стоянном давлении, |
называется |
|
|
|
t,0C |
изобарным. |
|
− |
1 |
|
|
|
|
|
|
||
|
|
α |
|
||
|
|
|
|
||
|
|
|
|
|
29 |
Закон Шарля
Давление данной массы газа при постоянном объёме изменяется линейно с температурой
p = p0 (1+αt) ,
при
V , m = const .
Процесс, протекающий при постоянном объёме, называется изохорным.
В этих уравнениях t- температура по шкале Цельсия, Vo, po - объём и давление при 0 ºC, α = 1/273,15 K-¹.
Вводя термодинамическую температуру, законам Гей-Люссака и Шарля можно придать вид
p = p0αТ .
Или
VT = const , при p, m = const ;
Tp = const , при V , m = const .
Закон Авогадро. Один моль любых газов при одинаковой температуре и давлении занимают одинаковые объёмы. При нормальных усло-
виях (ро = 1,013·105 Па; Tо = 273,15 K) этот объём равен 22,41·10–3
м3/моль.
В одном моле различных веществ содержится одно и тоже число молекул, называемое постоянной Авогадро: NA = 6,022·1023 моль-1.
Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений входящих в неё газов
p = p1 + p2 +...+ pn ,
где p1 , p2 ,..., pn - парциальные давления, т.е. давления, которые оказы-
вали бы газы смеси, если бы они одни занимали объём, равный объёму смеси при той же температуре.
Уравнение состояния идеального газа или уравнение Менделеева-
Клапейрона
pV = Mm RT ,
30
где: R = 8,31 |
Дж |
|
- универсальная газовая постоянная, |
|
моль |
К |
|||
|
|
М - молярная масса, ν = Mm - число молей.
Часто пользуются несколько иной формой уравнения состояния идеального газа, введя постоянную Больцмана
k = |
R |
=1,38 10 |
−23 Дж . |
||
NA |
|
К |
|
||
Умножим и разделим правую часть уравнения на число Авогадро
pV = |
m |
N |
|
|
R |
T =ν N |
|
kT = NkT , |
|
M |
|
|
|
|
|
||||
|
|
A NA |
A |
|
|||||
|
|
p = |
N |
kT = nkT , |
|||||
|
|
|
|||||||
|
|
|
|
|
V |
|
|
||
где n = VN - концентрация молекул.
Уравнение состояния идеального газа p = nkT .
Основное уравнение молекулярно-кинетической теории идеального газа
p = 13 nm0υср2 .кв ,
где mо - масса одной молекулы идеального газа, υср.кв - средняя квадратичная скорость молекул
υср.кв = |
3kT |
= |
3RT |
. |
|
|
|||
|
m0 |
M |
||
Средняя кинетическая энергия поступательного движения од-
ной молекулы идеального газа
εср.кин. = 32 kT .
Из этого уравнения следует, что при Т = 0 К, согласно классической молекулярно-кинетической теории, прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа.
ПРИЛОЖЕНИЕ № 2
Основы термодинамики
§1. Первый закон термодинамики
Первый закон термодинамики. Теплота d´Q, сообщаемая системе,
расходуется на увеличение её внутренней энергии dU и на совершение ею работы d´A против внешних сил
d´Q = dU+ d´A
Внутренняя энергия U - это энергия хаотического движения микрочастиц системы (молекул, атомов и др.) и энергия взаимодействия этих частиц.
Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенным значением внутренней энергии. Для идеального газа внутренняя энергияэто суммарная кинетическая энергия движения его молекул.
Средняя кинетическая энергия одной молекулы
< ε >= 2i kT ,
где i – число степеней свободы молекулы
i = iпост+ iвращ+2i колеб.
Одноатомная молекула имеет три степени свободы (i = 3); двухатомная молекула имеет пять степеней свободы (i = 5), трёхатомная и многоатомная молекулы имеют шесть степеней свободы (i =6).
k = 1,38·10–23 Дж/К – постоянная Больцмана.
Внутренняя энергия одного моля идеального газа
Um =< ε > NA = 2i kTNA = 2i RT ,
где R = kNA = 8,31 Дж/моль·К – универсальная газовая постоянная.
Внутренняя энергия произвольной массы идеального газа
U = Mm 2i RT .
Работа газа при изменении его объёма
A12 = ∫2 pdV
1
31 |
32 |
§2. Теплоёмкость
Удельная теплоёмкость вещества – величина равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К
c = |
dQ |
, |
[c] = |
Дж |
. |
mdT |
|
||||
|
|
|
кг К |
||
Молярная теплоёмкость - величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К
С = |
dQ |
= |
dQ , |
[С] = |
Дж . |
|||
|
|
|
|
моль K |
|
|||
νdT |
m |
dT |
||||||
|
|
|
M |
|
|
|
||
Удельная теплоёмкость с связана с молярной С соотношением
C = cM .
§3. Применение первого закона термодинамики к изопроцессам
1) Изохорический процесс
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
T = const |
|
при |
V , m = const , |
|
|
|
|
||||||||||
|
|
P |
|
|
|
|
||||||||||||
|
|
|
|
′ |
|
|
|
|
|
|
′ |
|
|
|
|
|||
|
′ |
d Q |
= dU +d A , |
|
2 |
|
T2 |
|
||||||||||
|
|
|
|
|||||||||||||||
|
|
|
= 0 , т.к. V = const , |
|
|
|
|
|
||||||||||
d A = pdV |
|
|
|
dQ |
|
|||||||||||||
|
|
|
|
|
|
′ |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
d Q = dU . |
|
|
|
|
|
|||||||||
Вся теплота идёт на приращение |
|
|
|
|
|
|||||||||||||
внутренней энергии |
|
|
|
|
|
P1 |
|
T1 |
|
|||||||||
|
|
|
|
|
|
|
||||||||||||
Молярная теплоёмкость при по- |
|
|
V |
V |
||||||||||||||
стоянном объёме |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
′ |
|
dU |
|
|
|
|
|
|
|||
|
|
C = |
|
d Q |
= |
. |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
V |
|
m |
|
dT |
|
|
m |
dT |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
M |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
||||
Тогда приращение внутренней энергии dU = Mm CV dT .
С другой стороны
dU = Mm 2i RdT .
Следовательно, молярная теплоёмкость при постоянном объёме
CV = 2i R .
33
2) Изобарный процесс |
|
|
|
|
|
|
|
|
|||||||||||||
V |
|
= const |
при p, m = const , |
|
|
|
|
|
|
|
|
||||||||||
|
T |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
′ |
|
|
′ |
CV dT + PdV . |
|
|
|
|
|
|
|
|
|||||||||
d Q |
= dU + d A = |
M |
|
|
|
|
|
|
|
|
|||||||||||
Работа при изобарном процессе |
|
|
|
|
|
||||||||||||||||
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = ∫ pdV = p(V2 −V1 ) . |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молярная теплоёмкость при по- |
|
|
|
|
|
||||||||||||||||
стоянном давлении |
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C dT |
|
|
|
|
|||
|
|
|
|
dQ |
|
|
|
′ |
|
|
|
pdV = C + R . |
|||||||||
|
|
|
C = |
|
|
|
M |
|
+ |
||||||||||||
|
|
|
= dU +d A = |
V |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
m |
|
|
|
|
|
m |
|
|
|
|
m |
|
|
m |
|
V |
|
|
|
|
|
dT |
|
|
dT |
|
dT |
|
dT |
||||||||||
|
|
|
|
|
|
M |
|
|
|||||||||||||
|
|
|
|
M |
|
|
|
|
M |
|
|
|
M |
||||||||
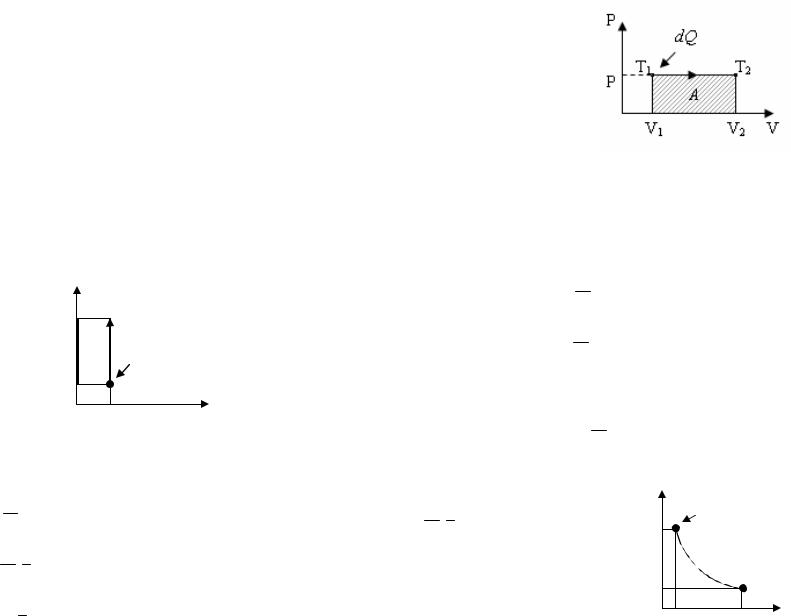
Первое слагаемое правой части даёт СV , а второе равно R - газовой постоянной. В самом деле, из уравнения
pV = Mm RT
(учитывая, что p = const) следует, что
pdV = Mm RdT .
Связь между молярными и теплоёмкостями (уравнения Майера)
Cp = CV + R .
Связь между удельными теплоёмкостями
cp = cV + MR .
3) Изотермический процесс pV = const при m,T = const ,
d′Q = dU +d′A
dU = Mm 2i RdT = 0 , т.к. T = const .
Вся теплота, сообщённая системе в ходе изотермического процесса, идёт на совершение системой работы над внешними телами.
d′Q = d′A = pdV ,
учтем, что
34
P
dQ
P1
P2 A
V1 V2 V

pV = Mm RT ,
тогда
V2 |
V2 |
m dV |
|
m |
|
V |
|||
A12 = ∫ pdV = ∫ |
|
RT |
|
= |
|
RT ln |
2 |
. |
|
M |
V |
M |
V |
||||||
V1 |
V1 |
|
|
|
|
|
|
1 |
|
В ходе изотермического процесса внутренняя энергия системы не изменяется U = const .
4) Адиабатический процесс – это процесс, протекающий без теп-
лообмена с окружающей средой |
|
|
|
|||||||||
|
|
|
′ |
|
|
= 0 , |
|
|
|
|
||
|
d Q |
|
P |
|
|
|||||||
следовательно |
|
|
|
|
|
|
|
|
||||
|
|
′ |
|
= 0 . |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||
dU +d A |
|
|
|
|||||||||
Работа в ходе адиабатиче- |
|
|
|
|||||||||
ского расширения осуществля- |
|
|
|
|||||||||
ется за счет убыли внутренней |
T1 |
адиабата |
|
|||||||||
энергии |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
m |
|
P1 |
|
|
|
dA = −dU = − |
CV dT , |
|
изотерма |
|
||||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
T2 |
|
|
m |
|
|
|
A |
|
|
A |
= − |
∫ |
|
|
|
C dT = |
|
|
||||
|
|
|
|
|
|
|
||||||
12 |
|
|
|
|
M |
|
V |
P2 |
T2 |
|
||
|
|
|
T1 |
|
|
|
|
|
||||
= |
m |
C |
(T |
−T ) |
V1 |
V2 |
V |
|||||
|
||||||||||||
|
M |
|
V |
|
1 |
2 |
|
|
|
|||
Получим уравнение адиабаты. Возьмем систему (газ) в количестве 1 моль
dU +d ′A = 0 или CV dT + pdV = 0 .
Разделим это уравнение на уравнение Клапейрона
pdV = −C dT |
|
|
dV |
|
|
|
CV |
|
dT |
|
|
R |
|
dV |
|
dT |
|
|||||||
V |
|
: |
= − |
|
|
|
|
+ |
= 0 . |
|||||||||||||||
pV = RT |
|
|
R T |
|
|
|
|
|||||||||||||||||
|
|
|
V |
|
|
|
|
|
|
CV V T |
|
|||||||||||||
Используя уравнение Майера Cp = CV |
|
+ R или R = Cp −CV |
||||||||||||||||||||||
|
|
CP −CV |
|
dV |
+ |
dT |
|
= 0 . |
|
|
|
|
|
|
||||||||||
|
|
|
|
V |
T |
|
|
|
|
|
|
|
||||||||||||
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обозначим отношение |
Cp |
|
= γ , тогда |
Cp −CV |
= γ −1 . |
|
||||||||||||||||||
C |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
V |
|
||||||||
Следовательно
(γ −1) dVV + dTT = 0 , d(lnV γ −1 +ln T ) = 0 ,
d(lnV γ −1T ) = 0
TV γ −1 = const .
Это уравнение связывает температуру и объем газа в ходе адиабатического процесса. Из уравнения Клапейрона
T = PVR ,
тогда
PVR V γ −1 = const или pV γ = Rconst = const .
Уравнение Пуассона
pV γ = const ,
где γ = Cp - показатель адиабаты.
CV
Выразим γ = Cp через число степеней свободы i молекул газа.
CV
Молярная теплоемкость при постоянном объеме
|
|
|
|
C |
= |
|
|
i |
|
R , |
||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
V |
2 |
|
|
|
|
|
|
|
||||||
при постоянном давлении |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
i |
|
|
|
|
|
|
|
i +2 |
|
||||
C |
|
= C + R = |
|
|
R + R = |
R , |
||||||||||||
p |
|
|
|
|
||||||||||||||
|
V |
2 |
|
|
|
|
2 |
|
||||||||||
их отношение |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
i +2 |
|
|
|
|
|
|
|
||||||
|
|
|
CP |
|
|
R |
|
i + 2 |
|
|
||||||||
|
|
γ = |
= |
|
2 |
|
|
= |
. |
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
CV |
|
|
i |
|
|
|
i |
||||||||
|
|
|
|
|
|
|
|
2 |
R |
|
|
|
|
|
|
|||
35 |
36 |
§4. Второй закон термодинамики
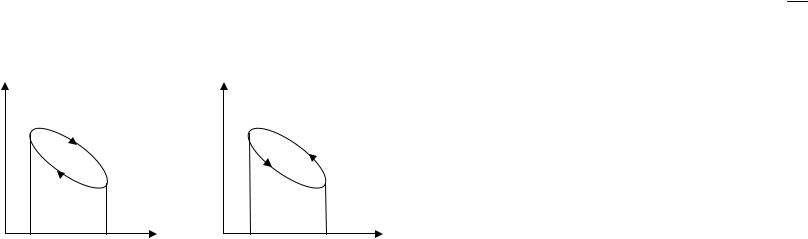
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. Если за цикл совершается положительная работа
A = ∫ pdV > 0
цикл протекает по часовой стрелке и называется прямым; если за цикл совершается отрицательная работа
A = ∫ pdV < 0
цикл протекает против часовой стрелки и называется обратным.
P |
P |
прямой |
обратный |
цикл |
цикл |
A |
A |
V1 |
V2 |
V |
V1 |
V2 |
V |
Прямой цикл используется в тепловых двигателях, обратный – в холодильных установках.
Термодинамический процесс называется обратимым, если его одинаково легко можно провести как в прямом, так и в обратном направлении; в каждом из этих случаев система проходит через одни и те же промежуточные состояния; после проведения прямого и обратного процесса система и окружающие её тела возвращаются в исходное состояние.
Второй закон термодинамики (получен из анализа работы тепловых и холодильных установок) имеет несколько формулировок.
1) по Кельвину. Невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
37
2) по Клаузиусу. Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Приведенное количество теплоты – это отношение теплоты dQ,
сообщаемое телу на бесконечно малом участке процесса, к температуре T теплоотдающего тела.
Энтропия S – это функция состояния, приращение которой определяется суммой приведенных количеств теплоты
∆S = S2 −S1 = ∫dT′Q .
Второй закон термодинамики. Энтропия изолированной системы не может убывать, она остается постоянной, если процессы, протекающие в системе обратимые, и возрастает, если процессы необратимые
∆S ≥ 0 .
Энтропия связана с термодинамической вероятностью состояния систем. Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние системы, или число микросостояний, осуществляющих данное макросостояние (по определению W ≥1 ).
Согласно Больцману, энтропия и термодинамическая вероятность связаны между собой следующим образом
S = k lnW ,
где k – постоянная Больцмана.
Эта формула позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы.
Второе начало термодинамики, отражая его статистический смысл, может быть сформулировано: наиболее вероятными являются процессы, протекающие с возрастанием энтропии.
Третий закон термодинамики (теорема Нернста). При стремле-
нии абсолютной температуры к нулю энтропия любой системы стремится к нулю
lim S = 0 .
T →0
38
ПРИЛОЖЕНИЕ № 3
Явления переноса
Процессы, протекающие в системе, могут быть равновесными и неравновесными.
Равновесным состоянием системы называется такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
При нарушениях равновесия в системах возникают потоки массы, либо энергии, либо электрического заряда и т.д. Эти процессы носят названия явлений переноса.
Диффузия –это обусловленное тепловым движением молекул выравнивание концентраций двух соприкасающихся газов, жидкостей и даже твёрдых тел.
Явление диффузии для газа подчиняется закону Фика. Масса вещества ∆m переносимого через площадку S, перпендикулярную оси x,
пропорциональна градиенту плотности вещества ddxρ , площади по-
верхности S и времени переноса ∆t
∆m = −D ddxρ S∆t ,
где D – коэффициент диффузии. Для газов коэффициент диффузии
D = 13 <υ >< λ > ,
где: <υ >- средняя скорость теплового движения молекул газа, < λ > - средняя длина свободного пробега молекул.
Знак минус обусловлен тем, что поток массы направлен в сторону убывания плотности.
Теплопроводность. Если в некоторой среде создать вдоль оси x
градиент температуры dTdx , то возникает поток тепла.
Явление теплопроводности подчиняется закону Фурье
∆Q = −χ dTdx S∆t ,
где: ∆Q - теплота, переносимая через поверхность S, перпендикуляр-
39
ную к оси x, за время ∆t , χ - коэффициент теплопроводности.
Знак минус отражает тот факт, что теплота течет в направлении убывания температуры.
Для газов коэффициент теплопроводности
χ = 13 cV ρ <υ >< λ >,
где cV - удельная теплоёмкость газа при постоянном объёме.
Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа или жидкости, движущимися с различными скоростями, заключается в том , что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее - увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Сила внутреннего трения между двумя слоями газа (жидкости) под-
чиняется закону Ньютона
F =η dudx S ,
где: η - динамическая вязкость,
dudx - градиент скорости, показывает быстроту изменения скорости
в направлении x, перпендикулярном направлению движения слоев, S- площадь соприкасающихся слоев.
Взаимодействие двух слоёв согласно второму закону Ньютона можно рассматривать как процесс, при котором от одного слоя к другому в единицу времени передается импульс, по модулю равный действующей силе
r |
|
dK |
r r |
|
F |
= |
|
или dK = Fdt , |
|
dt |
||||
|
|
|
dK = −η dudx Sdt ,
где dK - импульс, переносимый через площадку S, перпендикулярную оси x, за время dt. Знак минус указывает, что импульс переносится в направлении убывания скорости слоёв газа (жидкости).
Из кинетической теории газов следует, что коэффициент вязкости
η = 13 ρ <υ >< λ >.
40
