
Презентации 2 Еремин
.pdf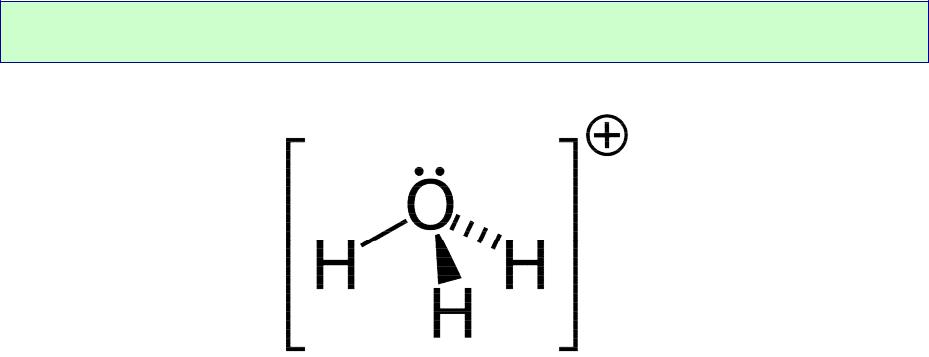
Ион гидроксония
В воде существует преимущественно в виде сольвата H3O+ 6H2O
Физтех, 1 курс. Осень 2015 |
|
4 |

Сопряженные кислоты и основания
|
HA + H2O |
|
H3O |
+ |
+ A |
|
Ka |
= |
|
[H3O+ ] [A ] |
|
|
|
|||
|
|
|
|
|
|
[HA] |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Kb |
|
|
[HA] [OH ] |
|
||||
|
A + H2O |
HA + OH |
|
|
= |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
] |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
[A |
|
|
|
|
|
|
|||||||||||||||
Ka Kb = [H3O+ ] [OH ] = Kw |
pKa pKb pKw 14 |
|||||||||||||||
Чем сильнее кислота, тем слабее сопряженное ей основание, и наоборот
|
Кислота |
HCl |
H SO |
|
H O+ |
H SO |
HSO – |
H PO |
4 |
HF |
NH + |
H O |
|
||||
|
|
|
2 |
4 |
3 |
2 |
3 |
4 |
3 |
|
|
4 |
2 |
|
|||
|
Основание |
Cl– |
HSO |
– |
|
H O |
HSO |
– |
SO 2– |
H PO |
– |
F– |
NH |
OH– |
|
||
|
|
|
|
4 |
2 |
3 |
4 |
2 |
4 |
|
3 |
|
|
|
|||
|
K |
107 |
102 |
|
1 |
1.5 10-2 |
1.2 10-2 |
7.5 10-3 |
3.5 10-4 |
5.6 10-10 |
10-14 |
|
|||||
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pKa |
–7 |
–2 |
|
0 |
1.8 |
|
1.9 |
2.1 |
|
|
3.5 |
9.3 |
14 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Физтех, 1 курс. Осень 2015 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|||

Сопряженные кислоты и основания
Физтех, 1 курс. Осень 2015 |
|
6 |

Физтех, 1 курс. Осень 2015
Диссоциация воды
H |
|
H |
+ |
+ OH |
|
K = |
[H+ ] [OH ] |
= 1.8 10 |
16 |
||||
2O |
|
|
[H |
2O] |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
[H2O] = 55.6 М, |
Kw = [H+ ] [OH ] = 10 14 |
|
|||||||||
|
|
|
|
|
|
||||||||
|
|
pH = lg[H+ ] |
pKw = pH + pOH = 14 |
|
|
||||||||
7
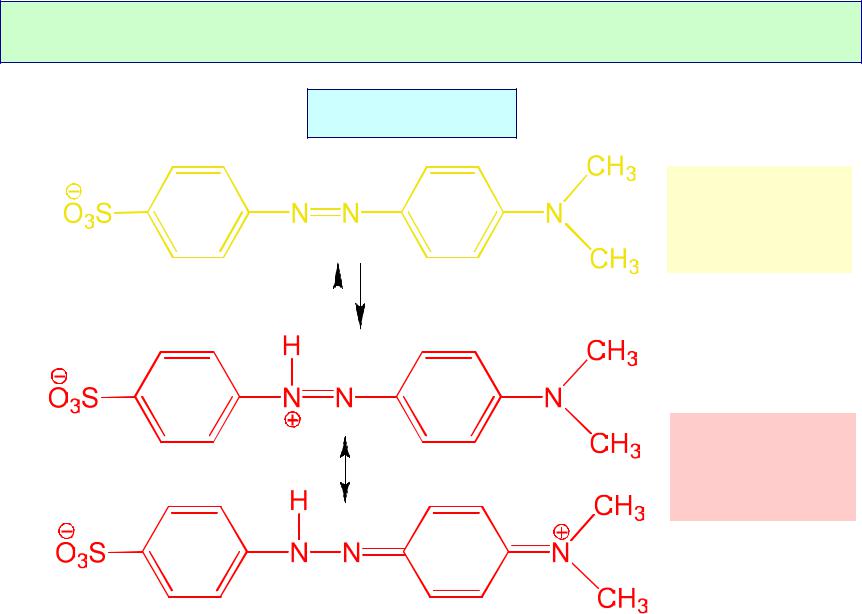
Почему индикатор меняет цвет?
Метилоранж
pH > 4.4
желтый
max = 460 нм
OH-  H+
H+
pH < 3.5
красный
max = 520 нм
Физтех, 1 курс. Осень 2015 |
|
8 |
Кислотность растворов
Значения pH растворов кислот, солей и оснований с концентрацией 0,1 моль/л.
|
Класс соединений |
|
Вещество |
|
pH рас- |
|||||
|
|
|
|
|
твора |
|||||
|
|
|
|
|
|
|
|
|
||
|
Кислота |
|
сильная |
|
|
HCl |
|
1,0 |
|
|
|
|
слабая |
|
CH3COOH |
|
2,9 |
|
|||
|
|
|
|
|
|
H2S |
|
4,1 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
AlCl3 |
|
3,0 |
|
|
|
Соль |
|
|
|
KNO3 |
|
7,0 |
|
|
|
|
|
|
|
Na2CO3 |
|
11,6 |
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Na3PO4 |
|
12,5 |
|
|
Основание |
|
слабое |
|
|
NH3.H2O |
|
11,1 |
|
|
|
|
сильное |
|
|
NaOH |
|
13,0 |
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
pOH = lg 0.1 = 1 |
|||
|
0.1 |
|
|
0.1 |
||||||
|
NaOH |
Na+ + OH |
|
pH = 14 |
pOH = 13 |
|
||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Физтех, 1 курс. Осень 2015 |
|
9 |

Слабые кислоты и основания
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
+ A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HA H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Ka = |
[H+ ] [A ] |
= |
|
|
[H+ ]2 |
|
|
|
[H+ ]2 |
|
|
|
|
|
pH |
|
|
|
1 |
|
pKa lg C |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
2 |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
[HA] |
|
|
C [H+ ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
pKa |
lg Ka Чем меньше Ka (больше pKa ), тем слабее кислота |
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
степень диссоциации: |
|
= |
[H+ ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
Ka = |
|
C 2C |
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOH |
|
|
|
|
|
+ |
+ OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
K |
b |
= |
|
[B+ ] [OH ] |
= |
|
|
[OH ]2 |
|
|
|
|
[OH ]2 |
|
|
|
|
|
pH |
14 |
1 |
pK |
b |
lg C |
|
|
||||||||||||||||||||||
|
|
|
|
C [OH |
|
|
|
|
|
C |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
[BOH] |
|
] |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||||||||||||||||||||||
|
pKb lg Kb Чем меньше Kb (больше pKb ), тем слабее основание |
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
Физтех, 1 курс. Осень 2015 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|||||||||||||||||||
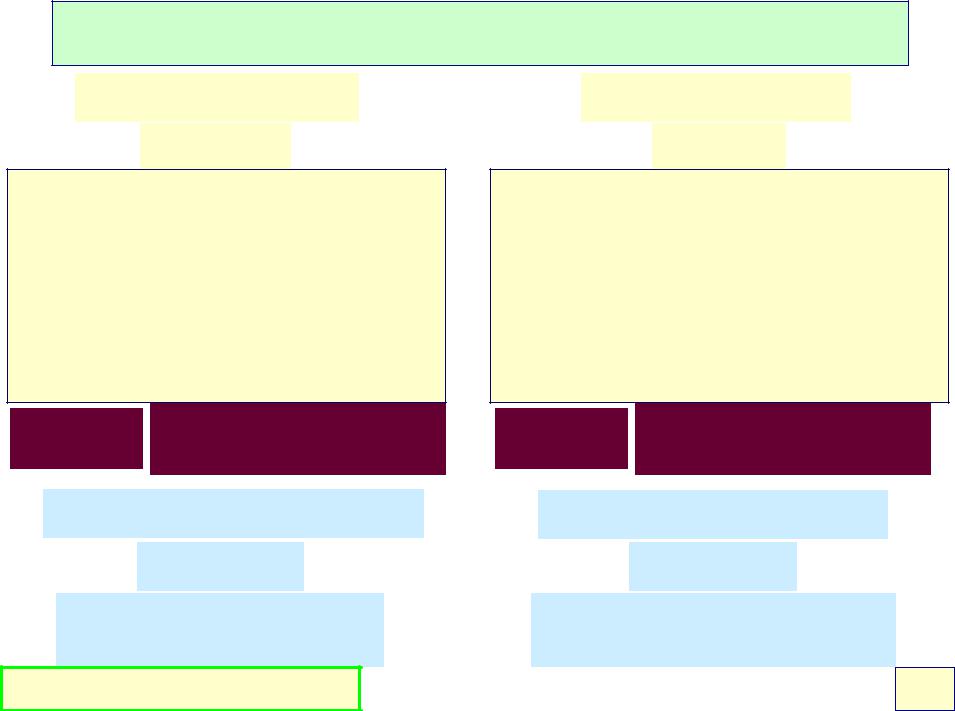
Сильные и слабые кислоты и основания
Сильная кислота
HCl(aq.)
•Легко отдает протоны.
•Кислотно-основное равновесие сдвинуто в сторону переноса протона к молекулам воды.
•Молекулы кислоты в растворе практически полностью депротонированы.
Ka 1 pKa - большое отрицательное число
Сильное основание
O2−(aq.)
Практически полностью протонировано (до OH−)
Физтех, 1 курс. Осень 2015
Слабая кислота
HF(aq.)
•Прочно удерживает протоны.
•Кислотно-основное равновесие сдвинуто в сторону неионизированной формы кислоты.
•Молекулы кислоты в растворе практически полностью протонированы.
Ka 1 pKa - большое положительное число
Слабое основание
NH3(aq.)
Практически полностью существует в виде молекул
11

|
|
|
|
Многоосновные кислоты |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Три последовательные ступени |
|
|
|
|
|
|
|||||
|
|
|
|
диссоциации ортофосфорной кислоты: |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H PO (aq.) + H O H PO |
|
−(aq.) + H O+(aq.) |
|
pKa1 2.12 |
||||||||||
3 |
4 |
2 |
2 |
4 |
3 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pKa 2 |
7.21 |
||||
H PO |
−(aq.) + H O HPO |
2−(aq.) + H O+(aq.) |
|
||||||||||||
2 |
4 |
|
2 |
|
4 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
pKa3 |
12.68 |
||||
|
HPO |
2−(aq.) + H O PO 3−(aq.) + H O+(aq.) |
|
||||||||||||
|
|
4 |
|
2 |
|
4 |
|
3 |
|
|
|
|
|
|
|
Правило Полинга: каждое последующее
значение pKa возрастает на 5 единиц
Относительное содержание различных
кислотных форм зависит от pH раствора
Физтех, 1 курс. Осень 2015 |
|
12 |
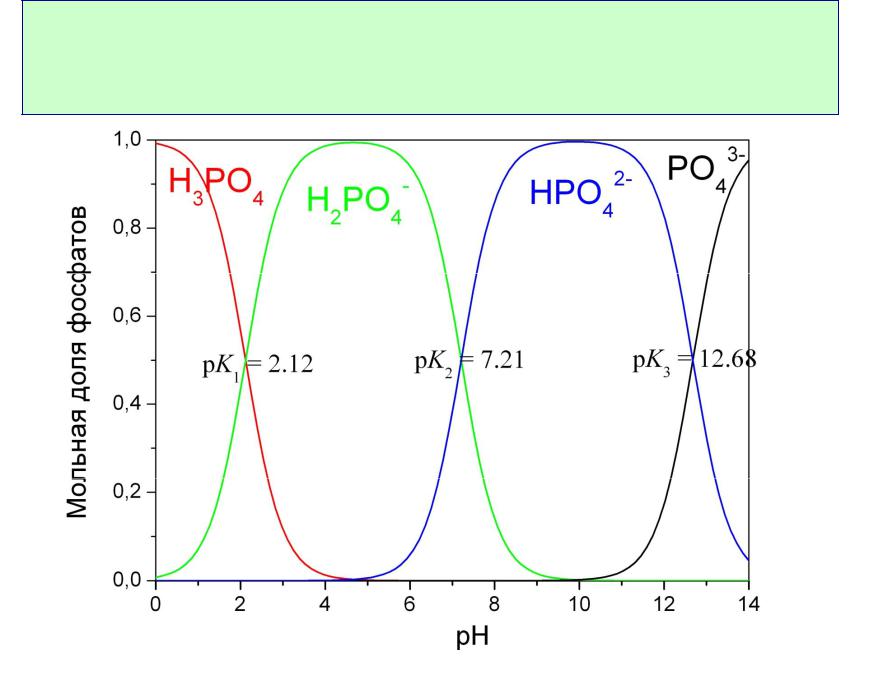
Зависимость состава раствора H3PO4 от pH
Физтех, 1 курс. Осень 2015 |
|
13 |
