
Сосудистая хирургия часть 1
.pdf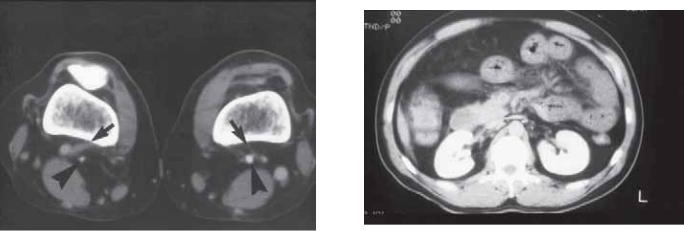
Глава 6. Компьютерная томография при сосудистых заболеваниях |
105 |
|
|
Рис. 6.12. Подколенная артерия. Слева отмечена мышечная порция, расположенная между артерией и веной. Справа нормальное расположение артерии и вены.
(ССПА) и адвентициального поликистоза бедренной и подколенной артерии (рис. 6.12). Это важный диагноз, определяемый у молодых здоровых пациентов с перемежающейся хромотой. В одном исследовании у 45 пациентов с подколенной артериопатией с помощью КТ диагностировано нарушение в 98% случаев, в то время как при артериографии — в 70%. В результате исследования было продемонстрировано, что КТ выявляет сдавление подколенной артерии у трех пациентов, в то время как результат артериографии у двух из трех пациентов — окклюзия. В дополнение к этому обнаружилась эффективность диагностики трех случаев адвентициального поликистоза подколенной артерии, в то время как при артериографии — только у одного из этих трех пациентов [66]. При КТ обнаруживаются различные варианты ССПА, зависящие от анатомических особенностей, но самое общее различие КТ демонстрируется тем, что подколенная артерия и вена разделены мышечной перемычкой или смещены латеральной головкой полуперепончатой мышцы медиально. Признаки адвентициального поликистоза бедренной или подколенной артерии включают локальные скопления жидкости с расширением, которые не усиливаются контрастом. КТ не только помогает в диагностике этих уникальных сосудистых заболеваний, но и определяет состояние окружающих мышечных и фасциальных структур, помогая в планировании хирургического вмешательства.
Нижняя полая вена и мезентеральная венозная система
Окклюзия нижней полой вены (НПВ) может иметь как внутренние, так и внешние причины. КТ определяет тромбоз НПВ и опухоли, но плохо визуализирует внутрипеченочную порцию НПВ. Преимущество КТ-исследования заключается в возможности визуализации таких врожденных аномалий, как удвоение НПВ, окружающей или ретроаортальной почечной вены и левостороннее расположение НПВ для оперативного вмешательства. КТ точно визуализирует портальную, селезеночную и нижнюю брыжеечную вены, что является методом выбора для диагностики тромбоза брыжеечных вен во многих центрах (рис. 6.13) [67]. Патогмоничные признаки тромбоза брыжеечных вен включают вы-
Рис. 6.13. Тромбоз брыжеечной вены, диагностированный при КТ по: 1) неусиленной контрастом верхней брыжеечной вене с усиленной веной; 2) отеку брыжейки; 3) истончению кишечной стенки.
являемый отек брыжейки с истончением стенки кишки и увеличением брыжеечной вены со снижением плотности вокруг измененной стенки.
Периферические вены
Дуплексное сканирование является золотым стандартом для визуализации глубоких вен нижних конечностей при их тромбозе. Из-за экономической эффективности КТ отводится меньшая роль в оценке глубокой венозной системы. Значительную роль КТ играет в идентификации и характеристике врожденных мальформаций (ВМ) нижних конечностей. Из-за сложности таких мальформаций их лучше оценить с помощью ряда исследований, таких как контрастная ангиография, КТ, МРТ. В то время как артериография важна для определения сосудов, «питающих» мальформацию, КТ важна в демонстрации вовлеченных групп мышц и фасций. Ограничение КТ-оценки в том, что мальформации имеют высокую степень клеточной дифференцировки и накапливают малое количество контраста, что снижает их полную визуализацию.
Сонные артерии
Выбором способа визуализации для оценки стеноза сонных артерий в последние десятилетия являлась контрастная ангиография и дуплексное сканирование (ДС). Многие каротидные эндартерэктомии, однако, были основаны только на данных ультразвукового исследования. В университете Duke изучали точные неинвазивные методы визуализации стеноза сонных артерий, включающих МРА, ДС и КТ-ангиографию (КТА) в сравнении с контрастной ангиографией. Из-за нечастого использования КТА в этом институте ее сравнивали с ДС, МРА и с обычной ангиографией. Выяснилось, что использование только одного ДС ошибочно определяет степень стеноза у 28% пациентов, а только одной МРА — у 18% пациентов [68]. Другое исследование, сравнивая КТ-ангиографию и обычную ангиографию, выявило корреляцию между КТА и ангиографией у 89% пациентов и определило, что использование двухмерной КТ с объемной техникой приводит к высокой точности диагностики [69]. В другом исследовании, использовавшем критерии NASCET > 60% в определении пораже-

106 |
Раздел I. Техника визуализации |
|
|
|
|
||
ния сонных артерий, выявлено, что контрастная ангиография КТА |
пациентов с симптомами «выхода» из грудной клетки [71]. Трех- |
||
имеет чувствительность 87%, специфичность 90%, точность 89% |
мерная КТ-реконструкция предоставляет точную детальную кар- |
||
[70]. Таким образом, это исследование показало, что осторож- |
тину шейного и аномального первого ребра. К тому же, у паци- |
||
ный подход к выбору хирургического вмешательства должен осу- |
ентов с атлетическим телосложением может выявляться |
||
ществляться, основываясь исключительно на неинвазивной визу- |
мышечная гипертрофия лестничной мышцы. Сагиттальная ре- |
||
ализации сонных артерий; оно также демонстрирует, что |
конструкция проводится до и после приведения и внутренней |
||
продолжающееся развитие КТ-технологии в будущем может иг- |
ротации руки (рис. 6.14). Приведение и внутренняя ротация при- |
||
рать исследовательскую роль для КТ-ангиографии в оценке пора- |
водят к подъему ключицы над первым ребром, вызывая окклю- |
||
жения сонных артерий. |
зию подключичной вены с последующей окклюзией подключич- |
||
|
|
ной артерии. Трехмерная КТ-реконструкция может также |
|
Синдром «выхода» из грудной клетки |
демонстрировать аномалии ключицы. Неправильно сросшийся |
||
перелом или деформация ключицы костной мозолью и непра- |
|||
|
|
||
«Выход» из грудной клетки — сложная анатомическая зона. Сим- |
вильное соотношение с реберно-ключичным пространством вы- |
||
птомы могут возникать при сдавлении подключичной артерии и |
зывают сосудисто-нервные нарушения при «выходе» из грудной |
||
вены и плечевого сплетения. Из-за сложных взаимосвязей меж- |
клетки (рис. 6.15). К сожалению, эта техника не используется у |
||
ду мышцами и сосудисто-нервными структурами в диагностике |
пациентов с неврогенной природой синдрома «выхода» из груд- |
||
и планировании оперативного вмешательства обычно полезна |
ной клетки. Для таких пациентов соотношение артериальной |
||
спиральная КТ. Matsumura с коллегами демонстрируют полез- |
циркуляции во время отведения и внутренней ротации могут де- |
||
ность сагиттальной и трехмерной реконструкции у здоровых и |
монстрироваться спиральной КТ. |
||
A Б
Рис. 6.14. КТ-скан при синдроме выхода из грудной клетки, по- |
|
лученный при контрастировании конечности на этой стороне |
|
(А) и при ее отведенной и наружной ротации (Б). Отмечена ок- |
Рис. 6.15. Перелом правой ключицы с деформацией мозолью |
клюзия подключичной вены. |
по отношению к реберно-ключичному пространству. |
Рис. 6.16. «Подтекание» эндопротеза в отдаленном периоде: отмечен контраст в аневризматическом мешке.
|
|
Глава 6. Компьютерная томография при сосудистых заболеваниях |
107 |
||
|
|
|
|
|
|
Задний |
АБА #1 |
Передний |
Задний |
Передний |
|
|
|
|
|
АБА #2 |
|
АБА #3 |
АБА #4 |
|
АБА #5 |
АБА #6 |
Контроль
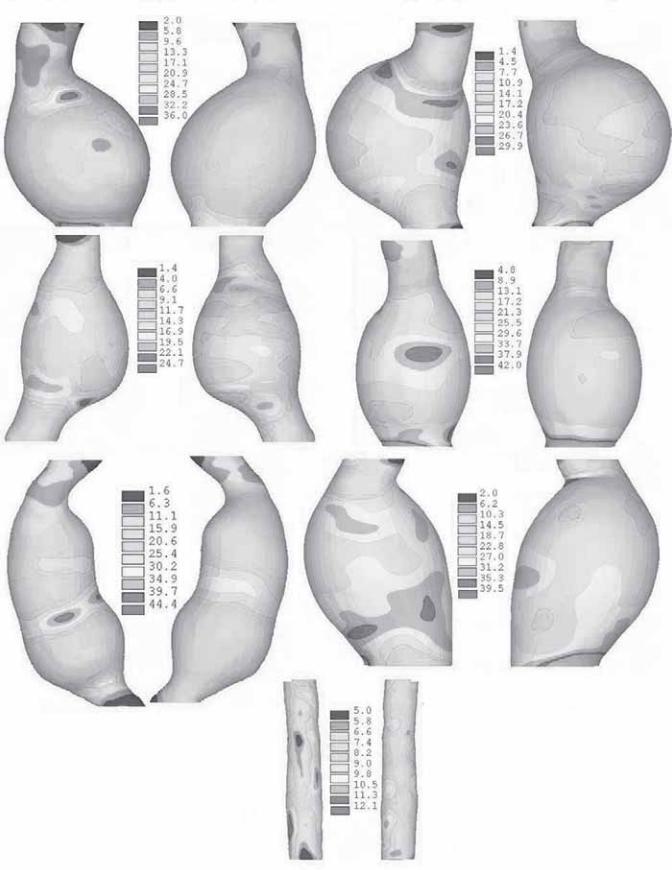
Рис. 6.17. Анализ конечного элемента (вычисляемое напряжение) может быть полезен в определении степени распределения механической силы или силового напряжения стенки конкретной АБА. Здесь показано распределение силы в задней и передней стенке брюшной аорты в шести различных 3D-реконструкциях АБА и одной «контрольной» аорты без аневризмы. Области серого цвета — зоны с искусственной высокой концентрацией в результате ограниченных эффектов. Шкалы представляют величины напряжения. (Рисунок представлен David Vorp.)

108 Раздел I. Техника визуализации
Комментарии
Развитие компьютерных технологий, используемых для получения изображения, позволяет сосудистым хирургам значительно изменять способы диагностики и лечения различных сосудистых заболеваний. Сосудистые хирурги и радиологи теперь имеют возможность неинвазивным способом выполнять КТ-ангиографию с реконструкцией и трехмерным изображением и получать фактически полную анатомию сосудов. В комбинации с передовой технологией в развитии эндопротезов КТ вводит сосудистую хирургию в эру эндоваскулярной хирургии, когда пациенты с сосудистой патологией могут проходить лечение за короткое время и иметь короткий послеоперационный период, а также значительно сокращается число осложнений, связанных с открытыми вмешательствами. Послеоперационное КТ-исследование важно в определении «подтеканий» эндопротеза (рис. 6.16).
Перспективы развития
С появлением «быстрого»программного обеспечения качество КТ-сканов будет улучшаться. Однако более важное клиническое развитие — это использование КТ-изображений (сканов) для вычисления зон с высоким уровнем напряжения стенки. Работы Fillinger и Vorpe используют конечный элемент анализа для КТ-сканов при создании моделей оценки зон высокого вертикального напряжения и сильного растяжения стенки. Основываясь на этих исследованиях, в будущем мы, возможно, будем прогнозировать, какие из небольших аневризм предрасположены к разрыву. Некоторые примеры сильного растяжения стенки представлены на рис. 6.17. Регулярное использование этих методов будет бесценно. Кроме того, данные о растяжении стенки могут быть полезны для лучшего моделирования эндопротеза.
Литература
1.Friedland GW, Thurber BD.: The birth of CT. AJR 1996; 167: 1365–1370.
2.Hounsfield GN. Computed medical imaging. Nobellecture, December 8, 1979. J Com put Assist Tomogr 1980; 4; 665–674.
3.Wiesen EJ, Miraldi F. Imaging principles in computed tomography. In Haaga JR, Lanzieri CF, Sartoris DJ (eds): Computed tomography and magnetic resonance imaging of the whole body. St. Louis: Mosby-Year Book, 1994: 3–25.
4.Barnes GT, Lakshminarayanan AV. Conventional and spiral computed tomography-physical principles and image quality considerations. In: Lee JKT, Sagel SS, Stanley RJ (eds): Computed body tomography with MRI Correlation. Philadelphia: Lippincott-Raven, 1998: 1–20.
5.Heiken JP, Brink JA, Vannier MW. Spiral (helical) CT. Radiology 1993; 189: 647–656.
6.Seeram E. Computed tomography-physical principles, clinical applications and quality control. Philadelphia: W.B. Saunders Company, 1994: 125–138.
7.Barnes JE. Characteristics and control of contrast in CT. Radiographics 1992; 12: 825–837.
8.Garrett JS, Higgins CB, Lipton MJ. Computed axial tomography of the heart. Int J Cardiac Imaging 1985; 1: 113–126.
9.Sheedy PF, Welch TJ, BreenJE Electron beam CT: status. In Fishman EK, Federle MP, eds. Body CT categorical course syllabus. American Roentgen Ray Society 1994: 73–76.
10.Kalender WA, Seissler W. Vock P. single-breathhold spiral volumetric CT by continuous transport and continuous scanner rotation. Radiology 1989; 173(P): 414.
11.Zeman RK, Fox SH, et al. Helical (spiral) CT of the abdomen. AJR 1993; 160: 719–725.
12.Towers MJ. Spiral or helical CT? [letter]. AJR 1993; 161: 901.
13.Herts BR, Einstein DM, Paushter DM. Spiral CT of the abdomen: artifacts and potential pitfalls. AJR 1993; 161: 1185–1190.
14.Zeman RK, Zeiberg AS, et al. Routine Helical CT of the abdomen: image quality considerations. Radiology 1993; 189: 395–400.
15.Brink JA, Heiken JP, Balfe DM. Spiral CT: decreased spatial resolution in vivo due to broadening of sectionsensitivity profile. Radiology 1992; 185: 469–474.
16.Polacin A, Kalender WA, Marchal G. Evaluation of section sensitivity profiles and image noise in spiral CT. Radiology 1992;
185:29–35.
17.Kalender WA. Technical foundations of spiral CT. Seminars in Ultrasound, CT and MRI 1994; 15: 81–89.
18.Urban BA, Fishman EK, et al. Detection of focal hepatic lesions with spiral CT: comparison of 4- and 8-mm interscan spacing. AJR 1993; 160: 783–785.
19.Foley WD. Technology/contrast: current state of the art. In Fishman EK, Federle MP (eds). Body CT categorical course syllabus. American Roentgen Ray Society 1994: 1–4.
20.Hu H, He HD, et al. Four multidetector-row helical CT: image quality and volume coverage speed. Radiology 2000; 215: 55–62.
21.RydbergJ, Buckwalter KA, et al. Multisection CT: scanning techniques and clinical applications. Radiographics 2000; 20: 1787–1806.
22.Siegelman SS. Four-dimensional imaging. Radiology 1998; 207: 565.
23.Kalender WA. Thin-section three-dimensional spiral CT: is isotropic imaging possible? Radiology 1995; 197: 578–580.
24.Katayama H, Yamaguchi K, Kozuka T. Adverse reactions to ionic and nonionic contrast media: a report from the Japanese committee on the safety of contrast media. Radiology 1990; 175: 621–628.
25.McClennan B. Ionic and nonionic iodinated contrast media: evolution and strategies for use. AJR 1990; 155: 225–233.
26.Stock berger SM, HicklinJA, et al. Spiral CT with ionic and non ionic contrast material: evaluation of patient motion and scan quality. Radiology 1998; 206: 631–636.
27.Oliver JH, Baron RL. Helical biphasic contrast-enhanced CT of the liver: technique, indications, and pitfalls. Radiology 1996;
201:1–14.
28.Garcia PA, Bonaldi VM, et al. Effect of rate of contrast medium injection on hepatic enhancement at CT. Radiology 1996;
199:185–189.
29.Sheafor DH, Keogan MT, et al. Dynamic helical CT of the abdomen: prospective comparison of preand postprandial contrast enhancement, Radiology 1998; 206: 359–363.
30.Bae KT, Heiken JP, Brink JA. Aortic and hepatic contrast medium enhancement at CT Part II. Effect of a reduced cardiac output in a porcine model. Radiology 1998; 207: 657–662.
31.Silverman PM, Roberts SC, et al. Assessment of a technology that permits individualized scan delays on helical hepatic CT: A technique to improve efficiency of contrast material. AJR 1996;
167:79–84.
Глава 6. Компьютерная томография при сосудистых заболеваниях |
109 |
|
|
32.Silverman PM, Brown B, et al. Optimal contrast enhancement of the liver using helical (spiral) CT of the liver: Value of Smart Prep. AJR 1995; 164: 1169–1171.
33.Hemmy DC, Zonneveld FW, et al. A decade of clinical threedimensional imaging: a review. Part I. Historical development. Invest Radiol 1994; 29: 489–496.
34.Prokop M, Shin HO, et al. Use of maximum intensity projections in CT angiography: a basic review. Radiographics 1997; 17: 433–451.
35.Fishman EK, Magid D, et al. Three-dimensional imaging. Radiology 1991; 181: 321–337.
36.Ney DR, Drebin RA, Fishman EK. Volumetric rendering of computed tomographic data: principles and techniques. IEEE Comput Graphic Appl 1990; 10: 24–32.
37.Johnson PT, Heath DG, et al. Three-dimensional CT: real-time interactive volume rendering. AJR 1996; 167: 581–583.
38.Kuszyk BS, Heath DG, et al. CT angiography with volume rendering: imaging findings. AJR 1995; 165: 445–448.
39.Zeman RK, Silverman PM, et al. CT angiography. AJR 1995; 165: 1079–1088.
40.Rubin GD, Dake MD, et al. Three-dimensional spiral CT Angiography of the abdomen: initial clinical experience. Radiology 1993; 186: 147–152.
41.Rubin GD, Napel S, Leung AN. Volumetric analysis of volumetric data: achieving a paradigm shift. Radiology 1996; 200: 312–317.
42.Rothenberg LN, Pentlow KS. AAPM Tutorial: radiation dose in CT. RadioGraphies 1992; 12: 1225–1243.
43.Huda W. Radiation dosimetry in diagnostic radiology. AJR 1997; 169: 1487–1488.
44.Mini RL, Vock P, Mury R. Radiation exposure of patients who undergo CT of the trunk. Radiology 1995; 195: 557–562.
45.Nienaber CA, von Kodolitsch Y, et al. The Diagnosis of Thoracic Aortic Dissection by Noninvasive Imaging Procedures. N Engl J Med 1993; 328: 1–9.
46.Sommer T, Fehske W, et al. Aortic dissection: a comparative study of diagnosis with spiral CT, multiplanar transesophageal echocardiography, and MR imaging. Radiology 1996; 199: 347–352.
47.Torossov M, Singh A, Fein SA. Clinical presentation, diagnosis, and hospital outcome of patients with documented aortic dissection: The Albany Medical Center Experience, 1986 to 1996. Am Heart J 1999; 137: 154–161.
48.Urban BA, Bluemke DA, et al. Imaging of thoracic aortic disease. Cardiol Clin 1999; 17: 659–682.
49.Hansmann HJ, Dobert N, et al. Various spiral CT protocols and their significance in the diagnosis of aortic dissections: results of a prospective study. Rofo Fortschr Geb Rontgenstr Neuen Bildgeb 2000; 172: 879–87.
50.Batra P, Bigoni B, et al. Pitfalls in the diagnosis of thoracic aortic dissection at CT angiography. Radiographies 2000; 20: 309–320.
51.Ledbetter S, StukJL, KaufmanJA. Helical CT in the evaluation of emergent thoracic aortic syndromes. Radiol Clin N Am 1999;
37:575–589.
52.Fabian TC, Davis KA, et al. Prospective study of blunt aortic injury: Helical CT is diagnostic and antihypertensive therapy reduces rupture. Ann Surg 1998; 227: 666–667.
53.Wall MJ, Hirshberg A, et al. Thoracic aortic and thoracic vascular injuries. Surg Clin N Am 2001; 81: 1375–1393.
54.Papanicolaou N, Wittenberg J, et al. Preoperative evaluation of abdominal aortic aneurysms by computed tomography. AJR 1986; 146: 711.
55.Flinn WR, Courtney DF, et al. Contained rupture of aortic aneurysm. In Bergan JJ, Yao JST (eds). Aortic surgery. Philadelphia: WB Saunders, 1989: 341–350.
56.Wadlington VR, Nemcek AA, et al. CT and MR imaging of imflammatory abdominal aortic aneurysms. RNSA 1992; 185(P): 258.
57.Fillinger, ME New Imaging Techniques in Endovascular Surgery. Surg Clin N Am 1999; 79: 451–475.
58.Fillinger ME Postoperative imaging after endovascular AAA repair. Semin Vasc Surg 1999; 12: 327–338.
59.Eskandari MK, Yao JS, et al. Surveillance after endoluminal repair of abdominal aortic aneurysms. Cardiovasc Surg 9: 469–71, 2001.
60.Best IM, Vansandani G, Bumpers HL. Complications of isolated bilateral iliac artery aneurysms. Am Surg 2001; 67: 767–771.
61.Soury P, Brisset D, et al. Aneurysms of internal iliac artery: management strategy. Ann Vasc Surg 2001; 15: 321–325.
62.Santilli SM, Wernsing SE, Lee ES. Expansion rates and outcomes for iliac artery aneurysms. J Vasc Surg 2000; 31 (1 Pt 1): 114–121.
63.Sahgal A, Veith FJ, et al. Diameter changes in isolated iliac artery aneurysms 1 to 6 years after endovascular repair. J Vase Surg 2001; 33: 289–294.
64.Rieker O, Duber C, et al. Prospective comparison of CT angiography of the legs with intraarterial digital subtractionangiography. AJR 1996; 166: 269–276.
65.Walter F, Leyder B, et al. Value of arteriography scanning in lower limb artery evaluation: a preliminary study. J Radiol 2001; 82: 473–9.
66.Rizzo RJ, Flinn WR, et al. Computed tomography for evaluation of arterial disease in the popliteal fossa. J Vasc Surg 1990; 11: 112–119.
67.Morasch MD, Ebaugh JL, Chiou AC, Matsumura JS, Pearce WH, Yao JST. Mesenteric venous thrombosis — A changing clinical entity. J Vac Surg 2001; 34: 680–684.
68.Johnston, DC, Goldstein LB. Clinical carotid endarterectomy decision making: noninvasive vascular imaging versus angiography. Neurology 2001; 56: 1109–1015.
69.Verhoek G, Costello P, et al. Bifurcation CT angiography. J Comp Assist Tomogr 1999; 23: 590–596.
70.Cinat M, Lane CT, et al. Helical CT angiography in the preoperative evaluation of carotid artery stenosis. J Vasc Surg 1998;
28:290–300.
71.Matsumura JS, Rilling WS, et al. Helical computed tomography of the normal thoracic outlet. J Vasc Surg 1997; 26: 727–735.

Глава 7
Магнитно-резонансная ангиография
Джагаян Дж. Кармачария, Омайда C. Веласкес, Рихард A. Баум, Джеффри П. Карпентер
В дооперационном обследовании используется контрастная ангиография, являющаяся золотым стандартом для оценки сосудистого заболевания. Эта техника связана с риском осложнений с частотой 8% [1, 2], включающих кровотечения, гематомы, псевдоаневризмы, боль на стороне пунктируемой артерии, временную или длительно продолжающуюся почечную недостаточность, аллергию на контраст и смерть. Приблизительно 29% пациентов с заболеванием периферических артерий имеют сопутствующую почечную недостаточность [3], вызывающую повышенный риск почечных осложнений при использовании нефротоксичного контраста. Магнитно-резонансная ангиография (МРА) представляет собой метод получения неинвазивных изображений без зависимости от нефротоксичного контрастного вещества. Это экономически выгодный метод дооперационной оценки сонных артерий, грудной и брюшной аорт, тазовой и периферической циркуляции, а также венозной анатомии [4–9]. МРА точно выявляет доступные сосуды оттока, включая скрытую для ангиографии дистальную циркуляцию. Метод имеет выраженную чувствительность и может отображать кровоток со скоростью менее 2 см/с. В дополнение к визуализируемой информации, для измерения скорости кровотока по артериальному сегменту и при получении информации о гемодинамике используют программные средства, что может быть полезно для градации степени стенозов зоне поражения [10].
Многие центры при дооперационной оценке сосудистых заболеваний, особенно для визуализации дистального русла нижних конечностей, заменяют обычную контрастную ангиографию на МРА [4].
Основные принципы
Магнитно-резонансная визуализация основывается на реакции тканей на силу магнитного поля с предварительным насыщением или без него, с повторением вспышек радиочастотных ударов. Ядра водорода или протоны, которые находятся в тканях, генерируют сигналы. Протоны со спином от тканей генерируют магнитное поле, которое отражает магнитный вектор. При нестимулированном состоянии магнитные векторы находятся в неупорядоченной позиции. При воздействии сильного магнитного поля векторы ориентируются в соответствии с осью магнитного поля. Внезапный радиочастотный удар изменяет нормальную ось спина протона, и при возвращении протонов на свою ось генерируется сигнал (spin echo). Этот сигнал связан с плотностью протонов конкретной ткани, захватывается датчиком на внешне передающей катушке и генерируется изображение.
МРТ имеет преимущество при динамической природе сигнала от кровотока по отношению к сигналу от тканей, расположенных стационарно. «Магнитизированный» кровяной поток на участке изображения генерирует сигнал, который кажется более ярким, чем изображение на заднем плане, как это бывает на участках изображения от тканей, которые были насыщены повторяющимися воздействиями радиочастотных ударов (рис. 7.1). Не нефротоксичный контраст, такой как гадолий, находясь в пределах циркуляции кровотока, может также усиливать такие сигналы. С этого момента такое усиление находится в зависимости от вырабатываемого потока и получаемого изображения. МРА, таким образом, является более физиологичным методом, чем анатомический метод визуализации сосудов. Эти фундаментальные принципы базируются на двух основных методиках МРА, которые сейчас используются:
Глава 7. Магнитно-резонансная ангиография |
111 |
|
|
Радиочастотное излучение
Ткань
Кровеносный сосуд
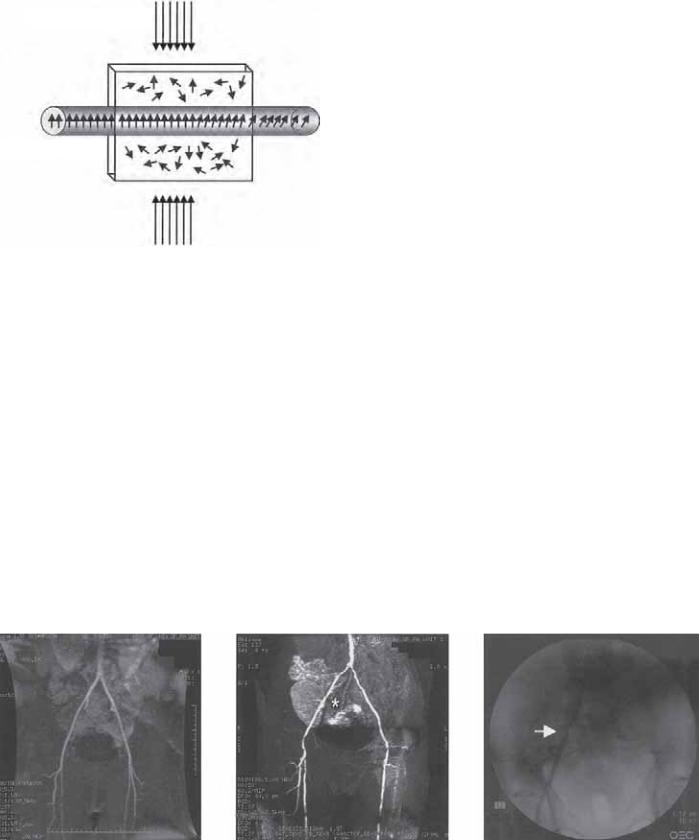
Рис. 7.1. Двухмерная техника, зависимая от различного насыщения тканей протонами. Кровоток под воздействием магнитного поля в визуализируемой части генерирует сигнал, представленный ярче, чем на заднем плане.
•полетном времени частиц при ангиографии (TOF) [11];
•фазово-контрастной ангиографии (PC) [12];
Техника 2-D TOF основывается на различном насыщении тканей протонами в потоке крови и насыщении мягких тканей. Быстрая и повторяющаяся радиочастотная иррадиация (RF) отражается на насыщении. Эти протоны не имеют времени для достижения равновесия, что проявляется в ослаблении эхо-сиг- нала, или сатурации. Если, однако, данная часть тканей содержит кровеносные сосуды, будут визуализироваться заряженные протоны от постоянно движущегося кровотока на этом участке тканей, вырабатывая, таким образом, яркий эхо-сигнал в ответ на RF-воздействие. Этот сигнал будет очень чувстви-
тельным при выявлении патологии сосудов, даже без контрастного усиления.
Фазово-контрастная ангиография (PC) имеет преимущество в изменении фазы ротации протона при движении ядра водорода через магнитное поле. Это изменение фазы пропорционально скорости движения протонов и величине градиента магнитного поля. Цифровая субтракционная технология может устранять задний план при комплексном методе субтракции с использованием градиента. Тогда кровоток может отображаться на изображении и можно вычислить его скорость.
Селективное изображение артериального потока по отношению к венозному можно легко получить при использовании магнитно-резонансной ангиографии. Насыщение тканей перед зоной интереса (ниже и около зоны) определяется кровотоком ниже этой зоны из-за отсутствия насыщения зоны выше интересуемой (т. е. артериальной крови) с получением сильного сигнала с помощью TOF-техники. До насыщения венозная кровь возвращается от низлежащих тканей к находящимся выше, с получением сигнала слабой (невизуализируемой) интенсивности. До насыщения ткани выше визуализируемой зоны (артериальный приток) может быть получено венозное изображение (маг- нитно-резонансная венография) [14]. Полезно комбинирование программирования, обработка данных и проектирование в более детальном виде.
Информация может отражаться как в двухмерном (2-D), так и в трехмерном (3-D) виде. Данные можно как получать в аксиальной плоскости, так и проектировать в двухили трехмерной плоскости с помощью компьютерной реконструкции, используя «утонченное» программирование.
Клиническое применение
Сравнение обычной ангиографии с магнитно-резонансной ангиографией (МРА) показывает, что МРА позволяет избегать осложнений, возникающих при артериальной пункции, исключается риск ятрогенной почечной недостаточности, и эта техника более чувствительна при определении характера дистальных сосудов
A |
|
Б |
|
B |
|
|
|
|
|
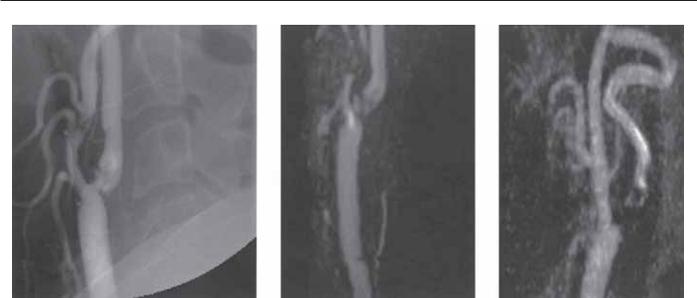
Рис. 7.2. (А) МРА-чувствительная техника, которая не только показывает основную сосудистую патологию, но и демонстрирует окружающие ткани/структуру органов. (Б) Почечный аллопротез наблюдается в правой части таза. Короткий участок стеноза зафиксирован в правой наружной подвздошной артерии, на 3 см проксимальнее анастомоза трансплантированной почечной артерии. (В) Данные были подтверждены операционными ангиограммами, и поражения были успешно дилатированы и стентированы с улучшением в значительной степени функции аллопротеза.
112 Раздел I. Техника визуализации
A |
|
Б |
|
B |
|
|
|
|
|
Рис. 7.3. (А) Обычная ангиография сонных артерий демонстрирует точную корреляцию с МРА TOF визуализацией. (Б) Оба исследования демонстрируют изъязвленную бляшку со стенозом 60% в проксимальной части правой внутренней сонной артерии. (В) Каротидная МРА демонстрирует участок с отсутствием сигнала от правой внутренней сонной артерии, предполагающим наличие стеноза высокой степени правой внутренней сонной артерии.
у пациентов с поражением периферических артерий [4]. Исследования, проводящиеся для сравнения обычной ангиографии с маг- нитно-резонансной, демонстрируют хорошо сбалансированные корреляции [6]. МРА при сравнении с обычной ангиографией имеет высокую степень точности в оценке артериальных стенозов крупных, средних и мелких дистальных сосудов. К тому же, она является неинвазивной техникой, предоставляющей хороший вид пространственной взаимосвязи сосудистой сети, включая информацию о морфологии бляшки, аномалии сосудистой анатомии и смежных паренхиматозных тканей (рис. 7.2).
Сонные артерии
Хотя каротидная ангиография — общепризнанный стандарт для каротидной визуализации, последние исследования доказывают, что неинвазивная визуализация может быть более чувствительной, экономически выгодной и более надежной, чем обычная ангиография [7–9]. Проспективные сравнительные исследования МРА и каротидной ангиографии демонстрируют среднюю чувствительность и специфичность стенозов высокой степени в 93% и 88% соответственно (рис. 7.3) [15, 16]. Интересно, что, когда провели прямые сравнения каротидной ангиографии, дуплексного сканирования и МРА с хирургическими данными, МРА и УЗИ лучше кореллировали с данными эндартерэктомии, чем обычная ангиография [17]. В зависимости от угла проецирования стандартная каротидная ангиография может недооценивать стенозы небольшой протяженности или мембраны, что связано с комплексным круговым изъязвлением. Это важно, потому что МРА может переоценивать степень стеноза. Такая ситуация связана с комплексной потоковой структурой в зоне критического стеноза и перед ней. МРА снижает вероятность переоценки благодаря определению данных у источника изображения, количественной оценке скорости и использованию 3-D процесса с усилением гадолинием [4], применению множественной угловой проекции [19]. Кроме того,
она должна соотноситься с эффектом МР-испускающего сигнала, который характеризует стенозы высокой степени градации, как и изображение МРА (рис. 7.3В). Потоковый провал, образующий вихревой поток перед повреждением, точно определяет высокую степень стеноза или наличие короткой сегментарной окклюзии внутренней сонной артерии.
С того момента, как каротидная ангиография оказалась связана со значительным риском инсульта [20], многие сосудистые хирурги резервируют стандартную ангиографию при противоречивых результатах ультразвука и МРА или неубедительных МРА и ультразвуковых изображений. С помощью каротидной ангиографии можно получить значимую информацию при нахождении в режиме субоптимальной неинвазивной визуализации. Последнюю можно выполнять при необычной постхирургической или посттравматической анатомии, при наличии артефактов от металлических предметов, неоднозначной серой шкалы, сглаживающей вид волны, или у пациентов, не переносящих эту процедуру.
Коронарные сосуды
С тех пор как в последнее десятилетие появились первые клинические сообщения об использовании МРА для визуализации коронарных артерий [13], широкое клиническое применение этого исследования для визуализации коронарных артерий было ограничено. Это явилось результатом специфических проблем в получении оптимальных коронарных изображений с помощью МР, включая сосуды маленького диаметра, извитые сосуды, перекрывание сигнала эпикардиальным жиром и артефакты от дыхания и сокращения сердца [15, 21–23]. В дополнение к этому, технические изменения, связанные с толерантностью пациентов к задержке дыхания, относительно медленная частота получаемых данных и бесполезные сигналы (металлические артефакты) от интракоронарных стентов, снижают способность МРА к точному выявлению коронарных стенозов.
Глава 7. Магнитно-резонансная ангиография |
113 |
|
|
Развитие МР-оборудования и программирования привело к появлению стратегий для возможной визуализации проксимальных эпикардиальных артерий [15]. Широко распространены протоколы, использующие ЭКГ селективную технику для минимизации артефактов от движения. Максимальное приближение сможет описывать обычные спиновые эхо, сегментарные гради- ент-эхо-последовательности, сегментирующиеся turbo-FLASH 3-D TOF, спиральные данные и эхоплоскостные изображения [13, 24–26]. МРА-визуализация проксимальных коронарных артерий хорошо коррелирует (> 95%) с обычной ангиографией. Визуализация проксимальных отделов коронарных артерий несколько лучше дистальных, и выраженные стенозы выявляются более точно. МРА может определить высокую соразмерность выраженных стенозов и низкую соразмерность средних стенозов. Чувствительность и специфичность коронарной МРА для определения выраженных стенозов составляют 85% и 80% соответственно. Умеренное усиление кровотока в значительной степени повышает чувствительность на 38% [26].
Преимущество коронарной артериальной визуализации перед МР лучше проявляется при визуализации аномалий коронарных артерий [28]. Хотя обычная ангиография может показать аномалии сосудов, расположение артерий по отношению к аорте и рядом расположенным органам оценить непросто. МРА может чет-
ко демонстрировать пассаж по аномальным артериям к аорте или от нее и их пространственную связь с нервами, венами и другими паренхиматозными структурами и может быть полезна как инструмент дооперационной визуализации [28, 29].
В общем, используемая в настоящее время технология коронарной МРА для выявления коронарных стенозов не очень распространена. Необходимо дальнейшее совершенствование визуализационной техники, чтобы коронарная МРА нашла более широкое признание.
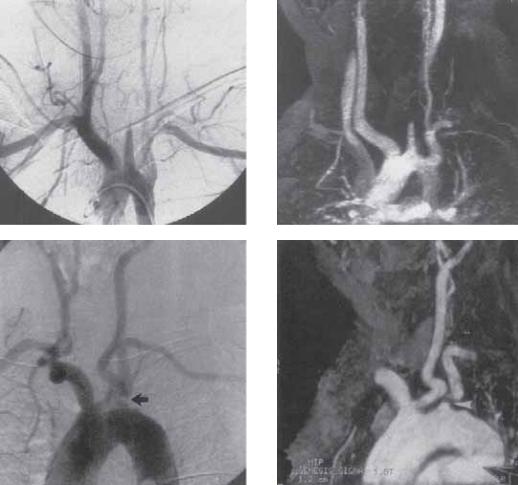
Дуга аорты, грудная и брюшная аорты
МРА может отображать дугу аорты и ее ветви с высокой степенью разрешения (рис. 7.4). Диссекция аорты может быть достоверно диагностирована МРА и классифицирована как тип А (вовлекается восходящая аорта) либо как тип В (дистальнее левой подключичной артерии). МРА точно демонстрирует взаимосвязь артериальных ветвей, отходящих от истинного или ложного просвета, а также определяет проксимальную и дистальную финестрацию (рис. 7.5).
Не нефротоксичные контрастные вещества, такие как гадолий (Gd), улучшают точность визуализации дуги и ветвей аорты (почечных и висцеральных артерий абдоминальной аорты). Для
A |
|
Б |
|
|
|
В |
|
Г |
|
|
|
Рис. 7.4. Диссекция и окклюзия левой общей сонной артерии визуализируются при артериографии (А) и МРА (Б). Аномалии дуги аорты («бычья» аорта) показаны на контрастной ангиографии (В) и (Г). (С разрешения из J Vasc Surg 1997; 25(1): 147.)
114 Раздел I. Техника визуализации
A |
|
Б |
|
B |
|
|
|
|
|
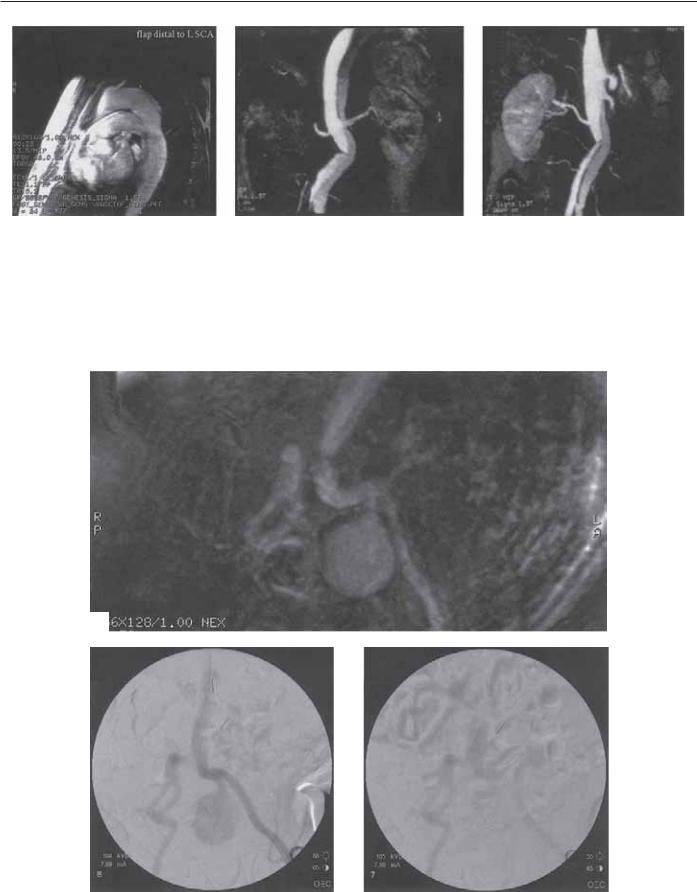
Рис. 7.5. Gd-усиленная МРА показывает (А) расслоение аорты тотчас дистальнее подключичной артерии (тип В-расслоения), (Б) диссекция заканчивается на уровне левой общей подвздошной артерии, (В) левая почечная артерия отходит от ложного просвета.
A
Б |
|
B |
|
|
|
Рис. 7.6. (A) МРА демонстрирует аневризму левой внутренней подвздошной артерии. (Б) Интраоперационные ангиограммы подтверждают эти данные с их успешным лечением чрескожным эндоваскулярным доступом, включающим прекращение кровотока по аневризме с использованием возможного стента. (В) Размер стента планируется с помощью МРА-изображения.
