
Техническая термодинамика
.pdfОбъемная теплоемкость смеси газов
|
|
n |
|
ссм/ r1c1| r2c2| |
... rn cn| |
ri ci| |
(2.16) |
i 1
где ri и ci| - доли компонентов по объему и объемные теплоемкости отдельных
компонентов.
Парциальное давление отдельного компонента
Р = |
PсмVi |
P r |
(2.17) |
|
|||
i |
Vсм |
см i |
|
|
|
|
Задачи Задача 2.1. Определить массовый состав сухого воздуха, его удельную
газовую постоянную, кажущуюся относительную молекулярную массу и плотность при абсолютном давлении 110 кПа и температуре 20% кислорода и 79% азота.
Решение. Между массовыми и объемными составами газовой смеси существует зависимость qi = riМi/Мcм
Кажущуюся молекулярную массу газовой смеси можно определить по формуле 2.11
n |
|
|
|
|
|
кг |
мсм== ri M i |
rО M o |
rN M N |
|
=0,21·32+0,79·28=28,84 |
|
|
|
к / моль |
|||||
i 1 |
2 |
2 |
2 |
2 |
|
|
|
|
|
||||
Тогда
qN2 rN2 M N2  M см =0,79 ·28/28,84=0,767; qO2 1 qN2 =1-0,767=0,233.
M см =0,79 ·28/28,84=0,767; qO2 1 qN2 =1-0,767=0,233.
Удельная газовая постоянная смеси определяется по формуле 2.14
Rсм=8314,3/Мсм=8314,3/28,84=288,3 кДж/(кг∙K)
Плотность газовой смеси определяем из формулы
см = |
P |
== |
100 103 |
3 |
|
см |
|
|
1,182 кг/м . |
||
|
|
|
|
|
|
|
RсмTсм |
|
288.3 293 |
|
|
Задача 2.2. Смесь двух объемов водорода и одного объема кислорода называют гремучим газом. Определить кажущуюся молекулярную массу, газовую постоянную и массовый состав гремучего газа.
Задача 2.3. Смесь газов состоит из 1,0 м3 генераторного газа и 1,5 м3 воздуха, взятых при нормальных физических условиях. Определить газовую постоянную смеси газов и парциальные давления составляющих смеси. Плотность генераторного газа ρ2 принять равной 1,2 кг/м3.
Задача 2.4. В цилиндр газового двигателя засасывается газовая смесь, состоящая из 20 массовых долей воздуха и 1 доли коксового газа.
Определить плотность и удельный объём смеси при нормальных условиях, а также парциальное давление воздуха в смеси. Плотность коксового газа при нормальных условиях 0,515 кг/м3?.
Задача 2.5. Анализ продуктов сгорания, произведенный с помощью газоанализатора показал их следующий объемный состав: СО2=12,2%; О2=7,1%; СО=0,4%; N2=80,3%. Определить массовый состав входящих в смесь газов.
11

Задача 2.6. Определить объем смеси газов при абсолютном давлении 100 кПа и температуре 900С, образовавшийся при смешивании 100 кг топочных газов с 50 кг воздуха. Массовый состав топочных газов 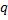 со=0,18; qНо=0,08;
со=0,18; qНо=0,08;
qо=0,02, и qN=0,72.
Задача 2.7. Определить среднюю мольную, объемную и весовую теплоемкости в процессах постоянного давления и постоянного объема в интервале температур от 0 до 1300°C для смеси газов, имеющий следующий объемный
состав: 8% СО2 ; 2% |
СО и 85% |
N 2 ; 5% H 2 . |
|
Задача 2.8. Определить потери тепла ккал / ч с выпускными газами двига- |
|||
теля внутреннего |
сгорания, |
если количество |
выпускных газов за 1 |
ч : М Н2О 0,2 моль / ч : М N2 О2 1,5 моль / ч; М СО2 0,15 моль / ч. Температура выпускных |
|||
газов t 500 C. Количество всасываемого воздуха в 1 |
ч L0 1.6 моль / ч, а его тем- |
||
пература t0 20 C.
3 ТЕПЛОЕМКОСТЬ ГАЗОВ
Теплоемкостью газа называют количество теплоты, необходимое для повышения его температуры на 1 К. Теплота, затраченная на повышение температуры единицы количества газа на 1 К называется удельной теплоемкостью. Принято удельную теплоемкость называть просто теплоемкостью.
В зависимости от выбранной количественной единицы различают тепло-
емкости: мольную Сm-кДж/(кмоль·К), массовую С – кДж/(кгК), и объемную С’
– кДж/(м3К).
Так как в 1 м3 газа могут содержаться, в зависимости от параметров его состояния, разные количества газа, принято относить 1 м3 газа к нормальным условиям (Р0= 101325 Па, Т0=273,15 К).
Между теплоемкостями существует следующее соотношение
С= |
Сm |
; С’= |
Cm |
; С= |
C' |
; С’=ρ0∙С , |
(3.1) |
|
|||||||
|
|
|
|||||
|
М |
|
22.4 |
|
0 |
|
|
где ρ0 – плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку отличают истинную и среднюю теплоемкость.
Если q – удельное количество теплоты, сообщаемой единице количества
вещества (или отнимаемый от него) при изменении температуры от t1 |
до t2 , то |
величина |
|
_ |
|
С =q/(t2- t1)=q/( Т2- Т1), |
(3.2) |
Представляет собой среднюю теплоемкость в пределах от t2 до t1.
Предел этого отношения, когда разность температур стремиться к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как
q |
|
С dT |
(3.3) |
Теплоемкость зависит от вида процесса сообщаемая газу теплоты.
12

Для теплотехнических расчетов особое значение имеют теплоемкости га-
зов |
при |
|
|
постоянном давлении |
||||||
|
|
|
| |
|
|
|
|
|
| |
|
С ,С |
,C |
,C |
||||||||
|
|
. |
||||||||
|
v |
v |
|
v |
|
v |
||||
|
|
|
|
| |
|
|
|
|
|
| |
и при постоянном объеме |
С |
|
,С |
,C |
|
,C |
||||||
|
|
|
|
|
|||||||
|
|
р |
|
p |
|
|
p |
|
|
p |
|
Между массовыми теплоемкостями С р и Сv существуют соотношения
С р Сv R0; |
С р |
k |
(3.4) |
Сv |
где к- показатель адиабаты.
Постоянная теплоемкость политропного процесса с показателем n находитcя из выражения
C |
|
C |
|
n k |
C |
|
|
R0 |
. |
(3.5) |
n |
v n 1 |
v |
|
|||||||
|
|
|
|
n 1 |
|
|||||
Для приближения расчетов при невысоких температурах теплоемкость можно считать постоянной.
Таблица 3.1 Приближенные значения мольных теплоемкостей при v -const, р-
сonst
|
|
Теплоемкость, |
Теплоемкость, |
Показатель |
|
||
|
|
кДж/(кмоль∙К) |
КДж/(кмоль∙К) |
|
|||
Газы |
|
адиабаты, |
|
||||
|
С |
|
|
|
|
||
|
|
тр |
С |
mv |
К |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
Одноатомные |
|
20,93 |
12,56 |
1,67 |
|
||
|
|
|
|
|
|
||
Двухатомные |
|
29,31 |
20,93 |
1,4 |
|
||
|
|
|
|
|
|
||
Трех- и многоатомные |
|
37,68 |
29,31 |
1,2 |
|
||
|
|
|
|
|
|
||
При точных расчетах |
учитывают криволинейную зависимость теплоем- |
||||||
кости от температуры и пользуются табличными значениями средних теплоемкостей в интервале от 0°С до t °С (Приложение1). Их отмечают сверху черточ-
кой и указанием границ температур. Например : C p t01 ,Cv t02 и т.д.
Менее точные расчеты, применяемые в технике получаются при использовании линейной зависимости теплоемкости от температуры (Приложение 2).
Средняя теплоемкость в этом случае определяется в интервале температур от t1 до t2 по уравнению
С a |
b |
t |
t |
|
|
(3.6) |
|
|
|||||
2 |
1 |
|
2 |
|
|
|
где a и b- величины, зависящие от физических свойств газа и постоянные для данного газа.
При пользовании таблицами значения истинных теплоемкостей, а также средних теплоемкостей в пределах от 0°С до t°С берутся непосредственно из таблиц, причем в необходимых случаях проводится интерполирование.
13
Количество теплоты, которое необходимо затратить для нагревания или охлаждения рабочих тел определяются из соотношений а) для 1 кг
|
|
|
|
|
t2 |
t |
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
q С |
|
|
C |
|
|
t |
|
C |
t ; |
(3.7) |
|||||||||||||||
|
|
|
|
|
t1 |
|
2 |
1 |
|
|
2 |
|
|
2 |
|
|
|
|
1 |
1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
для m кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
Q m q |
|
|
|
|
|
|
|
|
|
|
|
|
(3.8) |
|||||
б) для 1 нормального кубического метра газа |
|
|
|
|
|
||||||||||||||||||||
q |
|
| |
|
t2 (t |
|
t ) |
|
|t |
|
|
|
|t ; |
(3.9) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
C |
2 |
C |
2 |
C |
|||||||||||||||||||||
|
|
|
|
|
|
|
t1 |
|
1 |
|
|
2 |
|
|
1 |
1 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
для объема Vo в м3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Q V0 q |
|
|
|
|
(3.10) |
||||||||||
В зависимости от условий, при которых протекают нагревание (охлаждение) газа (V- const , p- const ) в формулах 3.6...З.10 ставятся соответствующие значения теплоемкости.
Теплоемкость смеси идеальных газов
|
|
n |
|
|
массовая |
Ccм |
qiCi |
; |
(3.11) |
|
|
i 1 |
|
|
|
C \ |
n |
\ |
|
объемная |
r C |
(3.12) |
||
|
cм |
i 1 i |
i |
|
Задачи Задача 3.1. Вычислить количество теплоты необходимой на нагревание
при постоянном давлении р=100 кПа ,60 м3 воздуха от 10° до 500°С. Задачу решить в трех вариантах:
а) считая зависимость теплоемкости от температуры криволинейной; б) пользуясь формулой линейной зависимости средней теплоемкости
воздуха от температуры; в) полагая, что теплоемкость не зависит от температуры.
Решение. Количество теплоты, необходимое на нагревание воздуха, исходя из криволинейной зависимости теплоемкости от температуры определяем по следующей формуле, полученной на основании уравнений (3.7)и(3.8)
|
|
|
t2 |
|
|
|
|
t |
|
|
|
|
|
t |
|
|
|
|
|
t |
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Q |
|
|
V |
|
С |
\ |
|
2 t |
|
|
С |
\ |
1 t |
|
m |
С |
\ |
|
2 t |
|
|
С |
\ |
1 t |
. |
|||
|
p |
|
t |
0 |
|
|
p |
|
|
2 |
|
|
p |
|
1 |
|
|
|
p |
|
|
2 |
|
|
p |
|
1 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
1 |
|
|
|
|
t |
0 |
|
|
|
|
t |
0 |
|
|
|
t |
0 |
|
|
|
|
t |
0 |
||||
Если использовать при решении задачи объемные теплоемкости, то нужно найти объем воздуха при нормальных условиях (Р0=101325 Па и Т0=273,15 К). Можно определить массу воздуха и применить массовые теплоемкости.
Определяем массу воздуха по уравнению
m |
pV |
|
|
100 103 60 |
7,39 кг |
|
|
287 283 |
|||
|
R |
Т |
|
||
|
воз |
|
|
|
|
Из приложения 1 выбираем средние изобарные массовые теплоемкости от
0 до 10 и от 0 до 500°С.
14

|
10 1,0067кДж /(кг К ); |
|
р |
|
500 1,0925кДж /(кг К ); |
|
|
|
|
||||
С р |
С |
|||||
|
|
0 |
|
|
|
0 |
|
|
|
||||
Qp 10500 7,39(1,0925 500 1,0067 10) 3962 кДж;
В случае линейной зависимости теплоемкости от температуры формула для определения количества теплоты будет выглядеть
|
|
|
|
|
|
|
|
|
|
|
|
0,952 9349 10 |
8 |
|
|
|
|
t2 |
|
m a b t |
2 |
t |
|
|
7,39 |
|
10 500 |
|
|||
Qp |
|
|
|
|
1 |
|
|
|
|
|
|
|
357кДж; |
||
|
t1 |
t2 t1 |
|
|
|
|
500 10 |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||
а при постоянной теплоемкости
Q |
|
|
t2 |
mс |
|
t |
|
t |
m |
сmp |
t |
|
t |
7.39 |
29.31 |
500 10 3665 кДж. |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||||
|
p |
|
t |
|
p |
|
2 |
1 |
|
M |
2 |
1 |
|
28.96 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Во второй случае использовали уравнения (3.6), (3.8) и приложение 2, а в третьем- (3.1), (3.8) и таблицу 3.1.
Задача 3.2. В котел-утилизатор поступают дымовые газы с температурой 1200°С следующего объемного состава: СО2=12%; О2=6%,N=74%; пары воды H2O=8% при давлении 200 кПа. Определить количество подаваемой теплоты нагреваемой воде, если температура газов при выходе из котла 200°С, к.п.д котла – 70% и расход дымовых газов 10 м 3/ч
Решение. Определяем количество теплоты, отведенной от дымовых газов по уравнению
|
t |
|
n |
|
1 |
|
n |
|
1 |
|
Qp |
|
2 |
V0 C pi |
rit2 |
C pi |
rit1 . |
||||
|
t1 |
i 1 |
|
|
|
i 1 |
|
|
|
|
где Vo - объём газовой смеси при нормальных условиях;
ri - объемные доли отдельных компонентов дымовых газов.
Из уравнения состояния для m кг идеального газа необходим объем дымовых газов при нормальных условиях
V |
pVТ0 |
|
200 103 273.15 |
3.685 |
м3 |
|
|
||||
0 |
P0Тсм |
|
1013251473.15 |
ч |
|
|
|
|
|||
Среднюю теплоемкость газов, входящих в состав дымовых газов берем из приложения 1
Qp |
|
t2 |
3.685 1.78730.121.33520.061.30380.741.52230.08 200 |
|
|||
|
|
t |
|
|
|
|
|
|
1 |
|
|
2.2638 0.12 1.5005 0.06 1.4202 0.74 1.7769 0.08 1200 2779.23 кДж.
Q Q |
|
|
t2 |
|
|
2779.23 0.7 1945 кДж. |
|
|
|
||||
в |
p |
|
t |
|
к |
|
|
|
|
|
|||
|
1 |
|
|
|
||
Задача 3.3. Вычислить количество теплоты, удаляемое из птичника с отсасываемым воздухом, если температура внутри помещения 16,а наружного - 0°С. Объемная подача вентилятора 20 тыс. стандартных м3/ч.
Задача 3.4. В конденсатор холодильной установки с водяным охлаждением поступает газообразный аммиак давлением р =1,05 MПa и температурной 122°С, охлаждается до t=27°C. Объемный расход аммиака V t=0,04 м3/с. Вода в конденсаторе нагревается на 60С. Определить количество отведенной теплоты
15

и массовый расход воды на охлаждение конденсатора. Зависимость теплоемкости от температуры не учитывать.
Задача 3.5. В баллоне объемом 60л находится кислород при давлении 5 МПа и температуре 20°С. Какое количество тепла подведено, к кислороду, если его температура повысилась до 150°С. Какое давление установится при этом в сосуде? Зависимость теплоемкости от температуры. принять криволинейной.
Задача 3.6. В воздухоподогревателе котельного агрегата дутьевой воздух нагревается дымовыми газами, от 20 до 200°С. При этом температура, дымовых газов понижается от 350 до 160°С. Объемный состав дымовых газов: СО2=12%; О2=6%,N=74%, H2O=8%. Определить соотношение расходов воздуха и дымовых газов. Зависимость теплоемкости газов и воздух от температуры считать прямолинейной.
Задача 3.7. Определить среднюю мольную, объемную и весовую теплоемкости в процессах постоянного давления и постоянного объема в интервале температур от 0 до 1300°C для смеси газов, имеющий следующий объемный состав: 8% СО2 ; 2% СО и 85% N 2 ; 5% H 2 .
4 ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ГАЗОВ
Изменение состояния тела при взаимодействии его с окружающей средой называется термодинамическим процессом. В общем случае термодинамическом процессе могут изменяться все параметры состояния. В технической термодинамике рассматриваются следующие основные процессы:
изохорный - при постоянном объеме (V=const); изобарный - при постоянном давлении (р =const); изотермический - при постоянной температуре (Т=const); адиабатный - без теплообмена (q=const);
политропный- ( pvn =const); где n - показатель политропы.
Изменение внутренней энергии в термодинамических процессах с идеальным газом
U Cv T2 |
T1 , |
|
|
(4.1) |
|
Изменение энтальпии в любом термодинамическом процессе с идеаль- |
|||||
ным газом |
|
|
|
|
|
h Cp T2 T1 , |
|
|
(4.2) |
||
Изохорный процесс. Зависимость между основными параметрами со- |
|||||
стояния подчиняется закону Шарля |
|
|
|
||
P |
P T T |
1 |
, |
(4.3) |
|
2 |
1 |
2 |
|
|
|
В изохорном процессе газ работу не совершает, и вся теплота идет на из- |
|||||
менение внутренней энергии. |
|
|
|
|
|
Изобарный процесс. Зависимость между основными параметрами со- |
|||||
стояния выражается уравнением закона Гей-Люссака |
|
||||
V2 V1 T2 |
T1 . |
|
|
(4.4) |
|
Работа изменения объема 1кг газа
16

|
w p v2 v1 . |
|
|
(4.5) |
||||||
или |
|
|
|
|
|
|
|
|
|
|
|
w R0 T2 T1 , |
|
|
|
(4.6) |
|||||
Для любой массы газа |
|
|
|
|
|
|
|
|||
W mp(v2 |
v1 ) p(V2 |
V1 ) |
(4.7) |
|||||||
или |
|
|
T2 T1 . |
|
|
|
|
|||
|
W mR0 |
|
|
|
(4.8) |
|||||
Количество теплоты процесса |
|
|
|
|
||||||
|
|
T T |
V |
|
|
T T |
. |
|
||
|
|
|
C1 |
|
||||||
Q mC |
p |
(4.9) |
||||||||
|
|
2 1 |
0 p |
2 |
1 |
|
|
|||
где V0-объем газа при нормальных физических условиях. Изотермический процесс. Зависимость между основными параметрами
выражается уравнением Бойля-Мариотта
P |
P v |
v . |
(4.10) |
|
1 |
2 |
2 |
1 |
|
Работа единицы массы идеального газ определяется по уравнениям:
|
|
w R T ln |
v2 |
. |
|
|
|
|
|
|
(4.11) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
0 |
|
|
v1 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
w R0T ln |
|
|
p1 |
|
|
|
|
|
|
(4.12) |
||||||||
|
|
|
|
p2 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
w p v ln |
v2 |
|
|
|
|
|
|
|
(4.13) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
1 |
1 |
|
|
|
v1 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
w p1v1 ln |
|
|
p1 |
|
|
|
|
|
|
(4.14) |
||||||||
|
|
|
|
p2 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Работа совершенная m кг газа равно |
|
|
|
|
|||||||||||||||
|
|
W mw, |
|
|
|
|
|
|
|
|
|
|
|
(4.15) |
||||||
|
В изотермическом процессе изменение внутренней энергии равно нулю, |
|||||||||||||||||||
поэтому |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Q W , |
|
|
|
|
|
|
|
|
|
|
|
(4.16) |
||||||
|
Адиабатный процесс. Уравнение процесса |
pvk const , |
||||||||||||||||||
где |
K |
Cp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C - показатель адиабаты. |
|
|
|
|
|
|
|
|||||||||||||
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Зависимость между основными параметрами |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
k |
|
|||
|
|
|
p2 |
|
|
|
|
|
|
k 1 |
|
|
||||||||
|
|
|
|
|
v1 |
|
|
|
|
T2 |
|
|
(4.17) |
|||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
p1 |
|
|
|
|
|
|
|||||||||||
|
|
|
v2 |
|
|
|
T1 |
|
|
|||||||||||
Работа единицы массы рабочего тела
|
|
|
w |
|
|
1 |
|
|
p v p v |
; |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
k 1 |
|
|
|
1 |
1 |
|
2 |
2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
|
|
|
k 1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
v1 |
|
|
|
|
|
|
k |
|
||||||||||||
|
p1v1 |
|
|
|
|
|
|
p1v1 |
p2 |
|
|
|||||||||||||
w |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
; |
|||
k 1 |
v |
|
|
|
|
k 1 |
p |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
w |
R0 |
|
|
|
T T |
. |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
k 1 |
|
1 |
|
2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17 |
|
|
|
|
|
|
|
|
(4.18)
(4.19)
(4.20)

Работа любой массы газа |
|
W mw. |
(4.22) |
В адиабатном процессе q 0 и уравнение: первого закона термодинами- |
|
ки принимает вид 0 du dw или dw du , т.е. работа в |
адиабатном процессе со- |
вершается за счет уменьшения внутренней энергии. |
|
Политропный процесс. Уравнение политропы, |
pvn const , |
где n Cp Cn C |
C |
- показатель политропы. |
|
||||
r |
n |
|
|
|
|
|
|
Показатель политропы может меняться от |
до . |
||||||
Характеристикой политропного процесса является величина |
|||||||
|
|
|
u |
, |
|
(4.23) |
|
|
|
|
|
||||
|
|
|
q |
|
|||
которая может быть определена из выражения |
|
||||||
|
|
|
n 1 |
|
(4.24) |
||
|
|
n k |
|||||
|
|
|
|
|
|||
Зависимость между основными параметрами состояния, работа изменения объема газа определяется по формулам, аналогично 4.17… 4.21, но вместо показателя адиабаты применяется показатель политропы.
Количество теплоты политропного процесса
q Cn T2 T1 Cv |
n k |
T2 T1 ; |
(4.25) |
|
n 1 |
||||
|
|
|
||
Q mq |
|
|
(4.26) |
Задачи
Задача 4.1. В закрытом помещении, объемом V=150 м3 находится воздух при давлении Р=100 кПа и температуре t1=5 °С. Через некоторое время, температура воздуха повышается до 30°С. Определить какое количество теплоты сообщено воздуху, изменение внутренней энергии, и энтальпии воздуха, его конечное давление.
Решение. Нагревание воздуха протекает при постоянном, объеме, т.е. процесс изохорный. Из уравнения 4.3. Определяем конечное давление
P |
PT |
|
100 103 303 |
108.993 кПа |
|
1 2 |
|
|
|||
|
|
|
|||
2 |
T1 |
|
278 |
|
|
|
|
|
|
||
В связи с тем, что температура повышается незначительно, теплоемкость воздуха можно считать постоянной .
Q V C1 |
t |
|
t |
V PT |
|
C |
mv |
t |
|
t |
|
||||||
|
|
1 1 0 |
|
|
|
|
|||||||||||
2 |
|
|
|
|
|
|
|
|
2 |
||||||||
|
0 v |
|
1 |
|
P T |
|
22.4 |
|
1 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
0 |
1 |
|
|
|
|
|
|
|
|
|
|
|
150 100 103 278 |
20.93 |
30 |
5 3172 кДж |
|||||||||||||
|
|
|
|
|
|
|
|||||||||||
101325 303 |
|
22.4 |
|
|
|||||||||||||
Задача 4.2. При изобарном расширении углекислого газа температура его уменьшилась от 300 до 50°С. Определить доли теплоты, затраченной на изменение внутренней энергий и на совершение работы.
18
Решение: В изобарном процессе подведенная теплота расходуется на изменение внутренней энергии и на совершение работы, и уравнение первого закона термодинамики принимает вид
q U w.
Чтобы определить доли теплоты на изменение внутренней энергии и на совершение работы разделим данное уравнение на q
|
|
|
|
|
1 U |
|
w |
. |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
q |
|
|
q |
|
|
|
|
|||
Величина |
w |
1 |
U определяет ту долю всей теплоты, которая превра- |
||||||||||||||||
|
|||||||||||||||||||
|
q |
|
q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
щается в работу расширения. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Так для С02 при изобарном процессе |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
U Cv T2 T1 и q Cp T2 T1 ; |
|
|
||||||||||||||
|
|
|
|
w |
|
|
Cv |
T2 T1 |
|
|
|
||||||||
|
|
|
То |
|
1 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
q |
Cp |
T2 T1 |
|
|
|
|||||||||||
Принимая К=1,29 для С02, получаем |
|
w |
1 |
1.0 |
|
0, 225; |
U |
1 0, 225 0, 775. Сле- |
|||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
q |
|
1.29 |
|
|
|
q |
|
|||||
довательно, в изобарном процессе 22,5% теплоты превращается в работу, а 77,5 %расходуется на изменение внутренней энергии.
Задача 4.3. В охлаждаемом компрессоре изотермно сжимается V0=60 м3/ч воздуха до давления 0.6 МПа, определить затраченную мощность на сжатие и часовой расход охлаждающей воды mt компрессора, если вода нагревается при этом на 10°С.
Решение. Определяем мощность, затраченной на сжатие 60 м3/ воздух. Для изотермного сжатия
N |
W |
PV ln |
P2 |
100 103 |
60 |
ln |
600 |
2.98 кВт |
|
|
|
|
|
||||||
|
t |
1 |
0 |
P |
|
3600 |
100 |
|
|
|
|
|
|
|
|||||
|
|
|
|
1 |
|
|
|
|
|
В изотермическом процессе вся затраченная работа на сжатие превращается в теплоту, которая отводится охлаждающей водой
N Q mtvCpv t2 t1 mtvCpv t , |
тогда mtv |
|
N |
|
2.98 |
0.0712 кг / с 256.6кг / ч |
||
|
|
|
||||||
Cpv |
t |
4.19 10 |
||||||
|
|
|
|
|
||||
Задача 4.4. При нормальной, работе топливной аппаратуры двигателя температура смеси газов в цилиндре достигает 1900 К. После, сгорания следует политропическое расширение с показателем 1.3. Объем газов при этом до открытия выпускного клапана увеличивается в 12 раз. Насколько повышается температура газов, в момент открытия выпускного клапана, если в результате ухудшения работы топливной аппаратуры при расширении топливо догорает, благодаря чему значение показателя политропы расширения становится равным 1.2. Состояние газов до расширения в обоих случаях считать одинаковым.
Решение. Из соотношения параметров политропного процесса с показателями политропы n=1,3 и n=1,2 определяем конечные температуры в конце расширения
По условию задачи v1 v2 12 .Тогда
19

T2 T1 v1 n 1
v2
Если расширение происходит с показателем политропы n=1.3, то
T2 |
1900 |
1 |
1.3 1 |
901.60 K , |
|||
|
|
|
|
||||
|
|
||||||
|
|
12 |
|
|
|||
если n=1.2 , то |
|
|
|
|
|
|
|
|
|
1 |
|
1.2 1 |
|
||
T2 |
1900 |
|
|
|
1155.9 K |
||
|
|
||||||
|
|
12 |
|
||||
Задача 4.5. Компрессор, производительностью 120 м3/ч воздуха всасыва- |
|||||||
ет с давлением Р1=100 кПа, и сжимает его до давления Р2=0.7 МПа по политропе с показателем n=1,25. Вычислить, на сколько изменится работа сжатия , если сжатие будет происходить по изотерме. Температура окружающей среды 200С.
Задача 4.6. В процессе политропного расширения воздуху сообщается 80 кДж теплоты. Определить изменение внутренней энергии воздуха и производственную работу, если объем воздуха увеличился в 10 раз, а давление его уменьшилось в 8 раз.
Задача 4.7. 2 м3 кислорода расширяется политропно от р1=0,5 МПа и t1=400C до р2=0,15 МПа. Объем занимаемый при этом воздухом, становится равным 10 м3 . Определить показатель политропы, конечную температуру, ра-
боту и теплоту процесса. |
|
|
|
Задача 4.8. Углекислый газ |
массой 1 кг, |
с начальной |
температурой |
t1=20°С и давлением р1=1,0МПа |
адиабатно |
расширяется |
до давления |
р2=0,2МПа. Определить конечные температуру, удельный объем и работу расширения.
Задача 4.9. Кислороду в количестве 0,5 м3 при р1 =0,8 МПа и t=40°С. сообщается изотермически 65,45 кДж теплоты. Определить конечные давление и объем.
Задача 4.9. Определить тепловой поток Ф, отдаваемое уходящими газами котельной мясокомбината водяному экономайзеру для подогрева питательной воды если температура дымовых газов при входе в экономайзер 320 С, на выходе 200 С, средняя объемная теплоемкость дымовых газов Сд.г.=1,415 кДж/(м к) расчетный расход топлива для одного котла Вр=0,25 кг/с. Теоретический объем воздуха V=5,17 м3/кг, расход уходящих газов перед экономайзером 8,4 м3/с, за экономайзером 6,7 м3.
5 ВОДЯНОЙ ПАР. ДИАГРАММА hS ВОДЯНОГО ПАРА. ИССЛЕДОВАНИЕ ПАРОВЫХ ПРОЦЕССОВ ПО ДИАГРАММЕ hS
Вода и. водяной пар широко применяются в энергетике, в отоплении, вентиляции, горячем водоснабжении.
Водяной пар - реальный газ. Он может быть влажным, сухим насыщенным и перегретым. Уравнения состояния реальных газов сложны, поэтому в теплотехнических расчетах предпочитают использовать таблицы и диаграммы.
20
