
ХимияЭкз
.docx1. Ядерная модель атома. Протоны, нейтроны, электроны.
Ответ: Атом – микрочастица, нейтральная, состоит из ядра: протоны (p+), нейтроны (n0); и электронной оболочки: отриц. заряж. частицы – электроны (e-). Размер атома: 10-10 м = 1 Ао (ангстрем). Масса атома: 10-25 – 10-27 кг. Микрочастицы не подчиняются з-м классической физики. Для описания состояния микрочастиц исп-ют основы (идеи) квантовой механики.
2. Основные положения квантовой механики. а) Квантование энергии. б) Корпускулярно-волновой дуализм. в) Принцип неопределенности. Волновая функция.
Ответ:
а) Микрочастица поглощает и излучает
энергию строго опр-ми порциями –
квантами.
Формулы.
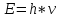
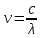
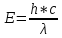 h
– пост. Планка = 6.63*10-34
Дж*с.
h
– пост. Планка = 6.63*10-34
Дж*с.
б)
Любую движущуюся микрочастицу можно
рассматривать как электромагнитную
волну.
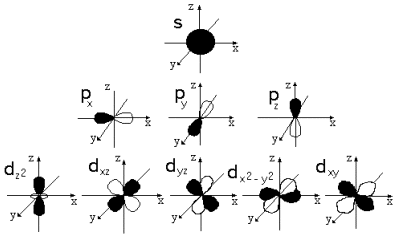
Орбитали.
3. Электронное облако. Формы атомных орбиталей. (Ответ сопровождать рисунками s-, p-, d- орбиталей и их обозначениями).
Ответ: Орбиталь – область пространства вокруг ядра, в которой вероятно пребывание электрона. Орбитали имеют разные формы, размеры и разную ориентацию в пространстве.
4. Квантовые числа.
Ответ: 1.Главное квантовое число (n=1, 2, 3, ∞) – опр-ет каким запасом энергии обладает электрон, т.е. на каком электр. слое (энерг.ур.) нах-ся электрон. Вывод: чем меньше n, тем меньшим запасом Е обл-ет электрон и нах-ся в энергетически более выгодном положении. 2. Орбитальное(азимутальное) квантовое число (L=0s, 1p, 2d, 3f, 4 (n-1)) – опр-ет на каком подслое (подуровне) нах-ся электрон и характеризует форму орбитали (s-, p-, d-, f- форма). 3. Магнитное (ориентационное) число (mL=+L, …, +2, +1, 0, -1, -2, …, -L) – опр-ет число орбиталей на конкретном подслое и хар-ет пространственную ориентацию орбитали. 4. Спиновое квантовое число электрона (ms=±1/2) ↑ms=+1/2 ↓ms=-1/2.
5. Энергетическая диаграмма многоэлектронного атома. Последовательность заполнения электронами орбиталей на диаграмме.
Ответ: 1S <2S2P <3S3P <4S ≈ 3D <4P <5S≈4D <5P <6S≈5D≈4F <6P и т.д. Заполнение d-орб. запаздывает на 1 период, f-орб. – на 2 периода.
6. Описание формы атомных орбиталей квантовыми числами. Описать форму орбиталей, хар-ся квантовыми числами: а) n=2, L=0, mL=0; б) n=4, L=2, mL = 0, ±1, ±2.
Ответ: а) n=2, L=0, mL=0 – на втором слое 1 подслой: s-подслой – 1 орбиталь. Общее число орбиталей: n2=4. б) n=4, L=2, mL = 0, ±1, ±2 – на 4-м слое 3 подслоя: s-подслой – 1 орбиталь, p-подслой – 3 орбитали, d-подслой – 5 орбиталей. Общее число орбиталей: n2=9.
8. Правило заполнения орбиталей электронами (а) принцип минимума энергии, б) принцип Паули, в) пр-ло Хунда).
Ответ: а) Электрон стремится занять орбиталь с наименьшей Е, т.е. в начале заполняется 1-ый уровень, затем 2-ой и т.д. б) В атоме не м.б. 2 электрона со всеми одинаковыми квантовыми числами, т.е. на одной орбитали будут нах-ся 2 электрона с антипараллельными спинами. в) Суммарное спиновое число электрона в пределах данного подслоя д.б. максимальным, т.е. зап-ют сначала по одному электрону, а затем по второму.
9. Электронные конфигурации (формулы атомов).
Ответ: Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
10. Правила, которыми определяется число орбиталей и электронов данного электронного слоя.
Ответ: Для определения электронной конфигурации элемента существуют следующие правила: принцип минимума энергии, принцип Паули, пр-ло Хунда (см. вопрос №8).
11. По какому признаку происходит деление элементов на s-, p-, d-элементы. Приведите пример электронной конфигурации и схему распределения электронов по орбиталям для s-, p-, d-элементов. Составьте валентные электронные конфигурации для этих элементов.
Ответ: Элементы, в атомах которых в последнюю очередь заполняется s-орбиталь – s-элементы, если p-орбиталь – p-элементы, если d-орбиталь – d-элементы.
S-элемент: 3 Li (Литий): 1s2 2s1. ВЭК:1s2 2s1
P-элемент: 15 P (Фосфор): 1s2 2s2 2p6 3s2 3p3. ВЭК: 3s2 3p3
D-элемент: 21 Sc (Скандий): 1s2 2s2 2p6 3s2 3p6 3d1 4s2. ВЭК: 3d1 4s2
12. Периодический з-н. Структура периодической системы. Группы, подгруппы, периоды. Периодичность св-в элементов.
Ответ: Д.И. Менделеев сформулировал сам закон: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от их атомного веса". Периоды – гориз. ряды, опр-ют элементы с одинаковыми значениями главного квантового числа n. № периода совпадает с числом энерг.уровней в атоме.
Группы – верт. ряды, объединяют элементы с одинаковым числом валентных электронов, т.е. № группы совпадает с числом открытых электронов атома.
К периодичным св-м атома отн-ся: ra – радиус атома, Еи – энергия ионизации, Еср – энергия сродства, ЭО – электроотрицательность.
13. Свойства атомов. Закономерности изменения св-в атомов по периодам и группам.
Ответ:
1. Атомный
радиус (ra)
– атом не имеет четко определенных
границ. Поэтому пол-ся понятием орбитальный
радиус свободного атома. Это расстояние
от ядра до максимума плотности внешних
электронных облаков. В периоде слева
направо с возрастанием заряда ядра
электроны сильнее притягиваются к ядру,
электр. облака сжимаются, т.е. ra
уменьшается.
Это касается s-,
p-,
d-,
f-элементов.
В группе у s-,
p-
элементов сверху вниз увел-ся число
энерг. уровней, а значит ra
увеличивается.
2. Энергия
ионизации
(Еи)
– энергия необходимая для удаления
электрона от нейтрального изолированного
атома находящегося в газообразном
состоянии. Э0(г)+ЕИ=Э+(г)
+ е-,
ЕИ =
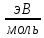 ,
,
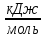 .
По периоду слева направо по мере
увеличения полож. заряда ядра и уменьшения
ra
– ЕИ
увеличивается (труднее оторвать
электрон). В группе у s-,
p-элементов
сверху вниз с увеличением числа энерг.ур.
ЕИ
уменьшается. 3. Сродство
с электронами
(Еср)
– энергетический эффект присоединения
электрона к нейтр. атому. При этом
образуется отриц. заряж. частица.
Э0(г)+e-=Э-(г)
± Еср.
Энерг.эффект присоединения м.б. полож.
или отриц. Когда Е выделяется Еср
<0 (“-”, экзопроцесс), когда Е поглощается
Еср
>0 (“-”, эндопроцесс). Наиб. сродство у
p-элементов
7 гр. (F,
Cl,
Br,
I,
At).
Наим. сродство у s-элементов
2 гр. В периоде слева направо способность
присоединять электрон усиливается. В
группе сверху вниз способность
присоединять электрон ослабевает.
.
По периоду слева направо по мере
увеличения полож. заряда ядра и уменьшения
ra
– ЕИ
увеличивается (труднее оторвать
электрон). В группе у s-,
p-элементов
сверху вниз с увеличением числа энерг.ур.
ЕИ
уменьшается. 3. Сродство
с электронами
(Еср)
– энергетический эффект присоединения
электрона к нейтр. атому. При этом
образуется отриц. заряж. частица.
Э0(г)+e-=Э-(г)
± Еср.
Энерг.эффект присоединения м.б. полож.
или отриц. Когда Е выделяется Еср
<0 (“-”, экзопроцесс), когда Е поглощается
Еср
>0 (“-”, эндопроцесс). Наиб. сродство у
p-элементов
7 гр. (F,
Cl,
Br,
I,
At).
Наим. сродство у s-элементов
2 гр. В периоде слева направо способность
присоединять электрон усиливается. В
группе сверху вниз способность
присоединять электрон ослабевает.
14. Электроотрицательность элементов. Закономерности изменения ЭО по периодам и группам.
Ответ: ЭО – способность атома оттягивать на себя электронную плотность по сравнению с атомом другого элемента в соединении. В химии исп-ют шкалы ЭО с целыми числами и с числами с одним знаком после запятой. По группе ОЭО снизу-вверх возрастает. В периоде слева направо ОЭО возрастает.
15. Как образуется химическая связь? Два механизма образования ковалентной связи (обменный и донорной-акцепторный). Показать механизмы на примере образования молекулы водорода.
Ответ:
В образовании хим. связи в основном
участвуют валентные электроны атома.
Между ядрами атома возникают
электростатические силы притяжения
двух типов: 1) хим. притяжение электронов
к ядрам; 2) силы отталкивания между
ядрами. Сущ-ет 3 типа хим. связи: ионная,
ковалентная, металлическая. 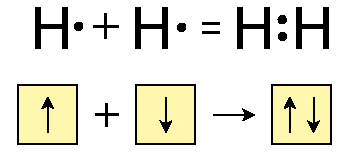
Ков.св: 1) Обменный механизм – тот случай, когда общая электронная пара образуется при взаимодействии непарных электронов с антипараллельными спинами, принадлежащих двум различным атомам. 2) Донорно-акцепторный – это образование ков. связи, когда один из атомов имеет не поделённую пару электронов (донор), а другой атом имеет свободную орбиталь (акцептор).
16.
Перекрывание атомных орбиталей (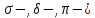 типа)
типа)
Ответ:
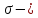 связь
образуется при перекрывании атомных
орбиталей вдоль линии связывания (1
область перекрывания).
связь
образуется при перекрывании атомных
орбиталей вдоль линии связывания (1
область перекрывания).
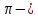 связь образуется при перекрывании
атомных орбиталей по разные стороны от
линии связывания (2 области перекрывания).
связь образуется при перекрывании
атомных орбиталей по разные стороны от
линии связывания (2 области перекрывания).
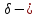 характерна
для d
орбитали (4 области перекрывания).
характерна
для d
орбитали (4 области перекрывания).
17. Свойства ковалентной связи (направленность, насыщаемость, поляризуемость).
Ответ: Характерные свойства ковалентной связи — направленность, насыщаемость, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов.
18. Основные положения теории валентных связей. Двухцентровые двухэлектронные связи. Валентные углы. Длина связи. Центральный атом молекулы. Координационное число центрального атома молекулы.
Ответ: Двухцентровая двухэлектронная связь в схемах изображается короткой линейной. В целом электронная структура молекулы выглядит как набор различных валентных схем, откуда вытекает второе название метода - метод локализованных пар. Валентный угол — угол, образованный направлениями химических (ковалентных) связей, исходящими из одного атома. Длина химической связи — расстояние между ядрами химически связанных атомов. В молекуле выделяют центральный и периферические атомы. Ц.а. в молекуле находится в ед.ч. Координационное число — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле. Под ним подразумевается число лигандов (атомов, молекул, ионов), которые образуют первую координационную (внутреннюю) сферу комплексообразователя.
19. Связывающие электронные пары. Несвязывающие электронные пары.
Ответ: Электронная пара — связанное состояние двух взаимодействующих электронов. Обладает нулевым спином и зарядом, равным удвоенному заряду электрона. Различают поделённые (связывающие) электронные пары, принимающие участие в образовании химической связи за счёт взаимодействия неспаренных электронов, и неподелённые электронные пары (внешние электронные пары), не принимающие участия в образовании химической связи.
20. Теория валентных связей (ТВС). Пространственные конфигурации молекул. Алгоритм определения пространственных конфигурации молекул и ионов.
Ответ: Теория валентных связей — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Конфигурация молекул, в стереохимии характеризует пространственное расположение атомов или групп атомов у асимметрического атома, у несимметрично замещенной двойной связи, у малого (жёсткого) цикла, у центрального атома в комплексах.
Для того чтобы определить строение молекулы предлагается следующий порядок действий:
1. На основании формулы молекулы определяется число лигандов n, с которыми центральный атом образует связь.
2. Находится общее число связывающих и неподелённых электронных пар.
3. Определяется пространственное расположение всех электронных пар (связывающих и неподелённых).
4. Находится число неподелённых электронных пар.
5. Устанавливается геометрия молекулы.
22. Полярные и неполярные химические связи, полярность и неполярность молекул.
Ответ: Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью. Полярные вещества́ в химии — соединения, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
24. Внутренняя энергия. Работа, совершаемая в системе.
Ответ: Внутренняя энергия системы складывается из энергии движения и взаимодействия ядер и электронов в атомах, а также из движения и взаимодействия молекул. Количество теплоты, сообщаемое термодинамической системе, равно сумме изменения ее внутренней энергии ΔU и работы A, совершаемой системой против внешних сил.
25. Энтальпия. Характер изменения энтальпии при экзо- и эндотермических процессах. Закон Гесса. Уметь вычислять энтальпию используя закон Гесса.
Ответ:
Энтальпия
— это та энергия, которая доступна для
преобразования в теплоту при определенном
постоянном давлении.![]()
Энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы. Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. ΔH>0 (эндопроцесс), ΔH<0 (экзопроцесс).
26. Энтропия и неупорядоченность системы. Уметь вычислять изменение энтропии при протекании реакции.
Ответ: Энтропия – количественная мера беспорядка. Если система из упорядоченного состояния переходит в неупорядоченное, то ΔSр-ции >0, такие реакции протекают самопроизвольно, и они энергетически выгодны. Если система из неупорядоченного состояния переходит в более упорядоченное, то ΔSр-ции <0.
Уравнения для расчета: ΔS0р-ции= ΔS0298(продуктов) - ΔS0298 (исходных веществ). ΔS0298 (простого вещества) ≠0.
27. Объясните какое из веществ обладает большей степенью порядка, если
NH3 (г) NO (г) NO2 (г)
S0298, Дж/моль 192,5 211 240,5
Ответ: Большей степенью порядка обладает NH3 (г), так как чем больше S0298, тем неупорядоченнее вещество.
28. Энергия Гиббса и самопроизвольное протекание реакций. Уметь вычислять изменение энергии Гиббса.
Ответ:
Свободная
энергия Гиббса
(или просто энергия Гиббса) — это
величина, показывающая изменение энергии
в ходе химической реакции и дающая таким
образом ответ на вопрос о принципиальной
возможности протекания химической
реакции. При
ΔG
<0 процесс может протекать, при ΔG
>0 процесс протекать не может (иными
словами, если энергия Гиббса в исходном
состоянии системы больше, чем в конечном,
то процесс принципиально может протекать,
если наоборот — то не может). Если
же, ΔG=0
то система находится в состоянии
химического
равновесия.
Уравнения для
расчета: ΔG0р-ции=
ΔG0298(продуктов)
- ΔG0298
(исходных веществ). ΔG0298
(простого
вещества) ≠0.![]()
29. Какие факторы, энтальпийный ил энтропийный, - определяют протекание процесса при: a) ΔH<0 и ΔS>0; б) ΔH<0 и ΔS<0; в) ΔH>0 и ΔS>0.
Ответ: а) оба фактора способствуют протеканию реакции (процесс возможен в прямом направлении и при любых температурах; б) энтальпийный (процесс протекает в прямом направлении при низких температурах); в) энтропийный (реакция протекает в прямом направлении при высоких температурах).
30. Рассчитайте изменение энергии Гиббса для следующей реакции: CO(г)+1/2O2(г)=CO2(г), если ΔH0298=-57,3 кДж и ΔS0298=-72,9 Дж/К. Возможно ли осуществление этой реакции при 25оС? Какой фактор – энтальпийный ил энтропийный, - определяет знак ΔG0298 этой реакции?
Ответ: ΔG0298= ΔH0298-T* ΔS0298=-57,3*103Дж-(273+25К)*(-72,9 Дж/К)=-35575,8 Дж/моль = -35,57 кДж/моль. Осуществление этой реакции при 25оС возможно, т.к. ΔG0298<0. Реакция протекает в прямом направлении при низких температурах (ΔH<0 и ΔS<0). Энтальпийный фактор определяет знак ΔG0298 этой реакции.
31. Используя з-н действующих масс, напишите выражения для константы гидролиза силикат-иона (при гидролизе силиката натрия) и иона алюминия (при гидролизе хлорида алюминия). В какую сторону будет смещаться равновесие этих реакций, если к раствору первой соли прибавить кислоту, а к раствору второй соли – щелочь?
Ответ:
32. Химическое равновесие. Константа химического равновесия.
Ответ:
Химическое
равновесие
— состояние химической системы, в
которой протекает одна или несколько
химических реакций, причём скорости в
каждой паре прямой-обратной реакции
равны между собой. Для системы, находящейся
в химическом равновесии, концентрации
реагентов, температура и другие параметры
системы не изменяются со временем. А2 +
В2 ⇄
2AB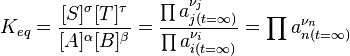
![]()
Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
33. Взаимосвязь константы равновесия и энергии Гиббса.
Ответ: Существует соотношение, связывающее изменение свободной энергии Гиббса в ходе химической реакции с её константой равновесия К:
ΔG = -RT*lnK, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
K= константа скорости прямой реакции / константа скорости обратной реакции.
34. Знаки изменения энтальпии и энтропии для процессов, находящихся в состоянии равновесия.
Ответ: Существует промежуточная область температур, в которой энтальпийный и энтропийный факторы уравновешивают друг друга: ΔH=TΔS, ΔG=0.
Наступает состояние химического равновесия, в уравнении реакции это обозначается:
ΔH<0 и ΔS<0
А2 + В2 ⇄ 2AB
ΔH>0 и ΔS>0
35. Формулировка принципа подвижного равновесия (принцип Ле Шателье).
Ответ: «Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.»
36. Влияние концентрации реагентов, температуры, давления на состояние равновесия.
Ответ:
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции (вправо);
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ (влево).
37. Предложите способы смещения равновесия в процессе синтеза аммиака из простых веществ, с учетом того, что это экзотермическая реакция.
Ответ: При 200 атм. и 400оС достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается. Значит, при повышении давления равновесие смещается в сторону образования NH3.
38. Ионизация кислот. Константа ионизации кислот. Сильные и слабые кислоты. Вопрос рассматривать на примере кислот углерода, азота, фосфора, серы, хлора, фтора, брома, иода. Названия кислот и кислотных остатков.
Ответ:
Ионизация
кислоты -
способность выделять протон. Ионизация
кислот обратима, поэтому константа
диссоциации зависит от электронной
конфигурации как кислоты, так и аниона.
В общей реакции,
AxBy⇄
xA+yB
где комплекс
AxBy
разбивается на x
единиц A и y
единиц B, константа диссоциации
определяется так: где [A], [B] и [AxBy] —
концентрации
A, B и комплекса AxBy
соответственно.![]()
Кa>108 – очень сильная, Кa=10-1-103 – сильная, Кa=10-2-10-3 – средняя, Кa=10-4-10-7 – слабая, Кa=10-8-10-11 – очень слабая.
Кислоты и их кислотные остатки: HCOOH – муравьиная к-та (HCOO- формиат), HNO2 – азотистая к-та (NO2- нитрит), H3PO4 – ортофосфорная к-та (PO43- фосфат), HCl – соляная к-та (Cl- хлорид), H2SO4 - серная к-та (SO42- сульфат), HF - плавиковая к-та (F- фторид), HI – йодоводород (I- йодид), HBr – бромоводород (Br- бромид).
39. Ионизация оснований. Константа ионизации оснований. Сильные и слабые основания. Вопрос рассматривать на примере оснований s-элементов I и II групп, а также на примере оснований p-, d-элементов периодической системы.
Ответ: Ионизация оснований вызвана сродством их молекул к протону растворителя и протекает тем полнее, чем больше сродство, т. е. чем сильнее основание. В общей реакции, AxBy⇄ xA+yB где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так: где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Если Kb >1*10-2, то основание сильное, все остальные слабые.
40.
Константа ионизации воды. Ионное
произведение воды. Водородный показатель
pH.![]()
Ответ: Вода представляет собой слабый электролит, диссоциирующий в соответствии с уравнением
Константа
диссоциации воды при 25 °C составляет![]()
предыдущее уравнение можно переписать в виде
![]()
Эта
величина называется ионным произведением
воды. Так как для чистой воды [H+]
= [OH−],
можно записать![]()
Водородный
показатель воды, таким образом, равен![]()
При
концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной. Наиболее
важное значение имеет автопротолиз
воды. Константа автопротолиза для воды
обычно называется ионным
произведением воды
и обозначается как
![]() .
Ионное произведение численно равно
произведению равновесных концентраций
ионов гидроксония и гидроксид-анионов.
Обычно используется упрощенная запись:
.
Ионное произведение численно равно
произведению равновесных концентраций
ионов гидроксония и гидроксид-анионов.
Обычно используется упрощенная запись:
В
стандартных условиях ионное произведение
воды равно 10−14. Оно является постоянной
не только для чистой воды, но также и
для разбавленных водных растворов
веществ. Автопротолиз воды объясняет,
почему чистая вода, хоть и плохо, но всё
же проводит электрический ток.![]()
41. Индикаторы (фиолетовый лакмус, метилоранж, фенолфталеин). Окраска индикаторов в различных средах.
Ответ:
|
|
Кислая среда |
Нейтральная |
Щелочная |
|
Фиолетовый лакмус |
Красный |
Фиолетовый |
Синий |
|
Метилоранж |
Бесцветный |
Бесцветный |
Малиновый |
|
Фенолфталеин |
Розовый |
Оранжевый |
Желтый |
42. Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей:
-
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
![]()
![]()
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
-
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
![]()
![]()
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
-
3. Гидролиз соли слабой кислоты и слабого основания:
