
- •Сборник задач по общей химии
- •Содержание
- •Предисловие
- •Тема 1. Способы выражения состава раствора Медико-биологическое значение темы
- •Основные параметры, характеризующие состав раствора
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 2. Титриметрические методы количественного анализа Кислотно-основное титрование. Оксидиметрия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 3. Химическая термодинамика. Химическое равновесие Медико-биологическое значение темы
- •Основные параметры, используемые для характеристики термодинамических процессов
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 4. Элементы химической кинетики Медико-биологическое значение темы
- •Основные кинетические параметры, характеризующие кинетические закономерности
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 5. Лигандообменные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 6. Редокс-процессы и редокс-равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 7. Осмотические свойства растворов
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 8. Свойства растворов электролитов Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 9. Гетерогенные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 10. Протолитические процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 11. Буферные растворы и их свойства Медико-биологическое значение темы
- •Задачи для самостоятельного решения
- •Тема 12. Физико-химия поверхностных явлений Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 13. Физико-химия дисперсных систем Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Приложение
- •Использованная литература
Задачи для самостоятельного решения
Задача 1. Рассчитайте емкость буферного раствора по кислоте, если при добавлении к 50 мл этого раствора 2 мл соляной кислоты с концентрацией 0,8 моль/л рН изменится от 7,3 до 7,0.
Ответ:
В![]() 0,107
моль/л.
0,107
моль/л.
Задача 2. Как изменится рН, если к ацетатному буферному раствору, состоящему из 100 мл кислоты и 100 мл соли, с концентрацией компонентов по 0,1 моль/л, прибавить 10 мл раствора с концентрацией соляной кислоты 0,1 моль/л? рКа(уксусной к-ты) = 4,76.
Ответ:
![]() рН
= 0,09.
рН
= 0,09.
Задача
3.
Как изменится рН фосфатного буферного
раствора, содержащего 100 мл раствора с
концентрацией дигидрофосфата натрия
0,1 моль/л и 300 мл раствора с концентрацией
гидрофосфата натрия 0,1 моль/л, при
добавлении к нему 20 мл раствора с
концентрацией гидроксида натрия 0,1
моль/л?
![]()
Ответ: от 7,687 до 7,812.
Задача 4. а) Рассчитайте буферную емкость по кислоте ацетатного буфера, состоящего из 100 мл раствора ацетата натрия с концентрацией 0,1 моль/л и 100 мл раствора уксусной кислоты с концентрацией 0,1 моль/л, если к этому раствору добавить 50 мл раствора соляной кислоты 0,01 моль/л.
б) Рассчитайте буферную ёмкость этого ацетатного буфера по основанию, если к этому раствору добавлено 50 мл раствора NaOH (С=0,01моль/л).
Ответ: Ва = 0,125 моль/л.ед.рН; Вb= 0,125 моль/л. ед. рН
Задача 5. Рассчитайте рН аммиачного буфера, если молярное соотношение компонентов NH4OH/NH4Cl = 2 : 3
Ответ: рН =9,6
Тема 12. Физико-химия поверхностных явлений Медико-биологическое значение темы
Сорбция играет важную роль в обмене веществ. Процессы абсорбции лежат в основе технологических процессов обработки пищевых продуктов, очистки лекарственных препаратов от примесей, очистки выбросов промышленных предприятий в окружающую среду.
Поступление питательных веществ и выведение продуктов метаболизма через клеточные мембраны подчиняются закономерностям распределения веществ между неполярной фазой липидного слоя мембран и полярными фазами внутри- и межклеточной жидкостей.
В медицине широко используется молекулярная адсорбция. Так, при отравлениях используется активированный уголь, способный адсорбировать газы, алкалоиды, барбитураты, токсины из пищеварительной системы. С помощью активированного угля осуществляют также сорбционную детоксикацию крови и лимфы (гемосорбция), пропуская их через адсорбент.
В санитарно-гигиенической практике адсорбция используется для очистки воды и сточных вод промышленных предприятий. Адсорбенты на основе природных глин используются в пищевой промышленности для очистки пищевых растворов: сиропов, масел, соков и т.д.
Ионообменная адсорбция используется для очистки воды, консервирования крови (удаления катионов кальция), детоксикации организма при отравлениях.
Исключительно важную роль в природе играют повехностно-активные вещества (ПАВ). Именно с помощью ПАВ в живых организмах обеспечивается гидрофильно-липофильный гомеостаз. Из молекул ПАВ образуются мицеллы в биологических жидкостях.
Хроматография - физико-химический метод разделения и анализа смесей веществ, основанный на процессах сорбции. Она широко применяется в медицине и биологии для идентификации веществ, для решения исследовательских, диагностических, клинических, токсикологических задач. Качественный и количественный анализ крови и мочи на присутствие в ней алкоголя, наркотиков, допинга осуществляется с помощью хроматографии за несколько минут. Для диагностики заболеваний желчного пузыря, печени, сердца, центральной нервной системы, сахарного диабета, гипертонической болезни определяют хроматографическим анализом жирные кислоты в определенных физиологических средах. В санитарии хроматография используется для контроля загрязнений окружающей среды.
Таблица 11. Основные параметры, используемые для характеристики поверхностных явлений
|
Параметр |
Обозначение, единица |
Смысловое значение |
|
Свободная поверхностная энергия |
GS, [Дж] GS = σ . S GS → min
|
Термодинамическая функция, характеризую-щая энергию межмоле-кулярного взаимодейст-вия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз. |
|
Удельная свободная поверхностная энергия (поверхностное натяжение)
|
σ, [Дж/м2] |
Поверхностное натяже-ние жидкости (удельная свободная поверхност-ная энергия). |
|
Поверхностное натяжение жидкости |
где σо –поверхностное натяжение воды; no- число капель воды; nж – число капель жидкости; mо –масса воды
|
Приведённая формула используется для расчёта поверхностного натяжения сталогмомет-рическим методом. |
|
Абсолютная адсорбция (удельная) |
|
Равновесное количество поглощаемого вещества, приходящееся на едини-цу поверхности раздела фаз или на единицу массы твердого вещества |
|
Относительная адсорбция на подвижной поверхности раздела фаз (уравнение Гиббса) |
где
|
Величина адсорбции отражает зависимость между поверхностной концентрацией адсорби-руемого вещества и его концентрацией в объёме раствора |
|
Поверхностная активность |
[Дж.м/моль] |
Способность растворён-ных веществ изменять поверхностное натяже-ние растворителя. |
|
Изотерма адсорбции (для неподвижной поверхности раздела фаз: газ – твёрдое , жидкость – твёрдое) |
Г- величина адсорбции; Г∞ предельная адсорбция С- равновесная концент-рация адсорбата; а- величина обратная константе адсорбцион-ного равновесия; |
Зависимость между величиной адсорбции и концентрации раствора при достижении адсорб-ционного равновесия в условиях постоянной температуры, выражают-ся уравнением Ленгмюра и Фрейндлиха |
|
Адсорбция из раствора на твёрдом адсорбенте |
[моль/г] |
Количество вещества адсорбированного дан-ной массой адсорбента. |
|
Правило Дюкло-Траубе |
|
Поверхностная актив-ность ПАВ в гомологи-ческом ряду возрастает в 3,0÷3,5 раза при удлине-нии углеводородного ра-дикала на одну группу -СН2- |


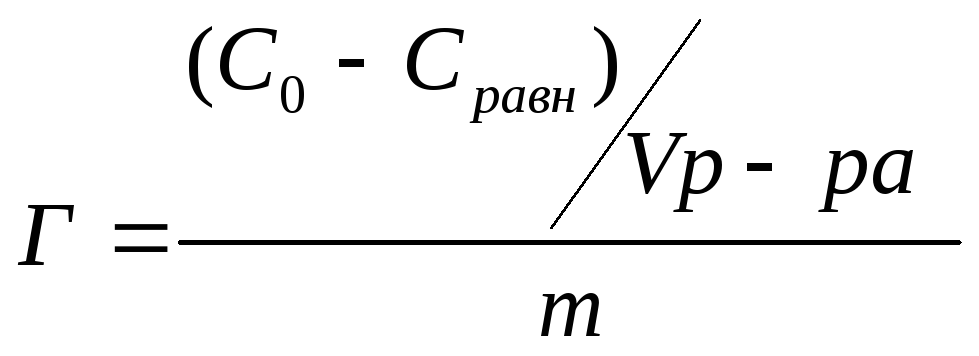 ,
,