
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •А Основные физиологические состояния организма и роль различных органов в интеграции метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление

Методы работы с белками 25
1.12 Методы работы с белками
Выделение и очистка белков требуют поддержания жестких условий, особенно кислотности среды (pH) и температуры. Методы фракционирования позволяют выделять белки на основе их растворимости, заряда, полярности, размера молекулы и сродства к определенным лигандам. Различия в растворимости позволяют выделять белки с помощью метода высаливания́ . Различия в массе белков и, следовательно, в скоростях седиментации позволяют фракционировать их с помощью ультрацентрифугирования. Хроматогра́фия — разделение растворенных молекул по скорости их продвижения через нерастворимую матрицу в хроматографической колонке — это метод очистки молекул на основе их заряда (ионообменная), гидрофобности (гидрофобная), размера (гель-фильтрационная) и специфичности к определенным молекулам (аффинная). Сродство белков и их элюция (вымывание из хроматографической колонки с помощью элюента) зависят от концентрации солей и pH. Электрофоре́з разделяет молекулы по их заряду и размеру. Электрофорез белков в полиакриламидном геле (SDS-PAGE) разделяет белки в основном по размеру молекул. Двумерный гелевый электрофорез (2D) может разделить тысячи различных белков.
А Очистка и выделение белка
Выделение и очистка — обязательный этап в изучении макромолекул, но он не так прост. Как правило, степень очистки вещества, доля которого в клетке составляет < 0,1%, должна быть доведена до 98%.
Поначалу проблема очистки белков, находящихся в клетке в следовых количествах, была настолько актуальна, что многие белки изучались лишь отчасти. Гемоглобин (1/3 сухого веса эритроцита) был едва ли не самым изучаемым белком. Большинство ферментов, участвующих в основных метаболических процессах или экспрессии генетической информации, присущи всем видам. Поэтому для удобства их выделяют из тканей крупного рогатого скота или клеток микроорганизмов, ставших классическими микробиологическими объектами — кишечная палочка Escherichia coli и пекар-
ские дрожжи Saccharomyces cerevisiae.
Современные методы позволяют выделить ген белка из желаемого организма, генетически модифицировать его и вставить в микроорганизм для большей экспрессии. Таким образом, можно добиться высокого «выхода» белка (его доля в результате может составить вплоть до 40% от всех белков микроорганизмов). Если количество белка в клетках организма слишком мало, то прибегают именно к таким методам.
26 |
Глава 1 |
Аминокислоты и белки |
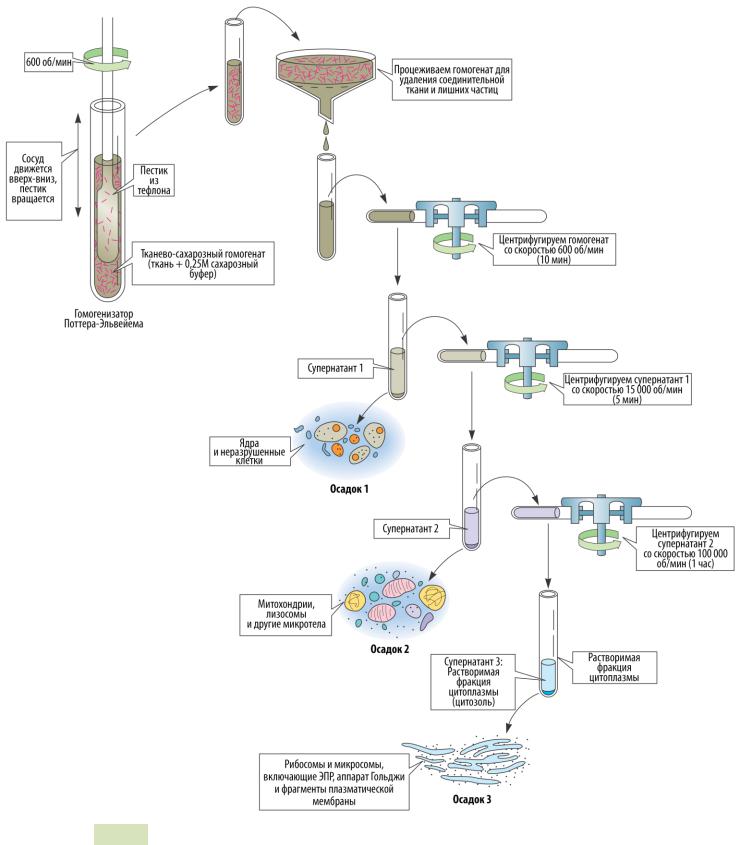
Рис. 21. Гомогенизация и дифференциальное центрифугирование
Первым шагом в выделении белка из клетки является его извлечение из клетки
враствор — гомогенизация́ . Несколько актуальных методов:
1.Первый метод основан на гомогенизаторе Поттера-Эльвейема— это толстостенная трубка, в которую вставляют пестик (трубка с насадкой).
Методы работы с белками 27
Давление и вращение пестика разрывает клетки и не нарушает структуру клеточных органелл.
2.Второй метод — использование звуковых волн для разрушения клеточных мембран (обычно — ультразвук).
3.Третий метод — разрушение клеток замораживанием и разморажи-
ванием. Если белок прочно связан с мембраной, следует добавить де-
тергенты, чтобы отделить его.
После гомогенизации клеток их подвергают дифференциальному центрифугированию (см. Рис. 21 ▲). Вращение образцов со скоростью, в 600 раз превышающей силу гравитации (600 g), приводит к выпадению в осадок (преципитированию) неразрушенных клеток и ядер (самые крупные частицы).
Если интересующий нас белок находится не в ядре, то этот преципитат (т.е. осадок) удаляется. Надосадочная часть (супернатант) центрифугируется повторно со скоростью уже 15 000 g. В осадок выпадают митохондрии. Наконец ещё более быстрое центрифугирование (100 000 g) позволяет получить в осадке микросомальную фракцию, состоящую из рибосом и фрагментов мембран. Если искомый белок растворим, то этот осадок удаляют, а супернатант подвергают дальнейшей очистке.
Б Высаливание
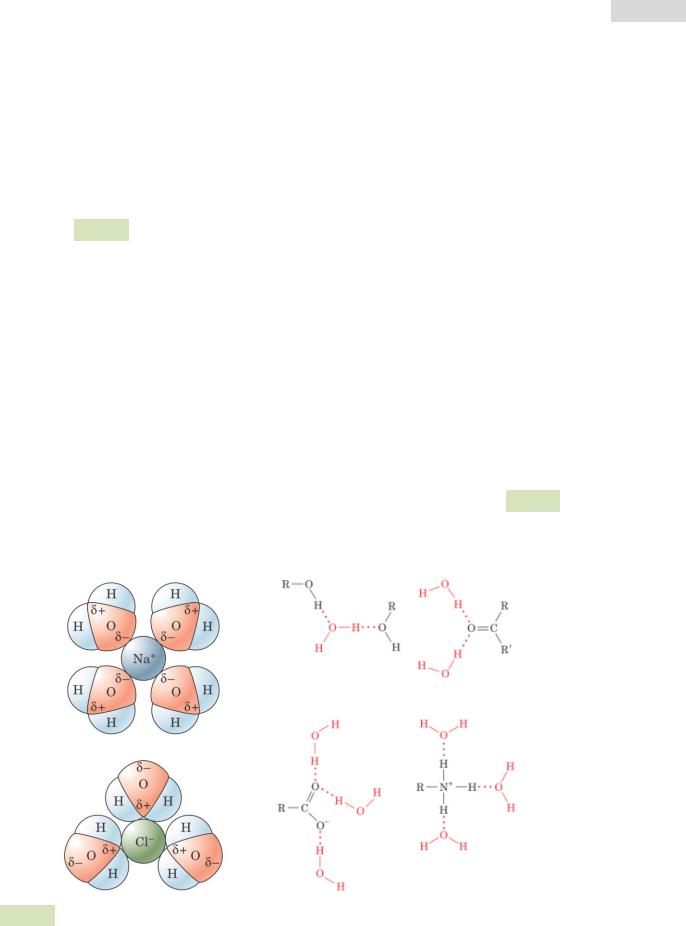
На этом этапе растворимые белки подвергают грубой очистке. Метод основан на свойстве растворимости молекул (и белков, в частности) в воде (см. Рис. 22 ▼). Все соединения растворяются благодаря своему взаимодействию с молекулами воды. Белки имеют различную растворимость в полярных и ионных растворах.
Рис. 22. Растворение ионов в воде: образование ионных и водородных связей.
При добавлении солей к раствору белков, часть молекул воды «отнимается» у белков и образует ионные связи с солями. Как правило, в качестве соли используют сульфат аммония (NH4)2SO4. При этом концентрация доступных для белков молекул
28 |
Глава 1 |
Аминокислоты и белки |
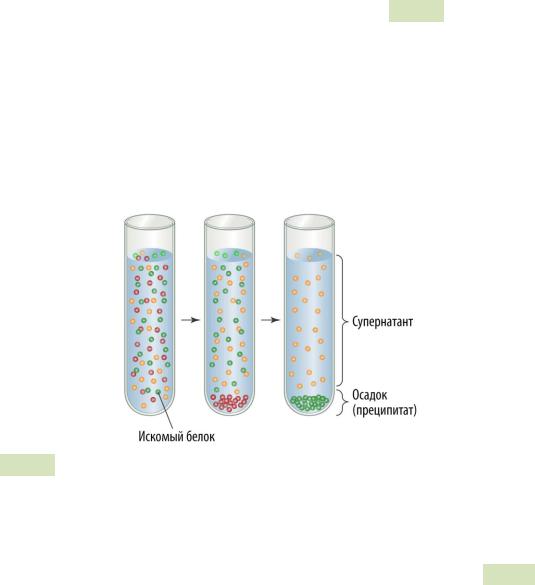
воды снижается, и белки начинают взаимодействовать друг с другом с помощью гидрофобных связей и постепенно выпадают в осадок (см. Рис. 23 ▼). Чтобы ускорить этот процесс, раствор центрифугируют. Поскольку белки имеют различный ионный и гидрофобный состав (зависит от последовательности аминокислот в белках), они осаждаются при разной концентрации солей. Та концентрация, при которой искомый белок осаждается, называется точкой преципитации́ . Обычно в раствор добавляют сульфат аммония до 40% насыщения, осаждают белки с помощью центрифугирования. Далее снова используют супернатант и доводят степень насыщения до 6070%. Формирующийся осадок часто содержит искомый белок. Процесс ускоряют центрифугированием, осадок растворяют в минимальном объёме буферного раствора.
Рис. 23. Высаливание.
В Диализ
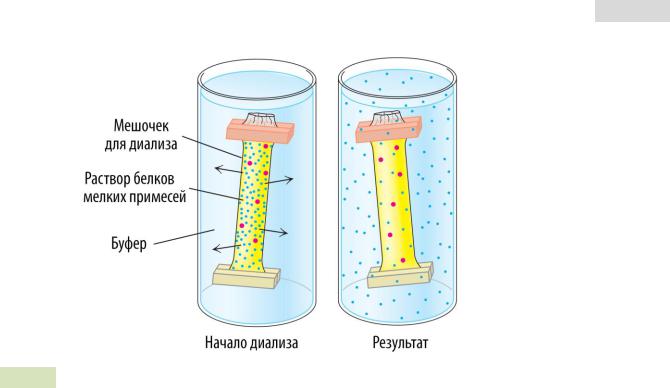
После высаливания раствор с белком подвергают диа́лизу: его переливают в целлофановый мешочек, который погружают в буферный раствор (см. Рис. 24 ▼). Целлофановая мембрана полупроницаема. Белки с большой молекулярной массой слишком велики, чтобы диффундировать через поры в этой мембране, однако остаточные соли (например, сульфат аммония и некоторые др.) выходят наружу в буферный раствор, а внутрь попадают буферные соли.
Вышеописанные методы не позволяют выделить чистый белок, однако они представляют собой важный этап в подготовке образцов для дальнейшей работы.
Методы работы с белками 29
Рис. 24. Диализ.
ГХроматография
Как правило, для точного фракционирования белков используют методы хроматографии. Виды хроматографии классифицируют на основании используемой твёрдой матрицы (твердый материал, которым заполняют хроматографическую колонку). Примеры матриц и элюентов даны ниже.
Колоночная́ хроматография часто используется для разделения смеси белков (фракционирования). В цилиндрическую колонку, наполненную нерастворимым материалом или синтетическими гранулами («стационарная» фаза), наливают растворитель, затем раствор белка и вымывают его с помощью элюента́ («мобильная фаза»). Элюент может быть тем же растворителем, однако его можно и заменить более полярным раствором для ускорения процесса. При этом элюент будет конкурировать с белками за матрицу, связываясь с ней прочнее, а белки — двигаться вниз. По мере продвижения всего раствора белков через колонку внизу собирают элюа́т (жидкость, выделяющаяся из колонки). Скорость, с которой белки продвигаются через твёрдую матрицу (стационарную фазу) зависит от тех взаимодействий, в которые они вступают с ней. Различные белки элюируют с разной скоростью. Как правило, более полярные белки дольше задерживаются в колонке, поскольку между ними и матрицей образуются нековалентные химические связи. Концентрация белка в каждой фракции может быть измерена с помощью пропускания через раствор УФ-света с длиной волны 280 нм (фотометри́я). Чтобы понять, в какой именно фракции находится очищаемый белок, фракции проверяют на биологическую активность (особенно актуально для ферментов, т.е. к ним добавляют их субстрат, и определяют, появился ли в среде продукт, так делают вывод о наличии фермента во фракции).
Колоночная хроматография была компьютеризирована и сейчас осуществляется под большим давлением с помощью плотно упакованных колонок с растворителем. Этим процессом управляет оператор с помощью компьютера. Такой метод по-
лучил название высокопроизводительной жидкостной хроматографии.
30Глава 1 Аминокислоты и белки
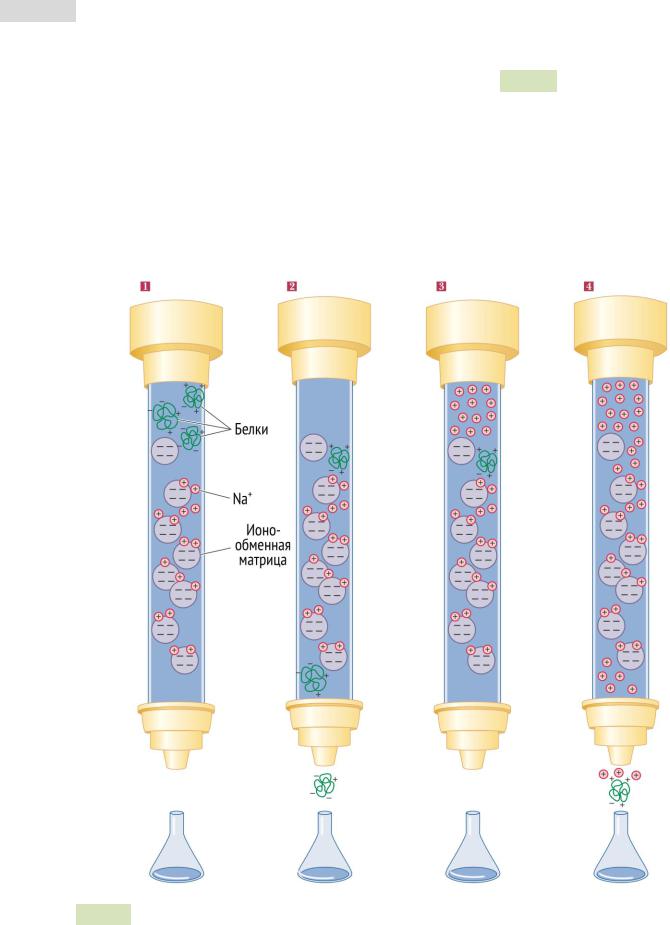
Вионообменной хроматографии матрица заряжена положительно (анионообменная) или отрицательно (катионообменная) (см. Рис. 25 ▼). Анионообменная матрица связывает отрицательно заряженные белки и задерживает их в колонке для последующего элюирования. Схожим образом, катионообменная матрица взаимодействует с положительно заряженными белками. Связанные с матрицей белки могут быть элюированы (вымыты из колонки) постепенным повышением концентрации соли в растворе. Когда концентрация солей достигнет нужной отметки, соли будут прочнее и быстрее связываться с матрицей (соли тоже имеют заряд), тем самым взаимодействие белков с твердой фазой будет нарушено, и они будут элюированы из колонки.
Рис. 25. Ионообменная хроматография. 1) В колонку вносят раствор с белками. Матрица связана с ионами Na+. 2) Белки, общий заряд которых нейтрален или отрицателен, легко вымываются из колонки. Белки, заряженные положительно, взаимодействуют с матрицей и вытесняют ионы Na+. 3) Избыток ионов Na+добавляется в колонку. 4) Теперь уже они вытесняют белки, связываясь с матрицей. Белки элюируют.
Методы работы с белками 31
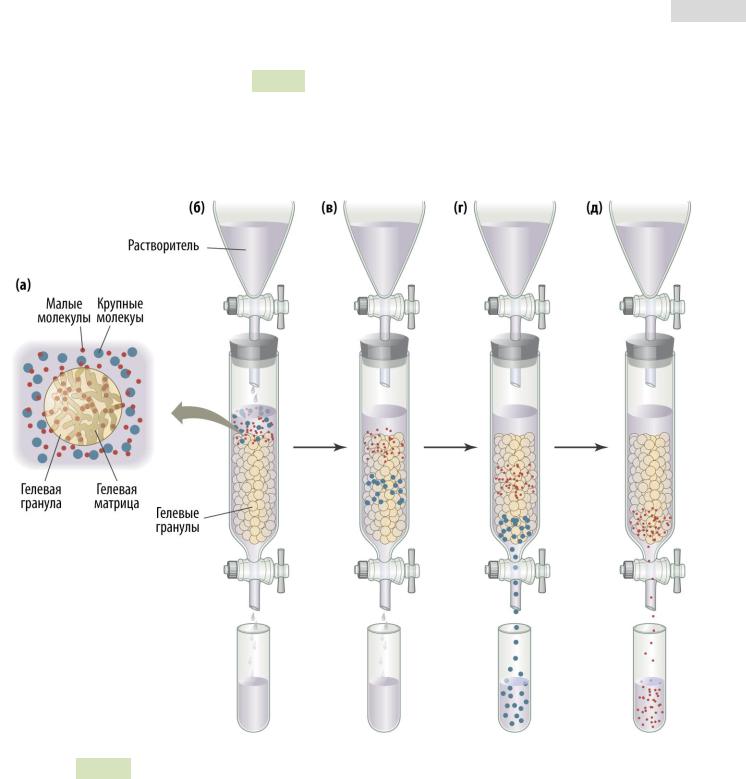
Гельфильтрационная (или эксклюзионная) хроматография разделяет белки на основании их размера (см. Рис. 26 ▼). Матрицей служит особый пористый гель. Малые белки проникают в поры геля и задерживаются там. Большие белки в поры не попадают и потому быстро минуют стационарную фазу, слабо контактируя с ней. Чем меньше размер белка, тем позднее он вымывается из колонки. Большие белки элюируются быстрее.
Рис. 26. Гельфильтрационная хроматография. (а) Гелевые гранулы имеют поры
(гелевую матрицу). Малые молекулы свободно попадают в них. Крупные молекулы не проникают в гелевые гранулы. (б) Сверху в колонку подают раствор, содержащий образец. (в) Малые молекулы проникают в гель и мигрируют медленнее, чем крупные. (г и д) Сначала элюируют (вымываются из колонки) крупные молекулы. Малые молекулы требуют бо́ льшего объёма растворителя.
32 |
Глава 1 |
Аминокислоты и белки |
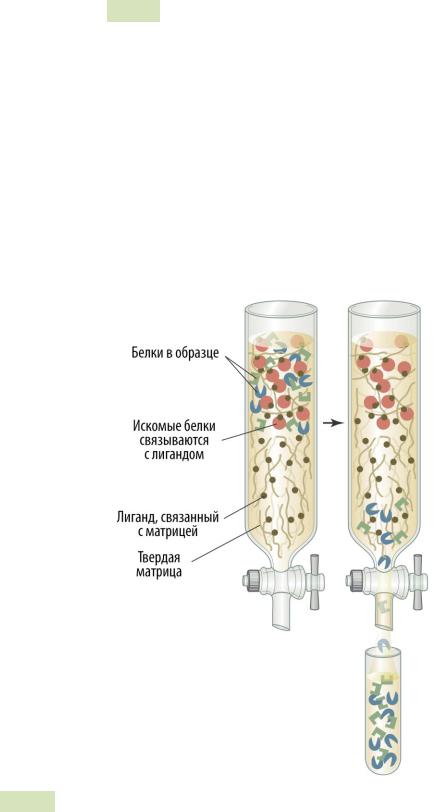
Аффи́нная хроматография — самая специфичная из всех видов хроматографии. Она основана на взаимодействии молекул белков со специфичными только к ним лигандами́ (см. Рис. 27 ▼). Этим лигандом может быть: субстрат, который связывается с белком in vivo; антитело, специфичное к нему; другой белок, который имеет свойство связываться с искомым (см. таблицу ниже). По мере прохождения смеси белков через колонку только искомый белок специфически связывается с матрицей. Колонку несколько раз промывают буферным раствором, чтобы вывести из неё все остальные белки. Затем в колонку добавляют соли в высокой концентрации, которые активнее вступают во взаимодействие с матрицей и нарушают её связи с необходимыми нам белками. Белки диссоциируют от матрицы и вымываются (элюируют). Иногда используют не соли, а раствор того же лиганда (отметим, что в колонке уже есть этот лиганд, но он связан с неподвижной матрицей — специальным твердым инертным материалом). Этот лиганд также вступает во взаимодействия с молекулами белков. Этот способ эффективен, когда лиганд является небольшой по размерам молекулой. Аффинная хроматография очищает белки в 1 000–10 000 раз.
Рис. 27. Аффи́ нная хроматография.
