
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •А Основные физиологические состояния организма и роль различных органов в интеграции метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление
Врожденный (неспецифический) иммунитет 163
Результат лектинового пути: формируется активный комплекс C4b2a; C3b связывается с мембраной патогена.
Е Классический путь активации комплемента
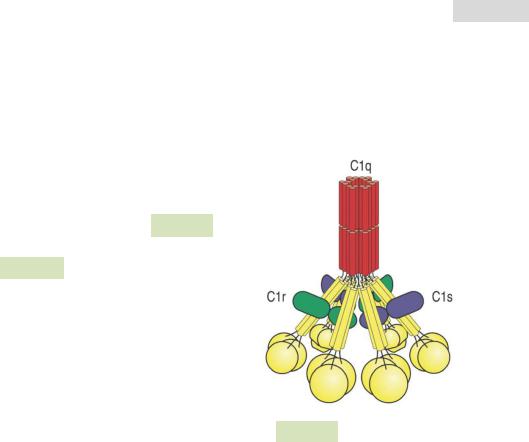
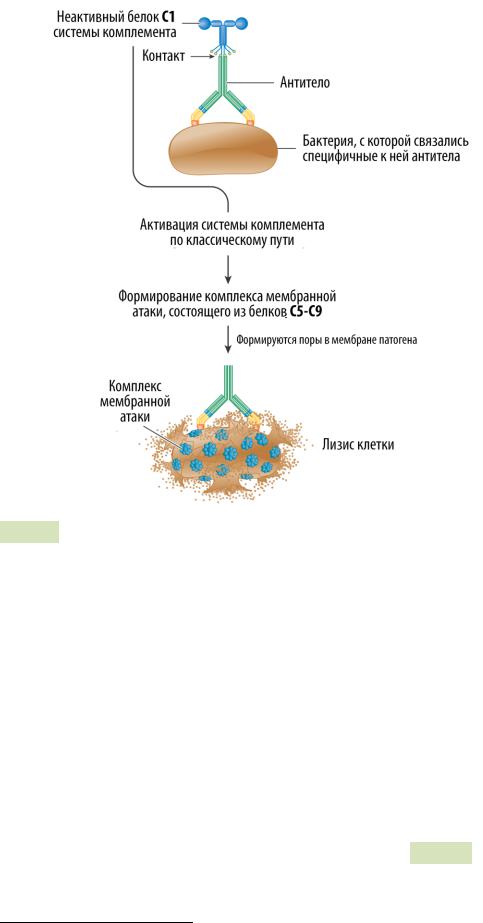
Классический путь активации комплемента напоминает лектиновый: он тоже использует «молекулусенсор» для узнавания патогенов, но в этом пути эту роль играет комплекс C1 или просто C1 (см. Рис. 100 ). Этот комплекс взаимодействует как с самим патогеном, так и с антителами (см. Рис. 101 ▼), поэтому классический путь активации комплемента участвует не только в неспецифическом иммунном ответе, но и в специфиче-
ском. Комплекс C1 состоит из большого белка C1q, узнающего патогены, и двух неактивных сериновых протеаз
— C1r и C1s:
Этапы активации:
1.Комплекс C1 связывается с лигандом (патогеном или комплексом антитело + патоген). Активируется C1r, который переводит про-
теазу |
C1s |
в |
активное |
состояние: |
C1 + лиганд → C1r C1s*. |
|
|||
Рис. 100. Строение комплекса C1.
2.C1s расщепляет C4 до C4a и C4b. Последний связывается с мембраной и
C2.
3.C1s расщепляет C2 до C2a и C2b. Образуется активный комплекс C4b2a
(C4b + C2a).
4.Комплекс C4b2a — это активная C3-конвертаза, расщепляющая C3 на C3a и C3b. C3b связывается с мембраной патогена.
Результат классического пути: формируется активный комплекс C4b2a; C3b связывается с мембраной патогена.
164 |
Глава 9 |
Иммунитет и антитела |
Рис. 101. Активация системы комплемента по классическому пути комплексом антиген-антитело.
Ж Альтернативный путь активации комплемента
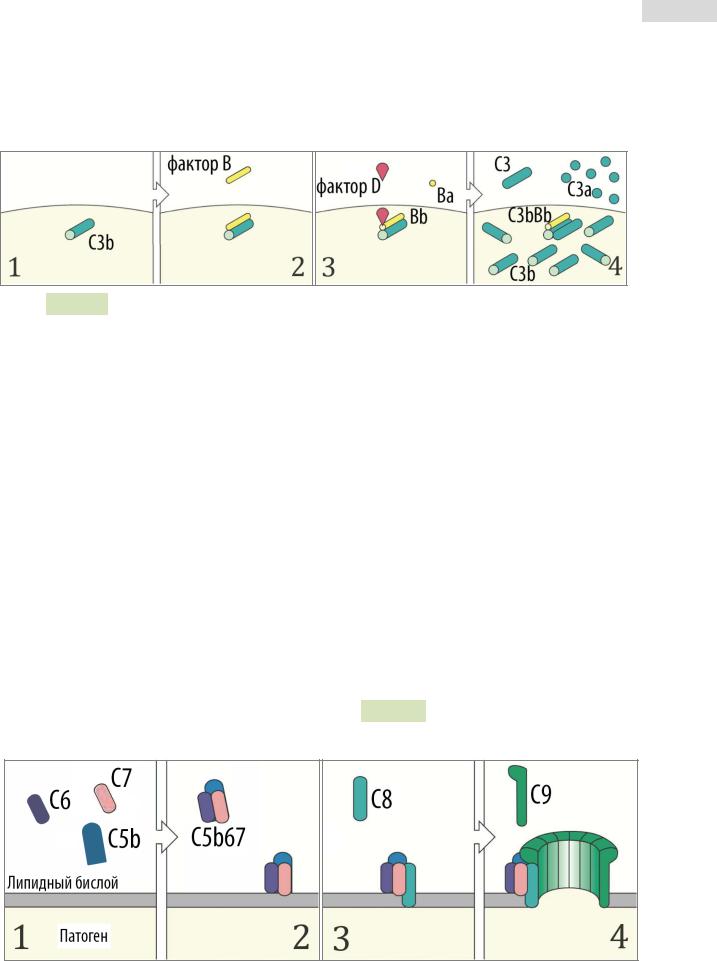
Этапы активации:
1.Белок C3 («си-три» или «це-три») попадает в кровь из печени и время от времени спонтанно активируется (C3*) с помощью гидролиза тиоэфирной связи внутри молекулы.
2.Активированный C3* связывается с фактором B.
3.Фактор D расщепляет фактор B на факторы Ba и Bb.
4.Комплекс C3*Bb представляет собой нестабильную C3-конвертазу13 , расщепляющую неактивные белки C3 на C3a и C3b. Последний быстро инактивируется, если не контактирует с мембранами патогенов. Однако, если такой контакт происходит, C3b связывается с фактором B, который снова расщепляется фактором D на Ba и Bb (см. Рис. 102 ▼).
5.Образуется комплекс C3bBb — он является уже стабильной C3конвертазой, расщепляющей неактивные белки C3 на C3a и C3b. С3b
13C3-конвертаза стабильна лишь некоторое время, однако она стабилизируется белком пропердином (фактор P), который секретируют нейтрофилы в присутствии патогенов.
Врожденный (неспецифический) иммунитет 165
быстро покрывают поверхность мембраны патогена. Происходит активация терминальных компонентов комплемента (см. раздел 10).
Результат альтернативного пути: формируется активный комплекс C3bBb;
C3b связывается с мембраной патогена.
Рис. 102. Активация комплемента по альтернативному пути.
З Активация терминальных компонентов комплемента
Все три пути активации комплемента сходятся на этапе образования C3конвертазы. Следующим этапом является формирование активной C5-конвертазы.
1. C5-конвертаза формируется так:
а. В классическом и лектиновом пути C4b2a связывается с C3b. Образуется C4b2a3b.
б. В альтернативном пути C3bBb связывается с C3b. Образуется
C3b2Bb.
Комплексы C4b2a3b и C3b2Bb представляют собой активные C5-
конвертазы.
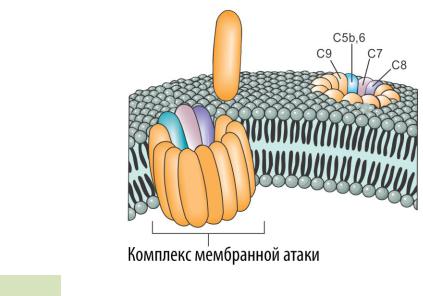
2.C5-конвертаза связывается с белками C5 и расщепляет их на C5a и C5b.
3.C5b связывается с C6.
4.Комплекс C5b6 (C5b + C6) связывается с C7.
5.Далее происходит последовательное связывание комплекса C5b67 с белками C8 и C9.
6.Ключевую роль в формировании комплекса мембранной атаки играют 10-16 молекул белка C9 (см. Рис. 103 ▼). Именно они и образуют мембранную литическую пору.
166 |
Глава 9 |
Иммунитет и антитела |
Рис. 103. Формирование комплекса мембранной атаки.
И Как фагоциты отличают чужеродные клетки от «своих»?
Безусловно, фагоциты должны отличать патогенные клетки от клеток своего организма. Для этого существует два механизма:
1.У фагоцитов на поверхности мембран находятся особые Толл-подоб- ные рецепторы. Эти рецепторы «узнают» вещества, содержащиеся в мембранах патогенов — молекулярные особенности патогена, называе-
мые PAMP (англ. pathogen-associated molecular patterns). Наиболее из-
вестными из них являются липополисахариды (ЛПС) грамотрицательных бактерий и пептидогликаны клеточных стенок грамположительных бактерий. Взаимодействие Толл-подобных рецепторов с патогенами (или чужеродными веществами) стимулирует секрецию фагоцитирующими клетками цитокинов (регуляторных молекул):
а. Привлекают к месту обнаружения патогена другие клетки имму-
нитета — нейтрофилы и моноциты, а также T- и B-лимфоциты;
б. Активируют другие механизмы врожденного иммунитета — фа-
гоцитоз и лихорадку.
2.В организме человека синтезируются особые вещества, «помечающие» патогены для фагоцитирования — опсонины. Важнейшие опсонины —
антитела и белки системы комплемента (например, белки C3b). Опсо-
нины обеспечивают более тесный и надёжный контакт между фагоцитом и патогеном.
КВещества, секретируемые фагоцитами
Наиболее важные вещества, секретируемые фагоцитами:
1.Макрофаги секретируют оксид азота NO, токсичный для бактериальных клеток.
