
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •А Основные физиологические состояния организма и роль различных органов в интеграции метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление
120 |
Глава 6 |
Трансляция |
релиз-факторы (RF-белки). Они способствуют диссоциации рибосом на две субъединицы — малую и большую.
Д Этап 5. Фолдинг и посттрансляционная модификация
Любой полипептид должен принять нативную конформацию для достижения биологической активности. До или после фолдинга белок должен подвергнуться ферментативному процессингу — отщеплению нескольких аминокислот с конца цепи (обычно с N-конца), присоединению ацетильной, метильной, карбоксильной или другой химической группы (и часто не одной), протеолизу (отщеплению целой части цепи) или присоединению олигосахаридов или каких-либо других простетических групп.
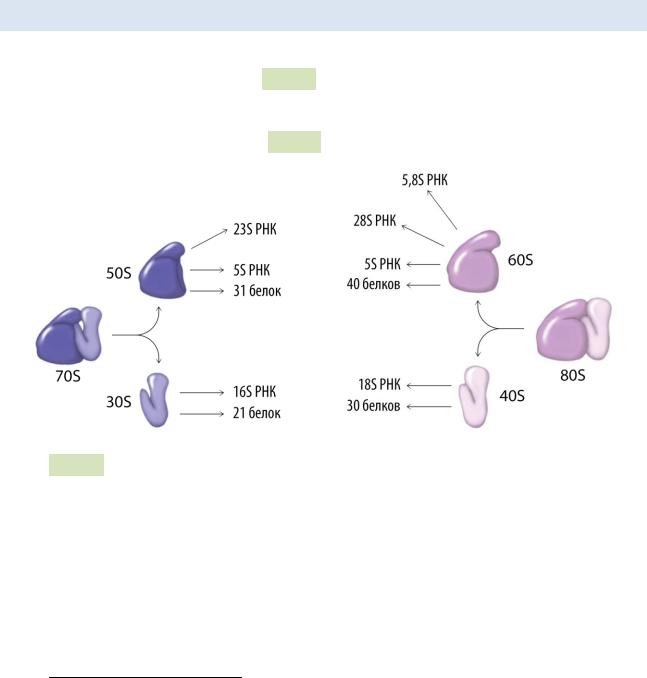
6.4 Рибосомы
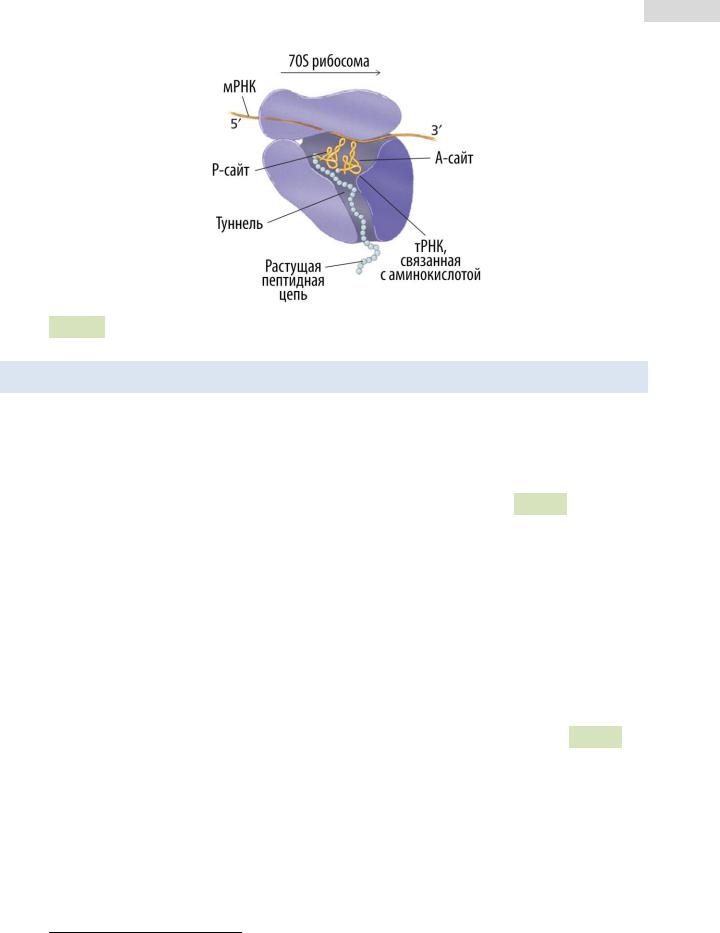
Рибосомы — это крупные рибонуклеопротеидные комплексы, состоящие из большой и малой субъединицы (см. Рис. 79 ▼). В состав рибосом входят рРНК и белки. Собранные и активные рибосомы имеют 3 сайта: А-сайт (сайт связывания с амино-
ацил-тРНК), Р-сайт (сайт, в котором находится пептидил-тРНК8) и Е-сайт (сайт, в
котором деацилируется тРНК) (см. Рис. 80 ▼).
Рис. 79. Строение про- и эукариотической рибосомы: слева — прокариотическая
70S рибосома (состоит из большой 50S и малой 30S субъединиц), справа — эукариотическая 80S рибосома (состоит из большой 60S и малой 30S субъединиц).
8 Пептидил-тРНК — транспортная РНК, связанная с синтезируемой пептидной цепью.
Инициация у прокариот 121
Рис. 80. Сайты связывания тРНК у прокариотической рибосомы.
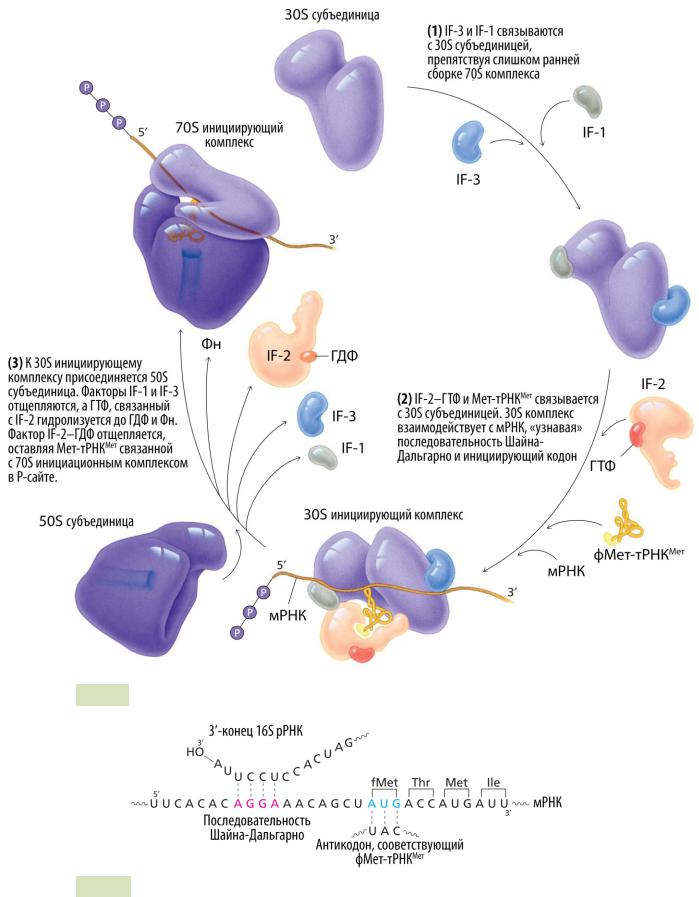
6.5 Инициация у прокариот
Инициация — это первая стадия трансляции, в ходе которой происходит сборка 70S рибосомы (инициаторного комплекса), узнавание старт-кодона AUG9 (кодирует аминокислоту формилметионин10), установка рамки считывания и связывание с формилметионил-тРНКМет (транспортная РНК, несущая остаток формилметионина)
вP-сайте рибосом. Инициация происходит в несколько этапов (см. Рис. 81 ▼):
1.Рибосомы находятся в диссоциированном состоянии перед трансляцией, то есть обе субъединицы разделены, и с 30S субъединицей рибосом связан фактор IF-3, препятствующий сборке 70S комплекса.
2.Факторы IF-1, IF-2–ГТФ и мРНК связываются с 30S субъединицей в произвольном порядке. Связывание формилметионил-тРНК с 30S субъединицей происходит не по принципу кодон-антикодоновой комплементарности, а благодаря взаимодействию с фактором IF-2. Фактор IF-3 способствует связыванию мРНК с 30S комплексом. Затем 16S рРНК малой субъединицы ри-
босом «находит» на мРНК последовательность Шайна-Дальгарно (5’ –
GGAGGU– 3’), связывается с ней по принципу комплементарности и устанавливает рамку считывания на инициирующий кодон AUG (см. Рис. 82 ▼).
3.50S субъединица присоединяется к 30S инициаторному комплексу. Факторы IF-1 и IF-3 отщепляются. ГТФ, связанный с IF-2, гидролизуется до ГДФ и Фн (неорганический фосфат). Комплекс IF-2 + ГДФ диссоциирует от 70S рибосомы, связанной в P-сайте с формилметионил-тРНК.
9В роли старт-кодона у прокариот может выступать не только AUG (83% генов), но и GUG (14% генов; кодирует валин), и UUG (3% генов; кодирует лейцин).
10Формилметионин — аминокислота метионин, связанная с формильной группой (—
CHO).
122 |
Глава 6 |
Трансляция |
Рис. 81. Инициация трансляции у прокариот.
Рис. 82. Узнавание последовательности Шайна-Дальгарно у E. coli.
Инициация у эукариот 123
6.6 Инициация у эукариот
Инициация у про- и эукариот схожа, однако есть и различия:
1.Эукариотическая 40S субъединица рибосом связывается с факторами eIF1A и eIF-3. Затем к 40S частице присоединяется фактор eIF-2 + ГТФ + меттРНК. Формируется преинициационный комплекс 43S.
2.43S комплекс связывается с факторами eIF-4E, eIF-4G, eIF-4A, eIF-4B и мРНК в области 5’-кэпа. У эукариотических мРНК отсутствует последовательность Шайна-Дальгарно, поэтому у них существует сканирующий механизм обнаружения старт-кодона AUG11. eIF-40S комплекс движется по
цепи мРНК до т.н. последовательности Ко́зака (–3–ACCAUGG–+4). Рибо-
сома может пропустить первый встретившийся ей кодон AUG, если он не образует последовательность Козака. В конце данного этапа формируется 48S комплекс.
3.Происходит гидролиз ГТФ, факторы инициации отщепляются, присоединяется 60S субъединица и формируется 80S инициационный комплекс.
6.7Элонгация у прокариот
Элонгация — это вторая стадия трансляции, на которой синтезируется сама полипептидная цепь. Элонгация включает три важнейших этапа:
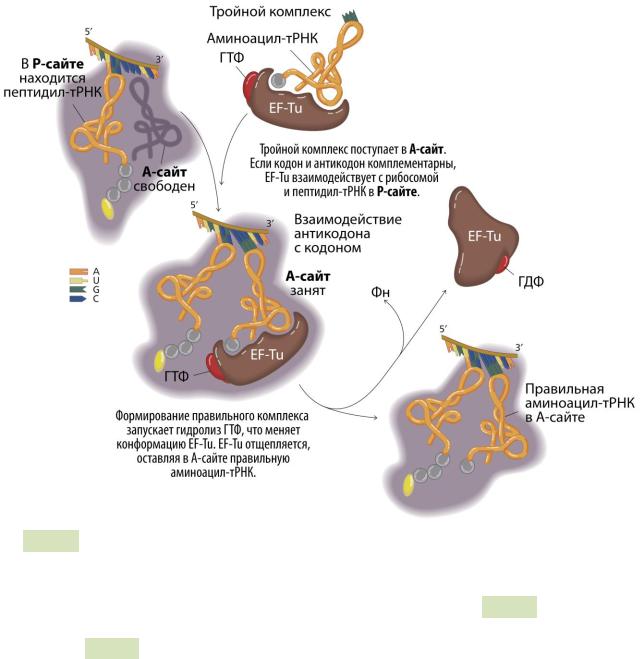
1.Декодирование (связывание аминоацил-тРНК, несущей аминокислоту) (см. Рис. 83 ▼). После инициации в P-сайте рибосомы уже находится инициирующая формилметионил-тРНК. В А-сайте происходит связывание второй аминоацил-тРНК, комплементарной своим антикодоновым участком кодону в мРНК. В этом процессе участвует фактор EF-Tu, направляющий аминоацил-тРНК в А-сайт. Если антикодон на аминоацил-тРНК оказывается комплементарен кодону на мРНК, происходит стабилизация комплекса EF-Tu + ГТФ + аат-тРНК и гидролиз ГТФ до ГДФ и Фн. EF-Tu + ГДФ диссоциирует от рибосомы, связывается с фактором EF-Ts. ГДФ обменивается на ГТФ и EF-Ts отщепляется от EF-Tu.
11Кодон AUG у эукариот кодирует аминокислоту метионин (не формилметионин, как
упрокариот).
124 |
Глава 6 |
Трансляция |
Рис. 83. Элонгация трансляции у прокариот: декодирование и «вставка» аминоа-
цил-тРНК в А-сайт.
2.Транспептидация (образование пептидной связи) (см. Рис. 84 ▼). Происходит образование пептидной связи по механизму нуклеофильной атаки (см. Рис. 85 ▼). Реакция катализируется пептидилтрансферазным центром большой субъединицы рибосом (катализируется не белком, а молекулой РНК в составе рибосом). Растущая полипептидная цепь оказывается связанной с тРНК в А-сайте. В Р-сайте находится уже свободная тРНК.
3.Транслокация (перемещение мРНК относительно рибосомы на один кодон). Третий фактор элонгации EF-G + ГТФ связывается с рибосомой. Происходит гидролиз ГТФ до ГДФ и Фн. EF-G + ГДФ отщепляется, происходит транслокация мРНК относительно рибосомы. То есть именно цепочка мРНК движется относительно неё, а не наоборот. Свободная тРНК перемещается из P-сайта в E-сайт. Пептидил-тРНК переносится из A-сайта в P-
сайт. А-сайт остаётся свободным.
Элонгация — циклический процесс. Он повторяется ровно столько раз, сколько кодонов находится между старт- и стоп-кодоном в цепи мРНК.
