
- •И. В. Мозговой, г. М. Давидан, л.Н. Олейник
- •Предисловие
- •Тема 1.
- •1.1. Краткая история нефтепереработки
- •1.2. Происхождение нефти
- •1.3. Мировые запасы нефти
- •1.4. Добыча нефти
- •1.5. Добыча природных газов
- •Контрольные вопросы
- •2.2. Химический состав нефти
- •2.3. Классификация нефтей
- •Контрольные вопросы
- •Тема 3.
- •3.1. Фракционный состав нефтей
- •3.2. Плотность
- •3.3. Молекулярная масса
- •3.4. Вязкость
- •3.5. Низкотемпературные свойства нефти и нефтепродуктов
- •3.6. Пожароопасные и взрывоопасные свойства нефтепродуктов
- •3.7. Оптические свойства нефти и нефтепродуктов
- •3.8. Электрические свойства нефтепродуктов
- •3.9. Тепловые свойства нефтепродуктов
- •Контрольные вопросы
- •Тема 4.
- •4.1. Газообразные алканы
- •4.2. Жидкие алканы
- •4.3. Твердые алканы
- •4.4. Физические свойства алканов
- •4.5. Химические свойства алканов
- •Контрольные вопросы
- •Тема 5.
- •5.1. Физические свойства циклоалканов
- •5.2. Химические свойства циклоалканов
- •5.3. Получение циклоалканов
- •5.3.2. Получение циклогептана
- •5.3.4. Получение циклододекана
- •Контрольные вопросы
- •Тема 6.
- •6.1. Типы аренов и концентрация их в нефтях и их фракциях
- •6.2. Физические свойства аренов
- •6.3. Химические свойства
- •6.3.3. Окисление
- •6.4. Применение аренов в нефтехимии
- •Контрольные вопросы
- •Тема 7.
- •7.1. Сернистые соединения
- •7.2. Азотистые соединения
- •7.3. Кислородсодержащие соединения
- •7.4. Асфальто-смолистые вещества
- •7.5. Микроэлементы
- •Контрольные вопросы
- •Тема 8.
- •8.1. Введение в теорию
- •8.2. Кинетика и механизм термических процессов
- •8.3. Термические превращения углеводородов в газовой фазе
- •8.4. Пиролиз (высокотемпературный крекинг)
- •8.5. Коксование
- •8.6. Промышленные термические процессы
- •Контрольные вопросы
- •Тема 9.
- •9.1. Основные понятия о катализе и катализаторах
- •9.2. Реакции карбкатионов
- •9.3. Каталитический крекинг
- •9.4. Катализаторы каталитического крекинга
- •9.5. Макрокинетика процесса
- •9.6. Промышленный каталитический крекинг
- •Контрольные вопросы
- •Тема 10.
- •10.1. Химизм процесса
- •10.2. Катализаторы процесса
- •10.3. Промышленная реализация процесса
- •Контрольные вопросы
- •Тема 11.
- •11.1. Алкилирование изоалканов алкенами
- •2,2,3-Триметилпентан
- •11.2. Изомеризация алканов с4 – с5
- •11.3. Полимеризация алкенов
- •11.4. Применение сжиженных газов и кислородсодержащих органических веществ в получении карбюраторных топлив
- •Контрольные вопросы
- •Тема 12.
- •12.1. Гидроочистка
- •12.1.3. Реакции кислородных соединений
- •12.2. Гидрокрекинг
- •Контрольные вопросы
- •Тема 13.
- •13.1. Нефтяные топлива
- •13.2. Нефтяные масла
- •13.3. Присадки к маслам
- •13.3. Пластичные смазки
- •13.5. Консервационно-смазочные материалы
- •13.6. Смазочно-охлаждающие технологические жидкости
- •13.7. Нефтяные растворители, ареновые углеводороды, керосины осветительные
- •13.8. Масла белые, вакуумные, технологические, теплоносители
- •13.9. Разные продукты
- •Контрольные вопросы
- •Тема 14.
- •14.1. Автомобильный бензин
- •14.2. Дизельное топливо
- •14.3. Авиационное топливо
- •Контрольные вопросы
- •Тема 15.
- •Контрольные вопросы
- •Библиографический список
- •Содержание
9.3. Каталитический крекинг
Это процесс каталитического деструктивного превращения тяжелых фракций нефти в моторное топливо и сырье для нефтехимии, производства технического углерода и кокса. Процесс ведут на алюмосиликатном катализаторе при 480 – 530 оС и давлении 0,3 – 0,7 МПа.
9.3.1. Химические основы процесса. Основными реакциями каталитического крекинга являются:
1) расщепление высокомолекулярных углеводородов;
2) изомеризация;
3) дегидрирование циклоалканов в арены.
Реализация этих реакций приводит к получению карбюраторных топлив с высоким октановым числом, т. к. октановые числа изоалканов выше, чем у н-алканов, а у аренов – чем у циклоалканов и алканов.
9.3.2. Превращения алканов. Они изомеризуются и распадаются на алканы и алкены меньшей молекулярной массы, чем исходные алканы. Первая стадия процесса – зарождение цепи – происходит по двум механизмам.
По первому – часть молекул алканов крекируется. Образовавшиеся алкены отрывают протоны от катализатора и превращаются в карбкатионы:
+
 RCH=
CH2
+ HA RCHCH3
+ A-.
(9.12)
RCH=
CH2
+ HA RCHCH3
+ A-.
(9.12)
По второму – образование карбкатиона происходит непосредственно из алкана путем отщепления от молекулы гидрид-иона под действием протонного центра или апротонного катализатора:
 RH
+ H+
R+
+ H2
(9.13)
RH
+ H+
R+
+ H2
(9.13)
или
 RH
+ L
R+
+ LH-
(9.14)
RH
+ L
R+
+ LH-
(9.14)
Так как отрыв гидрид-иона от третичного атома легче всего, изоалканы крекируются быстрее, чем н-алканы.
Термодинамика
процесса такая, что превращение, например,
карбкатиона С7Н15+
состоит в цепи ряда последовательно-параллельных
реакций изомеризации и
![]() -распада.
Химизм этого процесса представлен ниже.
-распада.
Химизм этого процесса представлен ниже.
СН3(СН2)5СН2+
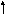

 изомеризация
изомеризация

![]() -
распад
+
-
распад
+
С Н3(СН2)4СН+СН3
СН3
– СН = СН2
+ СН3(СН2)2СН2
Н3(СН2)4СН+СН3
СН3
– СН = СН2
+ СН3(СН2)2СН2
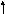
 изомеризация
изомеризация


![]() -
распад
+
-
распад
+
С Н3(СН2)3СН+СН2СН3
СН3
–СН2
- СН = СН2
+ СН3СН2СН2
Н3(СН2)3СН+СН2СН3
СН3
–СН2
- СН = СН2
+ СН3СН2СН2

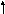

 изомеризация
изомеризация
![]() -
распад
+
-
распад
+
С Н3(СН2)3С+(СН3)2
СН2
= С(СН3)2
+ СН3СН2СН2
Н3(СН2)3С+(СН3)2
СН2
= С(СН3)2
+ СН3СН2СН2
Так как распад алкильных карбкатионов с образованием первичных и вторичных ионов С1 – С3 происходит труднее, чем с образованием третичных ионов с большим числом атомов углерода, то скорость крекинга растет с удлинением цепи. Например, в одинаковых условиях степень превращения составит, %: н-С5Н12 – 1; н-С7Н16 – 3; н-С12Н26 – 18; н-С16Н34 – 42.
Легкость распада ионов с отщеплением третичных карбкатионов ведет к накоплению в продуктах распада алканов с семью и более атомами углерода.
В ыделившиеся
низкомолекулярные карбкатионы после
изомеризации отрываютН+
-ионы от
исходного углеводорода, и весь цикл
реакций повторяется. Обрыв цепи происходит
при столкновении карбкатиона с анионом
катализатора: R+
+ LH-
RH
+ L.
ыделившиеся
низкомолекулярные карбкатионы после
изомеризации отрываютН+
-ионы от
исходного углеводорода, и весь цикл
реакций повторяется. Обрыв цепи происходит
при столкновении карбкатиона с анионом
катализатора: R+
+ LH-
RH
+ L.
В заключение следует отметить, что скорость реакций каталитического крекинга алканов на 1–2 порядка выше, чем при термическом крекинге.
9.3.3. Превращения циклоалканов. Скорость каталитического крекинга цикланов близка к скорости крекинга алканов с одинаковым числом атомов углерода. Для циклоалканов характерны следующие реакции:
1) дециклизация с образованием алкенов и диенов;
2) дегидрирование, приводящее к получению аренов;
3) изомеризация циклов и заместителей.
Глубина крекинга цикланов растет с увеличением числа заместителей в кольце (табл. 9.2).
Таблица 9.2
Зависимость глубины крекинга от заместителей в циклоалканах
|
Молекула |
Глубина крекинга, % |
Молекула |
Глубина крекинга, % |
|
|
47 |
Н |
78,6 |
|
|
75,6 |
|
51,8 |
Возрастание глубины крекинга, как показано в табл. 9.2, связано с тем, что отщепление гидрид-иона с образованием одновременно карбкатиона протекает легче с третичным атомом углерода. В то же время гемструктуры (1,1-диметилциклогексан) отщепляют гидрид-ион от вторичного атома углерода, поэтому степень превращения в этом случае сопоставима со степенью превращения незамещенного циклогексана.
Распад циклогексил-иона идет двумя способами: 1) с разрывом связи С – С; 2) с разрывом связи С – Н.
При разрыве связи С – С образуются алкены и алкадиены следующим образом:
R



 +
+



 + R
CH2
= C
– (CH2)3CH2
. (9.15)
+ R
CH2
= C
– (CH2)3CH2
. (9.15)
А лкенильный
ион далее изомеризуется в аллильный:
лкенильный
ион далее изомеризуется в аллильный:
R R

 + +
+ +
 CH2
= C – (CH2)3CH2
CH2
= C – СН(CH2)2CH3
. (9.16)
CH2
= C – (CH2)3CH2
CH2
= C – СН(CH2)2CH3
. (9.16)
Далее процесс развивается так:



R R

 + +
+ +
 CH2
=C–СН(CH2)2CH3
+R/H
CH2
= C –СН(CH2)3CH3
+ R/
(9.17)
CH2
=C–СН(CH2)2CH3
+R/H
CH2
= C –СН(CH2)3CH3
+ R/
(9.17)

или происходит передача протона алкену или катализатору:
+ +
C H2=C(R)–СН-(CH2)2CH3
+
R//CH=CH2
CH2=C(R)СН=CHCH2CH3
+ R//CHCH3
. (9.18)
H2=C(R)–СН-(CH2)2CH3
+
R//CH=CH2
CH2=C(R)СН=CHCH2CH3
+ R//CHCH3
. (9.18)
Распад циклогексил-карбкатиона с расщеплением связи С – Н энергетически более выгоден, так как через промежуточные циклоалкены и циклоалкины образуются арены:
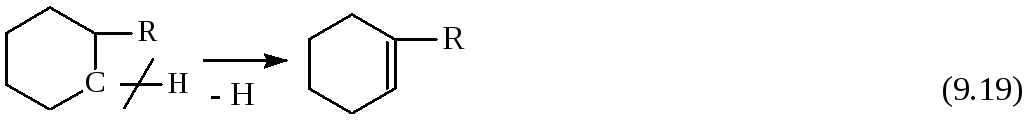
Циклоалкены подвергаются крекингу быстрее, чем циклоалканы:

Выход аренов составляет 25 % и более от суммы продуктов превращения циклогексанов, а газовая фаза содержит повышенное количество водорода по сравнению с газами крекинга алканов.
Имеет место также изомеризация циклогексанов в циклопентаны и обратно:
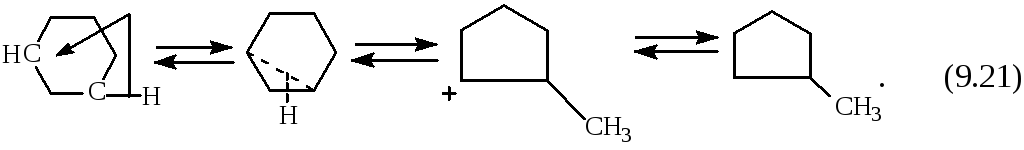
Эта реакция протекает через протонированное пропановое кольцо.
Равновесие в этой реакции сильно сдвинуто вправо, так как в условиях каткрекинга циклопентаны более устойчивы чем циклогексаны. Но циклогексаны дегидрируются в арены, и тем самым равновесие сдвигается влево. Вероятность превращения циклогексана в тот или иной продукт в итоге зависит от катализатора.
Если в молекуле циклоалкана длинные боковые цепи, то возможна изомеризация боковой цепи и /или деалкилирование.
Бицикланы ароматизируются в большей степени чем моноциклы. Декалин превращается в нафталин на 33 % при 500 оС, тетралин – на 88 %.
9.3.4. Превращения алкенов. Скорость их каткрекинга на 2 – 3 порядка выше соответствующих алканов и циклоалканов, что объясняется термодинамикой образования из них карбкатионов:
+
 Н2С
= СНСН2СН3
+ Н+
Н3ССНСН2СН3
+ 757 кДж/моль. (9.22)
Н2С
= СНСН2СН3
+ Н+
Н3ССНСН2СН3
+ 757 кДж/моль. (9.22)
Вместе со многими общими реакциями с алканами алкены обладают и специфическими реакциями перераспределения водорода и циклизации.
Сущность таких реакций состоит в том, что в присутствии кислых катализаторов часть алкенов теряет водород и образуются полиненасыщенные углеводороды, а другая часть алкенов гидрируется выделившимся водородом и переходит в алканы, например:
 2С8Н16
С8Н14
+ С8Н18
.
(9.23)
2С8Н16
С8Н14
+ С8Н18
.
(9.23)
При этом сильноненасыщенные углеводороды полимеризуются, дегидрируются и, теряя водород, превращаются в кокс.
Циклизация алкенов может привести к образованию циклопентанов, циклопентенов и аренов по схеме:
СН3(СН2)3СН = СН2



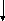

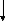
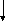
– Н2 – 2Н2 – 3Н2
![]()
![]()
![]()
![]()
метилциклопентан метициклопентен метилциклопентин бензол
Пятичленные циклы изомеризуются в шестичленные и далее ароматизуются.
9.3.5. Превращения аренов. Незамещенные арены при каталитическом крекинге стабильны. Монометилзамещенные арены по реакционной способности сравнимы с алканами, арены с более длинными алкильными заместителями по стабильности близки к алкенам. Основной реакцией для них является деалкилирование. Это объясняется тем, что ароматическое кольцо обладает большим сродством к протону по сравнению с алкил-ионом:
 H
H


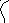



 +
+
+
+






 (СН2)2R
+ H (CH2)2R
+CH2CH2R
(9.24)
(СН2)2R
+ H (CH2)2R
+CH2CH2R
(9.24)
в свою очередь:
свою очередь:
 + +
+ +


 CH2CH2R
CH2
= CHR
+ Н .
(9.25)
CH2CH2R
CH2
= CHR
+ Н .
(9.25)

Скорость реакции возрастает с увеличением длины алкильного заместителя, а также в ряду:
С6Н5 – Rперв. < С6Н5 – Rвтор. < С6Н5 – Rтрет.
Именно такой ряд обусловлен различной устойчивостью образующихся карбкатионов.
Для метилзамещенных аренов отщепление карбкатиона затруднено и протекают в основном реакции диспропорционирования:
 2С6Н5СН3
С6Н6
+ С6Н4(СН3)2
(9.26)
2С6Н5СН3
С6Н6
+ С6Н4(СН3)2
(9.26)
и














 изомеризация по положению заместителя:
СН3
Н3С
СН3
Н3С
(9.27)
.
изомеризация по положению заместителя:
СН3
Н3С
СН3
Н3С
(9.27)
.
СН3 СН3
Полициклические арены сорбируются на катализаторе и подвергаются постепенной деструкции и перераспределению водорода с образованием кокса.
Представляет интерес сравнение механизмов реакций углеводородов при термическом и каталитическом крекингах (табл. 9.3).
Таблица 9.3
Сравнение механизмов термического и каталитического крекинга
|
Углево-дороды |
Термический крекинг |
Каталитический крекинг |
|
Алканы |
Расщепление по С–С-связи (в газах преобладают углеводороды С1–С2).Дегидрирование низших алканов. |
Расщепление по С–С-связи (в газах преобладают углеводороды С3–С4). Дегидрирование. |
|
Алкены |
Расщепление по С–С-связи. Дегидрирование. Полимеризация. Диеновый синтез. |
Расщепление по С–С-связи. Дегидрирование. Перераспределение водорода. Циклизация. |
|
Диены |
Диеновый синтез |
Полимеризация с перераспределением водорода и образованием смолы и кокса, а также алканов. |
|
Цикло-алканы |
Расщепление по С–С-связи. Дегидрирование. Ароматизация |
Расщепление по С–С-связи. Дегидрирование. Ароматизация. Изомеризация |
|
Арены |
Конденсация
с образованием многоядерных аренов.
Расщепление алкилбензолов по
|
Расщепление
алкилбензолов по
|


 СН3
СН3
 3С
3С СН3
СН3

 Н3С
СН3
Н3С
СН3
 СН3
СН3 СН3
СН3