
- •И. В. Мозговой, г. М. Давидан, л.Н. Олейник
- •Предисловие
- •Тема 1.
- •1.1. Краткая история нефтепереработки
- •1.2. Происхождение нефти
- •1.3. Мировые запасы нефти
- •1.4. Добыча нефти
- •1.5. Добыча природных газов
- •Контрольные вопросы
- •2.2. Химический состав нефти
- •2.3. Классификация нефтей
- •Контрольные вопросы
- •Тема 3.
- •3.1. Фракционный состав нефтей
- •3.2. Плотность
- •3.3. Молекулярная масса
- •3.4. Вязкость
- •3.5. Низкотемпературные свойства нефти и нефтепродуктов
- •3.6. Пожароопасные и взрывоопасные свойства нефтепродуктов
- •3.7. Оптические свойства нефти и нефтепродуктов
- •3.8. Электрические свойства нефтепродуктов
- •3.9. Тепловые свойства нефтепродуктов
- •Контрольные вопросы
- •Тема 4.
- •4.1. Газообразные алканы
- •4.2. Жидкие алканы
- •4.3. Твердые алканы
- •4.4. Физические свойства алканов
- •4.5. Химические свойства алканов
- •Контрольные вопросы
- •Тема 5.
- •5.1. Физические свойства циклоалканов
- •5.2. Химические свойства циклоалканов
- •5.3. Получение циклоалканов
- •5.3.2. Получение циклогептана
- •5.3.4. Получение циклододекана
- •Контрольные вопросы
- •Тема 6.
- •6.1. Типы аренов и концентрация их в нефтях и их фракциях
- •6.2. Физические свойства аренов
- •6.3. Химические свойства
- •6.3.3. Окисление
- •6.4. Применение аренов в нефтехимии
- •Контрольные вопросы
- •Тема 7.
- •7.1. Сернистые соединения
- •7.2. Азотистые соединения
- •7.3. Кислородсодержащие соединения
- •7.4. Асфальто-смолистые вещества
- •7.5. Микроэлементы
- •Контрольные вопросы
- •Тема 8.
- •8.1. Введение в теорию
- •8.2. Кинетика и механизм термических процессов
- •8.3. Термические превращения углеводородов в газовой фазе
- •8.4. Пиролиз (высокотемпературный крекинг)
- •8.5. Коксование
- •8.6. Промышленные термические процессы
- •Контрольные вопросы
- •Тема 9.
- •9.1. Основные понятия о катализе и катализаторах
- •9.2. Реакции карбкатионов
- •9.3. Каталитический крекинг
- •9.4. Катализаторы каталитического крекинга
- •9.5. Макрокинетика процесса
- •9.6. Промышленный каталитический крекинг
- •Контрольные вопросы
- •Тема 10.
- •10.1. Химизм процесса
- •10.2. Катализаторы процесса
- •10.3. Промышленная реализация процесса
- •Контрольные вопросы
- •Тема 11.
- •11.1. Алкилирование изоалканов алкенами
- •2,2,3-Триметилпентан
- •11.2. Изомеризация алканов с4 – с5
- •11.3. Полимеризация алкенов
- •11.4. Применение сжиженных газов и кислородсодержащих органических веществ в получении карбюраторных топлив
- •Контрольные вопросы
- •Тема 12.
- •12.1. Гидроочистка
- •12.1.3. Реакции кислородных соединений
- •12.2. Гидрокрекинг
- •Контрольные вопросы
- •Тема 13.
- •13.1. Нефтяные топлива
- •13.2. Нефтяные масла
- •13.3. Присадки к маслам
- •13.3. Пластичные смазки
- •13.5. Консервационно-смазочные материалы
- •13.6. Смазочно-охлаждающие технологические жидкости
- •13.7. Нефтяные растворители, ареновые углеводороды, керосины осветительные
- •13.8. Масла белые, вакуумные, технологические, теплоносители
- •13.9. Разные продукты
- •Контрольные вопросы
- •Тема 14.
- •14.1. Автомобильный бензин
- •14.2. Дизельное топливо
- •14.3. Авиационное топливо
- •Контрольные вопросы
- •Тема 15.
- •Контрольные вопросы
- •Библиографический список
- •Содержание
6.2. Физические свойства аренов
Арены избирательно растворяются в большинстве полярных растворителей. Температура кристаллизации у аренов тем выше, чем более симметрична его молекула, чем компактнее они упакованы в кристалллической решетке. Поэтому температура плавления у бензола на 100 оС выше, чем у толуола (+5,5 и – 95 оС соответственно). По этой же причине температура плавления у п-ксилола на 61 оС выше, чем у о-ксилола, а у дурола – на 105 оС выше, чем у изодурола. Конденированные арены с линейно аннелированными кольцами (типа антрацена) имеют значительно более высокие температуры кристаллизации, чем ангулярные (типа фенантрена).
Температуры кипения изомерных аренов отличаются незначительно, что затрудняет их разделение.
Вязкость и плотность аренов возрастают с увеличением числа заместителей, а индекс вязкости снижается. Плотность полиметилбензолов выше, чем у алкилбензолов с тем же числом атомов углерода, но с длинными заместителями.
Арены имеют высокую детонационную стойкость. Их октановое число выше 100, т. е. больше, чем у эталона – изооктана. Наличие метильных заместителей в о-положении снижает детонационную стойкость, а в м- и п- положениях – повышает.
Арены отличаются наименьшей воспламеняемостью, а следовательно, и низкими цетановыми числами. Не случайно цетановое число 1-метил- нафталина принято за 0 в шкале цетановых чисел. Поэтому арены крайне нежелательны в дизельных топливах.
Для аренов характерна совокупность ряда физических свойств и структурных особенностей:
а) характер связей С – С – промежуточный между простыми и двойными связями;
б) в голоядерных моноциклах все связи С – С равноценны;
в) плоское или почти плоское строение цикла;
г) поглощение света при сравнительно больших длинах волн;
д) легкая поляризуемость;
е) анизотропия диамагнитной восприимчивости.
6.3. Химические свойства
Арены характеризуются довольно высокой термодинамической устойчивостью, несколько уступающей алканам, но значительно превышающей алкены и циклоалкены. В большей мере это относится к незамещенным аренам, и аренам с меньшим количеством колец в молекуле. Особенно затруднены с аренами реакции присоединения.
6.3.1. Реакции электрофильного замещения для aренов наиболее характерны. Механизм электрофильного замещения может быть представлен такой схемой:





 Н Х
Н Х










 + Х+
Х+
+ Н+.
(6.1)
+ Х+
Х+
+ Н+.
(6.1)
 Х
Х
![]() -комплекс
-комплекс![]() -комплекс
-комплекс
где Х+ – электрофил.
Электрофильному замещению предшествует кислотно-основная реакция, например:

 НNO3
+2H2SO4
2HSO4
-
+H3O+
+ NO-2;
(6.2)
НNO3
+2H2SO4
2HSO4
-
+H3O+
+ NO-2;
(6.2)
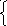

 2Н2SO4
SO3
+ H3O+
+ HSO4
–
; (6.3)
2Н2SO4
SO3
+ H3O+
+ HSO4
–
; (6.3)

 SO3
+ H2SO4
HSO4-
+ SO3H+
(6.4)
SO3
+ H2SO4
HSO4-
+ SO3H+
(6.4)
При галогенировании в присутствии сильных или льюисовских кислот (FeCl3, AlCl3, SnCl4 и т. д.) происходит образование ионов:

 Сl2
+ H2SO4
Cl+
+ HCl + HSO4-
; (6.5)
Сl2
+ H2SO4
Cl+
+ HCl + HSO4-
; (6.5)

 Cl2
+ FeCl3
Cl
Cl2
+ FeCl3
Cl![]() +
+ FeCl4-
. (6.6)
+
+ FeCl4-
. (6.6)
При повторном замещении образуются м-замещенные соединения.
6.3.2. Реакции присоединения. Эти реакции не являются характерными для аренов и протекают в жестких условиях при избыточном давлении и в присутствии катализатора (Ni, Pt, Pd и др.):




 +
3Н2 .
(6.7)
+
3Н2 .
(6.7)
Другая реакция присоединения – галогенирование – протекает по свободно-радикальному механизму в жидкой фазе при фото- или другом виде инициирования:

 С6Н6
+ 3Сl2
C6H6Cl6
. (6.8)
С6Н6
+ 3Сl2
C6H6Cl6
. (6.8)
Еще одна реакция присоединения – озонирование:


 О3
СНО
О3
СНО


 3Н2
3 + 6Н2О.
(6.9)
3Н2
3 + 6Н2О.
(6.9)

 + 3О3
СНО
+ 3О3
СНО
 О3
О3
О3
О3
триозонид глиоксаль
Конденсированные арены вследствие неравноценности связей С – С более реакционноспособны, чем бензол, и в реакции присоединения вступают с большей скоростью:



 ОНС
СНО
СНО
ОНС
СНО
СНО





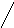


 2О3
О3
+2Н2
+ ; (6.10)
2О3
О3
+2Н2
+ ; (6.10)


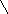
 СНО
СНО
–2Н2O
О3









 Сl2
Cl
Cl;
(6.11)
Сl2
Cl
Cl;
(6.11)

















 Cl2
. (6.12)
Cl
Cl
Cl2
. (6.12)
Cl
Cl
6.3.2. Восстановление с йодистым водородом. Эта реакция протекает по механизму гидроизомеризации:

Т


 ,
6НI
СН3
+
3I2 .
(6.13)
метилциклопентан
,
6НI
СН3
+
3I2 .
(6.13)
метилциклопентан
