
- •И. В. Мозговой, г. М. Давидан, л.Н. Олейник
- •Предисловие
- •Тема 1.
- •1.1. Краткая история нефтепереработки
- •1.2. Происхождение нефти
- •1.3. Мировые запасы нефти
- •1.4. Добыча нефти
- •1.5. Добыча природных газов
- •Контрольные вопросы
- •2.2. Химический состав нефти
- •2.3. Классификация нефтей
- •Контрольные вопросы
- •Тема 3.
- •3.1. Фракционный состав нефтей
- •3.2. Плотность
- •3.3. Молекулярная масса
- •3.4. Вязкость
- •3.5. Низкотемпературные свойства нефти и нефтепродуктов
- •3.6. Пожароопасные и взрывоопасные свойства нефтепродуктов
- •3.7. Оптические свойства нефти и нефтепродуктов
- •3.8. Электрические свойства нефтепродуктов
- •3.9. Тепловые свойства нефтепродуктов
- •Контрольные вопросы
- •Тема 4.
- •4.1. Газообразные алканы
- •4.2. Жидкие алканы
- •4.3. Твердые алканы
- •4.4. Физические свойства алканов
- •4.5. Химические свойства алканов
- •Контрольные вопросы
- •Тема 5.
- •5.1. Физические свойства циклоалканов
- •5.2. Химические свойства циклоалканов
- •5.3. Получение циклоалканов
- •5.3.2. Получение циклогептана
- •5.3.4. Получение циклододекана
- •Контрольные вопросы
- •Тема 6.
- •6.1. Типы аренов и концентрация их в нефтях и их фракциях
- •6.2. Физические свойства аренов
- •6.3. Химические свойства
- •6.3.3. Окисление
- •6.4. Применение аренов в нефтехимии
- •Контрольные вопросы
- •Тема 7.
- •7.1. Сернистые соединения
- •7.2. Азотистые соединения
- •7.3. Кислородсодержащие соединения
- •7.4. Асфальто-смолистые вещества
- •7.5. Микроэлементы
- •Контрольные вопросы
- •Тема 8.
- •8.1. Введение в теорию
- •8.2. Кинетика и механизм термических процессов
- •8.3. Термические превращения углеводородов в газовой фазе
- •8.4. Пиролиз (высокотемпературный крекинг)
- •8.5. Коксование
- •8.6. Промышленные термические процессы
- •Контрольные вопросы
- •Тема 9.
- •9.1. Основные понятия о катализе и катализаторах
- •9.2. Реакции карбкатионов
- •9.3. Каталитический крекинг
- •9.4. Катализаторы каталитического крекинга
- •9.5. Макрокинетика процесса
- •9.6. Промышленный каталитический крекинг
- •Контрольные вопросы
- •Тема 10.
- •10.1. Химизм процесса
- •10.2. Катализаторы процесса
- •10.3. Промышленная реализация процесса
- •Контрольные вопросы
- •Тема 11.
- •11.1. Алкилирование изоалканов алкенами
- •2,2,3-Триметилпентан
- •11.2. Изомеризация алканов с4 – с5
- •11.3. Полимеризация алкенов
- •11.4. Применение сжиженных газов и кислородсодержащих органических веществ в получении карбюраторных топлив
- •Контрольные вопросы
- •Тема 12.
- •12.1. Гидроочистка
- •12.1.3. Реакции кислородных соединений
- •12.2. Гидрокрекинг
- •Контрольные вопросы
- •Тема 13.
- •13.1. Нефтяные топлива
- •13.2. Нефтяные масла
- •13.3. Присадки к маслам
- •13.3. Пластичные смазки
- •13.5. Консервационно-смазочные материалы
- •13.6. Смазочно-охлаждающие технологические жидкости
- •13.7. Нефтяные растворители, ареновые углеводороды, керосины осветительные
- •13.8. Масла белые, вакуумные, технологические, теплоносители
- •13.9. Разные продукты
- •Контрольные вопросы
- •Тема 14.
- •14.1. Автомобильный бензин
- •14.2. Дизельное топливо
- •14.3. Авиационное топливо
- •Контрольные вопросы
- •Тема 15.
- •Контрольные вопросы
- •Библиографический список
- •Содержание
5.1. Физические свойства циклоалканов
Циклоалканы кипят при температурах выше, чем алканы и алкены, но ниже, чем арены с тем же числом атомов углерода в молекуле.
Алкилзамещенные циклоалканы кипят при более высокой температуре, чем голоядерные, а замерзают при более низкой температуре. При этом следует отметить, что чем проще заместитель у циклоалкана, тем выше разница в температурах плавления замещенного циклана и голоядерного.
5.2. Химические свойства циклоалканов
По многим свойствам циклоалканы похожи на алканы. Они также вступают в реакции замещения с галогенами, нитруются азотной кислотой.
Наиболее устойчивым среди голоядерных циклоалканов является циклогексан. В отличие от других циклоаканов, не имеющих заместителей, его молекула не является плоской и в ней отсутствует напряжение. И это при небольшом отклонении от Байеровского угла (109о28//) между двумя валентностями sp3-гибридизованного атома углерода, которое составляет у циклогексана – 5о16//. Для сравнения это отклонение у циклопентана составляет + 44//, у циклобутана + 9о 44// , циклопропана даже + 24о 44//. Последние три молекулы являются плоскими. Как следствие, теплота сгорания в расчете на одну группу – СН2 – у циклогексана наименьшая и составляет 659,03 кДж/моль, что почти равно теплоте сгорания, приходящейся на одну группу – СН2 – у алканов.
5.2.1.
Реакции изомеризации.
Пятичленные цикланы могут превращаться
в шестичленные в присутствии катализаторов
кислотного типа, подобного AlCl3
или AlBr3.
При этом расширение цикла идет за счет
включения в него
![]() -углеродного
атома :
-углеродного
атома :

Эта реакция используется для получения ценного сырья – циклогексана. Как видно из уравнения (5.1), реакция может быть обратимой при определенных условиях. Такой тип изомеризации называют структурной скелетной с изменением цикла. Существуют и другие виды изомеризации циклоалканов.
Структурная скелетная без изменения цикла:
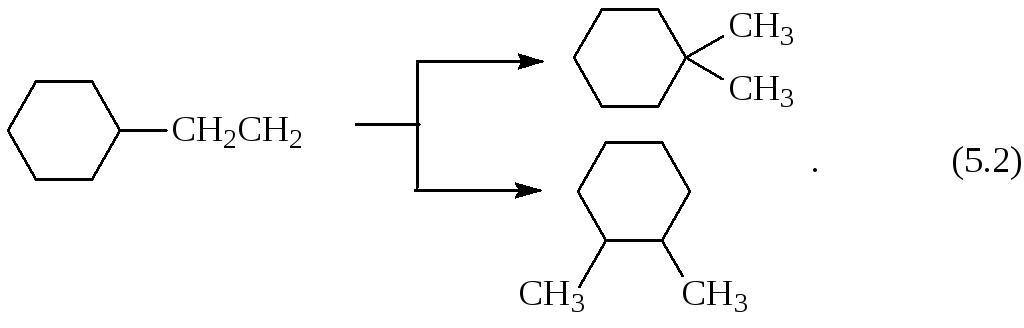
Пространственная геометрическая (цис – транс) изомерия:

5.2.2.
Реакция дегидрирования.
На бифункциональных
катализаторах при 240 – 420оС
на гидрирующе-дегидрирующих центрах
металлических катализаторов (Pt,
Ni,
Pd)
образуются циклоалкены, а на кислотных
центрах (Al2O3)
– карбкатионы:

где М – металлические центры;
К – кислотные центры.
5.2.3. Действие окислителей. Практическое применение имеют реакции для получения капрона и найлона через капролактам, последовательность которых приведена на рис. 5.1.
Окисление циклогексана проводят 35-процентной азотной кислотой при 120–125 оС и давлении 0,4–0,5 МПа и мольном соотношении кислоты к циклогексану 1,33:1. Нитроциклогексан восстанавливают в циклогексаноноксим водородом в среде аммиака на медном катализаторе при 80–130 оС, давлении 17 – 20 МПа с выходом оксима 85 – 90 %.
Окисление
циклогексана кислородом воздуха ведут
в жидкой фазе при 120–130 оС,
давлении 1,5–2,0 МПа в присутствии
нафтената Со
или стеарата Мп.
В конечном счете можно одновременно
получать адипиновую кислоту и
![]() -капролактам.
-капролактам.

 HNO3,
NxOy
HNO3,
NxOy



 NO2
NO2


 циклогексан
циклогексан
+


















 О2
+H2
-
H2O
О
ОН
- Н2
циклогексанон
+ HNO3
циклогексанол
NH2OH
О2
+H2
-
H2O
О
ОН
- Н2
циклогексанон
+ HNO3
циклогексанол
NH2OH




 НО – N
+[О]
+NOCl
+ O2
-
- НСl
НО – N
+[О]
+NOCl
+ O2
-
- НСl


 оксим
циклогексана
НООС(СН2)4СООН
оксим
циклогексана
НООС(СН2)4СООН
адипиновая кислота






изомеризация +Н2SO4 + SO3 + NH3
300-390 оС, H3PO4
 NH
NC(CH2)4CN
NH
NC(CH2)4CN



 (СН2)5
адиподинитрил
+ C
= O
80 – 100 оС
(СН2)5
адиподинитрил
+ C
= O
80 – 100 оС
![]() -
капролактам + Н2;
4,9 – 7,8 МПа
-
капролактам + Н2;
4,9 – 7,8 МПа


-
 [-HN(CH2)5CO-]x-
NH2
(CH2)6NH2
капрон
(найлон 6) гексаметилендиамин
[-HN(CH2)5CO-]x-
NH2
(CH2)6NH2
капрон
(найлон 6) гексаметилендиамин
-[HN(CH2)6NHCO(CH2)4CO
- ]x
-
анид (найлон 6,6)
Рис. 5.1. Схема переработки циклогексана в синтетические волокна
Получение
![]() -капролактама
путем нитрозирования циклогексана
раствором нитрозилхлорида проводят
путем облучения видимым светом с длиной
волны 450 – 550 мкм и насыщения раствора
хлороводородом:
-капролактама
путем нитрозирования циклогексана
раствором нитрозилхлорида проводят
путем облучения видимым светом с длиной
волны 450 – 550 мкм и насыщения раствора
хлороводородом:

 NOCl
+ HCl
NOCl
+ HCl



 NOH
NOH![]() HCl.
(5.5)
HCl.
(5.5)
И далее хлоргидрат циклогексаноксима изомеризуют в капролактам.
5.2.4. Гидрирование циклоалканов. При каталитическом гидрировании трех-, четырех- и пятичленные циклы разрываются с образованием соответствующих алканов. Наиболее легко эта реакция протекает с циклопропаном и его гомологами. Пятичленный цикл разрывается только при высокой температуре.
 Рd
Рd
 + Н2
СН3
– СН2
– СН3;
(5.6)
+ Н2
СН3
– СН2
– СН3;
(5.6)
 Pd,
300 оС
Pd,
300 оС
 + Н2
СН3
– (СН2)3
– СН3.
(5.7)
+ Н2
СН3
– (СН2)3
– СН3.
(5.7)
Иначе протекает реакция с шестичленными циклами. С этим же катализатором они, наоборот, дегидрируются с образованием ароматических соединений:



 Рd,
300 оC
+ H2
.
(5.8)
Рd,
300 оC
+ H2
.
(5.8)
5.2.5. Галогенирование. Реакция галогенирования протекает по-разному в зависимости от величины цикла. При хлорировании циклопропана кольцо разрывается:

 + Сl2
CH2Cl
– CH2
– CH2Cl
.
(5.9)
+ Сl2
CH2Cl
– CH2
– CH2Cl
.
(5.9)
Циклобутан взаимодействует с хлором двояким образом:

 CH2Cl––
CH2Cl
(5.10)
CH2Cl––
CH2Cl
(5.10)
 + Cl2
+ Cl2
 (5.11)
(5.11)
Пяти- и шестичленные циклы вступают только в реакции замещения:


 (5.12)
(5.12)
5.2.6. Реакция пербромирования открыта Густавссонном и Коноваловым. Протекает в присутствии АlВr3 в качестве катализатора. Она является качественной реакцией на циклоалканы, в том числе и гибридных структур.

 Br
Br
Br
Br

 AlBr3
AlBr3




 СН3
+ 8Вr2
Br CH3
+ 11HBr . (5.13)
СН3
+ 8Вr2
Br CH3
+ 11HBr . (5.13)


Br Br
пентабромтолуол
5.2.7. Действие галогеноводородов. С ними реагирует только циклопропан и его гомологи:

 +
НВr
BrСН2
– СН2
– СН3
.
(5.14)
+
НВr
BrСН2
– СН2
– СН3
.
(5.14)
5.2.8. Термические реакции. Главными продуктами крекинга циклоалканов являются низшие алканы, алкены, алкадиены и водород. Незамещенные циклоалканы могут распадаться по следующим направлениям:


 3СН2
= СН2
3СН2
= СН2
 СН2 =
СН – (СН2)3
– СН3
СН2 =
СН – (СН2)3
– СН3




 СН2
= СН2
+ СН2 =
СН – СН2
– СН3
(5.15)
СН2
= СН2
+ СН2 =
СН – СН2
– СН3
(5.15)
 СН3
– СН3
+ СН2 =
СН – СН = СН2
СН3
– СН3
+ СН2 =
СН – СН = СН2

 СН2 =
СН – (СН2)2
– СН = СН2
+ Н2
.
СН2 =
СН – (СН2)2
– СН = СН2
+ Н2
.
П ервичный
распад исходной молекулы происходит
с разрывом связиС–
С и
образованием бирадикала: С6Н12
ервичный
распад исходной молекулы происходит
с разрывом связиС–
С и
образованием бирадикала: С6Н12
![]() СН2
– (СН2)4
– СН2
СН2
– (СН2)4
– СН2![]() ,
который распадается на стабильные
молекулы:
,
который распадается на стабильные
молекулы:
 3СН2
= СН2
3СН2
= СН2

![]() СН2
– (СН2)4
– СН2
СН2
– (СН2)4
– СН2![]()
СН2 = СН – (СН2)3 – СН3 . (5.16)
Реакция (5.16) идет по нецепному механизму.
Алкилзамещенные
циклоалканы распадаются по радикальноцепному
механизму путем разрыва связи С
– С в боковой
цепи или обрыва радикала
![]() СН3
в случае метилпроизводных циклоалканов.
Бициклические циклоалканы также
подвергаются дециклизации, крекингу
и дегидрированию.
СН3
в случае метилпроизводных циклоалканов.
Бициклические циклоалканы также
подвергаются дециклизации, крекингу
и дегидрированию.
5.2.9. Каталитические превращения циклоалканов.
а) в 1911 г. Н. Д. Зелинский открыл реакцию, названную его именем:

 Pt,
Pd,
Ni
Pt,
Pd,
Ni

 + 3H2;
(5.17)
+ 3H2;
(5.17)
250 – 300 оC





 катализатор
CH3
температура
CH3
+ 3Н2;
(5.18)
катализатор
CH3
температура
CH3
+ 3Н2;
(5.18)
б) каталитическое диспропорционирование:



 Рt,
Pd
Рt,
Pd

 3 2 + ; (5.19)
3 2 + ; (5.19)


 Pt,
Pd
Pt,
Pd




 3
CH
= CH2
2
C2H5
+ C2H5
(5.20)
3
CH
= CH2
2
C2H5
+ C2H5
(5.20)
в) перераспределение водорода между реагентами:

 Pt,
Ni, Cu
Pt,
Ni, Cu

 +3R
– CH = CH2
+
3R – CH2
– CH3;
(5.21)
+3R
– CH = CH2
+
3R – CH2
– CH3;
(5.21)
г) внутримолекулярная изомеризация – перераспределение водорода на дегидрирующем катализаторе:





 Pt,
Pd,
Ni
СH
= CH2
CH2
– CH3
. (5.22)
Pt,
Pd,
Ni
СH
= CH2
CH2
– CH3
. (5.22)
винилциклогексан этилциклогексен
