
- •При выборе задания исходить из того, что задала преподаватель на уст.Лекции!!! введение
- •1.1. Электронная структура атомов. Зависимость свойств элементов строения их атомов
- •1.2. Строение атомных ядер. Радиоактивность. Ядерные реакции
- •2. Основные закономерности протеканий химических реакций
- •2.1.Энергетика химических реакций. Химико- термодинамические расчеты
- •2.2.Скорость химических реакций. Химическое равновесие
- •3.Растворы электролитов. Слабые электролиты. Константа и степень диссоциации
- •4.Окислительно-восстановительные реакции.
- •4.1. Степень окисленности
- •4.2. Окислители и восстановители
- •4.3.Составление уравнений окислительно-восстановительных реакций
- •5. Химические источники электрической энергии. Электродные потенциалы
- •6. Электролиз
- •7.Варианты контрольной работы
- •1. Строение атома
2.2.Скорость химических реакций. Химическое равновесие
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции)1.
В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени.
Это определение
можно выразить уравнением
![]() C/
C/![]() t
, где знак «плюс» относится к изменению
концентрации вещества, образующегося
в результате реакции (
t
, где знак «плюс» относится к изменению
концентрации вещества, образующегося
в результате реакции (![]() С>0)
, а знак
«минус» - к изменению концентрации
вещества, вступающего в реакцию (
С>0)
, а знак
«минус» - к изменению концентрации
вещества, вступающего в реакцию (![]() С<0).
С<0).
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализатора. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции
типа А+В![]()
![]() закон действия масс выражается следующим
образом:
закон действия масс выражается следующим
образом:
![]()
![]()
В этом уравнении
![]() и
и![]() - концентрации вступающих в реакцию
веществ, а коэффициент пропорциональности
- концентрации вступающих в реакцию
веществ, а коэффициент пропорциональности![]() -
константа скорости реакции, значение
которой зависит от природы реагирующих
веществ.
-
константа скорости реакции, значение
которой зависит от природы реагирующих
веществ.
Гораздо реже
реакция осуществляется путем столкновения
трех реагирующих частиц. Например,
реакция типа А+2В![]() может протекать по механизму тройных
столкновений:
может протекать по механизму тройных
столкновений:
![]()
В этом случае, в соответствии с законом действия масс, можно записать:
![]() ,
т.е.
,
т.е.
![]()
Одновременное
столкновение более чем трех частиц
крайне маловероятно. Поэтому реакции,
в уравнения которых входят большое
число частиц (например
![]() )
протекают в несколько стадий, каждая
из которых осуществляется в результате
столкновения двух (реже трех) частиц. В
подобных случаях закон действия масс
применим к отдельным стадиям процесса,
но не к реакции в целом.
)
протекают в несколько стадий, каждая
из которых осуществляется в результате
столкновения двух (реже трех) частиц. В
подобных случаях закон действия масс
применим к отдельным стадиям процесса,
но не к реакции в целом.
При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в управление закона действия масс.
Пример 1. Написать выражение закона действия масс для реакций
а)
![]() (г.)
(г.)![]() (г.)
(г.)![]() (г.)
(г.)
б)
![]() (к.)
(к.)![]() (к.)+СО
(к.)+СО![]() (г.)
(г.)
Решение: а)
![]() .
.
б) Поскольку
карбонат кальция – твердое вещество,
концентрация которого не изменяется
в ходе реакции, искомое выражение будет
иметь вид:
![]() ,
т.е. в данном случае скорость реакции
при определенной температуре постоянна.
,
т.е. в данном случае скорость реакции
при определенной температуре постоянна.
Пример 2.
Энергия активации некоторой реакции в
отсутствии катализатора равна 75,24
кДж/моль, а с катализатором – 50,14 кДж/моль.
Во сколько раз возрастает скорость
реакции в присутствии катализатора,
если реакция протекает при 25![]() С?
С?
Решение. Обозначим
энергию активации реакции без катализатора
через Е![]() ,
а с катализатором – через
,
а с катализатором – через![]() ;
соответствующие константы скорости
реакции обозначим через
;
соответствующие константы скорости
реакции обозначим через![]() и
и![]() .
Используя уравнение Аррениуса, находим:
.
Используя уравнение Аррениуса, находим:
![]()
Отсюда:
![]() ;
lg
;
lg![]()
Подставляя в последнее уравнение данные задачи, выражая энергию активации в Джоулях и учитывая, что Т= 298К, получим:
![]()
Окончательно
находим:
![]() .
.
Таким образом, снижение энергии активации на 25,1 кДж привело к увеличению скорости реакции в 25 тысяч раз.
При протекании химической реакции концентрации исходных веществ уменьшаются; в соответствии с законом действия масс это приводит к уменьшению скорости реакции. Если реакции обратима, т.е. может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакции становится одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит.
В случае обратимой химической реакции
![]()
зависимость
скоростей прямой (![]() )
и обратной (
)
и обратной (![]() )
реакций от концентраций реагирующих
веществ выражается соотношениями:
)
реакций от концентраций реагирующих
веществ выражается соотношениями:
![]() ;
;
![]()
В состоянии
химического равновесия
![]() т.е.k→[A][B]=k[C][D]
т.е.k→[A][B]=k[C][D]
Отсюда:
![]()
Здесь К – константа равновесия реакции.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия – постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т.е. тем больше выход ее продуктов. В химической термодинамике доказывается, что для общего случая химической реакции:
aA
+ bB
+…![]() cC
+ dD
+…
cC
+ dD
+…
справедливо аналогичное выражение для константы равновесия реакции:
![]()
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Катализатор не влияет на значения константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакции и поэтому одинаково изменяет скорость прямой и обратной реакции. Катализатор лишь ускоряет достижения равновесия, но не влияет на количественный выход продуктов реакции.
Пример 3. В системе
А(г.) + 2В(г.) = С(г.) равновесные концентрации
равны:
![]() = 0,06 моль/л;
= 0,06 моль/л;![]() =
0,12моль/л;
=
0,12моль/л;![]() =
0,216 моль/л. Найти константу равновесия
реакции и исходные концентрации веществ
А и В.
=
0,216 моль/л. Найти константу равновесия
реакции и исходные концентрации веществ
А и В.
Решение. Константа равновесия данной реакции выражается уравнением:
![]()
Подставляя в
него данные задачи, получим:![]()
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моля А и 2 молей Б образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля веществ С, то при этом было израсходовано 0,216 моля А и 0,216 * 2 =0,432 моля В. Таким образом, искомые исходные концентрации равны:
![]()
Задачи
Найти значение константы скорости реакции А+В
 АВ,
если при концентрациях веществ А и В,
равных соответственно 0,05 и 0,01 моль/л,
скорость реакции равна 5*10
АВ,
если при концентрациях веществ А и В,
равных соответственно 0,05 и 0,01 моль/л,
скорость реакции равна 5*10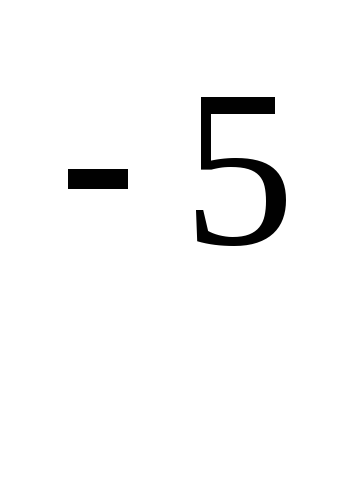 моль/л (л *мин).
моль/л (л *мин).Во сколько раз изменится скорость реакции 2А+В
 А
А В,
если концентрацию вещества А увеличить
в два раза, а концентрацию вещества В
уменьшить в два раза?
В,
если концентрацию вещества А увеличить
в два раза, а концентрацию вещества В
уменьшить в два раза?В два сосуда одной и той же вместимости введены: в первый 1 моль газа А и 2 моль газа В, во второй – 2 моль газа А и 1 моль газа В. Температура в обоих сосудах одинакова. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением
 б) уравнением
б) уравнением ?
?Через некоторое время после начала реакции ЗА+В
 2С+D
концентрации веществ составляли:
2С+D
концентрации веществ составляли:
 =0,03
моль/л;
=0,03
моль/л; =0,01
моль/л;
=0,01
моль/л; =
0,008 моль/л. Каковы исходные концентрации
веществ А и В?
=
0,008 моль/л. Каковы исходные концентрации
веществ А и В?В системе СО+Сl2=СОСl2 концентрацию монооксида углерода увеличили от 0,003 до 0,12 моль/л, а концентрацию хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Реакция между веществами А и В выражается уравнением: А+2В
 С.
Начальные концентрации составляют:
С.
Начальные концентрации составляют: =
0,03 моль/л,
=
0,03 моль/л, =
0,05 моль/л. Константа скорости реакции
равна 0,4. Найти начальную скорость
реакции скорость реакции по истечении
некоторого времени, когда концентрация
вещества А уменьшится на 0,01 моль/л.
=
0,05 моль/л. Константа скорости реакции
равна 0,4. Найти начальную скорость
реакции скорость реакции по истечении
некоторого времени, когда концентрация
вещества А уменьшится на 0,01 моль/л.Как изменится скорость реакции 2 NO(г.) + О
 (г.)
(г.) NО
NО (г.),
если: а) увеличить давление в системе
в 3 раза; б) уменьшить объем системы в 3
раза; в) повысить концентрациюNО
в 3 раза?
(г.),
если: а) увеличить давление в системе
в 3 раза; б) уменьшить объем системы в 3
раза; в) повысить концентрациюNО
в 3 раза?Две реакции протекают при 25
 С
с одинаковой скоростью. Температурный
коэффициент скорости первой реакции
равен 2,0, а второй – 2,5. Найти отношение
скоростей этих реакций при 95
С
с одинаковой скоростью. Температурный
коэффициент скорости первой реакции
равен 2,0, а второй – 2,5. Найти отношение
скоростей этих реакций при 95 С.
С.Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
При 150
 С некоторая реакция заканчивается за
16 мин. Принимая температурный коэффициент
скорости реакции равным 2,5, рассчитать,
через какое время закончится эта
реакция, если проводить ее: а)при 200
С некоторая реакция заканчивается за
16 мин. Принимая температурный коэффициент
скорости реакции равным 2,5, рассчитать,
через какое время закончится эта
реакция, если проводить ее: а)при 200 С;
б) при 80
С;
б) при 80 С.
С.Изменится ли значение константы скорости реакции: а) при замене одного катализатора другим; б) при изменении концентраций реагирующих веществ?
Зависит ли тепловой эффект реакции от ее энергии активации? Ответ обосновать.
Для какой реакции - прямой или обратной – энергия активации больше, если прямая реакция идет с выделением теплоты?
Во сколько раз увеличиться скорость реакции, протекающей при 298 К, если энергию активации ее уменьшить на 4 кДж/моль?
Чему равна энергии активации реакции, если при повышении температуры от 290 до 300К скорость ее увеличится в 2 раза?
Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
Энергия активации реакции
 равна 10 Дж/моль. Во сколько раз изменится
скорость реакции при повышении
температуры от 27 до 37
равна 10 Дж/моль. Во сколько раз изменится
скорость реакции при повышении
температуры от 27 до 37 ?
?Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать.
Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от ее структуры?
Реакция
 протекает с выделением теплоты. Однако
для того, чтобы реакция началась,
исходную смесь газов надо нагреть. Как
это объяснить?
протекает с выделением теплоты. Однако
для того, чтобы реакция началась,
исходную смесь газов надо нагреть. Как
это объяснить?Схематически изобразить энергетическую диаграмму экзотермической реакции
 .
Какая реакция – прямая или обратная
характеризуется большей константой
скорости?
.
Какая реакция – прямая или обратная
характеризуется большей константой
скорости?Схематически изобразить энергетическую диаграмму реакции
 ,
если
,
если ,
а для реакции в целом
,
а для реакции в целом

Почему в цепной реакции
 зарождение цепи начинается с радикала
С
зарождение цепи начинается с радикала
С *,
а не с радикала Н*?
*,
а не с радикала Н*?
