
Repetitor_po_Khimii
.pdf
§2.4. Классификация, номенклатура
играфические формулы кислот. Понятие об амфотерных гидроксидах
КИСЛОТЫ
Атомы водорода в молекулах кислот могут замещаться атомами металла, в результате чего образуются соли:
H(Ac) |
Замещение атомов H |
Mex(Ac)y |
|
|
|||
атомами металла Me |
|||
Кислота |
Соль |
||
|
Кислотные остатки Ас входят в состав кислот и в состав солей. Валентность кислотного остатка определяется числом атомов водорода (х) в молекуле кислоты. Например:
Кислота |
Кислотный |
Валентность |
|
остаток (Ас) |
|
HNO3 |
—NO3 |
I |
H2S |
=S |
II |
H3PO4 |
PO4 |
III |
Классификация
а) По основности.
Основность кислоты — это число атомов водорода, которые в молекуле кислоты могут замещаться атомами металла.
По основности кислоты делятся на:
— одноосновные, молекулы которых содержат один атом
водорода: НСl, HNO3, HCN и др.;
— двухосновные, молекулы которых содержат два атома
водорода: H2S, H2SO4, Н2СО3 и др.;
— трехосновные, молекулы которых содержат три атома
водорода: Н3РО4, Н3ВО3, H3AsO4 и др.;
— четырехосновные: Н4Р2О7 и др.
Кислоты, молекулы которых содержат два и более атомов водорода, называются многоосновными.
б) По содержанию атомов кислорода в молекуле кислоты
делятся на:
— бескислородные, молекулы которых не содержат ато-
мов кислорода: НСl, НВr, HCN, H2S и др.;
— кислородсодержащие, молекулы которых содержат атомы кислорода: HNO3, H2SO4, Н3РО4 и др.
60

Кислородсодержащие кислоты называются оксокислотами. Оксокислоты являются гидратами кислотных оксидов, т. е. продуктами соединения кислотных оксидов с водой. Например:
SO3 + Н2О = H3SO4
Р2О5 + 3H2O = 2Н3РО4
Кислотные |
Оксо- |
оксиды |
кислоты |
Элемент, атомы которого вместе с атомами водорода и кис-
лорода образуют молекулу оксокислоты, называется кислотообразующим элементом. Например, в кислотах HNO3, H3PO4,
H2SO4 кислотообразующими элементами являются соответственно N, P, S.
Валентность кислотообразующего элемента равна разности между суммой валентностей атомов кислорода и суммой валентностей атомов водорода.
Например:
Ix II
a)H2SO4
Сумма валентностей атомов кислорода равна 2 · 4 = 8. Сумма валентностей атомов водорода равна 1 · 2 = 2. Валентность серы равна: х = 8 2 = 6;
VI
H2SO4
I x II |
|
|
|
V |
|
|
б) Н3РО4; х= 2 · 4 1 · 3 = 5; |
Н3РО4 |
|
||||
|
Номенклатура |
|
|
|
||
а) Бескислородные кислоты |
|
|
|
|||
Название бес- |
Название |
соедини- |
|
«водородная |
||
кислородной = |
+ тельная |
+ |
||||
элемента |
кислота» |
|||||
кислоты |
|
гласная «-о-» |
|
|||
Название кислотного |
Название |
|
окончание |
|||
остатка бескислородной = |
+ |
|||||
элемента |
«-ид» |
|||||
кислоты |
|
|
|
|
|
|
|
|
|
|
|
Таблица 6 |
|
Формулы и названия бескислородных кислот и кислотных остатков
HF |
Фтороводородная кислота |
—F |
Фторид |
НСl |
Хлороводородная кислота |
—Сl |
Хлорид |
НВr |
Бромоводородная кислота |
—Вr |
Бромид |
HI |
Йодоводородная кислота |
—I |
Йодид |
H2S |
Сероводородная кислота |
=S |
Сульфид |
HCN |
Циановодородная кислота |
—CN |
Цианид |
|
|
|
|
61

Для HCl часто используют другое название — соляная кислота (от слова «соль»), HF называют пла@виковой кислотой,
HCN — синильной кислотой.
б) Оксокислоты. Названия оксокислот образуются из русских названий кислотообразующих элементов с добавлением различных суффиксов и окончаний.
Если один элемент образует две оксокислоты, то суффиксы -н или -ов используются в названии кислоты с большей валентностью элемента, а суффиксы -ист или -нист — в названии кислоты с меньшей валентностью элемента. На-
V |
III |
пример; НNО3 — азотная кислота, HNO2 — азотистая кислота.
Названия кислотных остатков образуются обычно из латинских названий кислотообразующих элементов с добавлением окончаний -am или -ит. Например: =SO4 — сульфат, =SO3 — сульфит (от латинского названия серы «sulfur»).
Формулы и названия наиболее важных оксокислот и их кислотных остатков приведены в табл. 7.
Таблица 7
Формулы и названия кислородсодержащих кислот и кислотных остатков
H2CO3 H2SiO3 HNO3
HNO2
H3PO4 H3PO3 H2SO4 H2SO3 H2CrO4 H2Cr2O7 HClO
HClO2 HClO3 НСlО4
H2MnO4 НМnО4
У@гольная кислота |
=СO3 |
Карбонат |
Кре@мниевая кислота |
=SiO3 |
Силика@т |
Азо@тная кислота |
—NO3 |
Нитра@т |
Азо@тистая кислота |
—NO2 |
Нитри@т |
Фо@сфорная кислота |
PО4 |
Фосфа@т |
Фо@сфористая кислота |
РO3 |
Фосфи@т |
Серная кислота |
=SO4 |
Сульфа@т |
Сернистая кислота |
=SO3 |
Сульфи@т |
Хро@мовая кислота |
=CrO4 |
Хрома@т |
Дихро@мовая кислота |
=Cr2O7 |
Дихрома@т |
Хлорноватистая кислота |
—ClO |
Гипохлори@т |
Хло@ристая кислота |
—СlO2 |
Хлори@т |
Хлорнова@тая кислота |
—СlO3 |
Хлора@т |
Хло@рная кислота |
—СlO4 |
Перхлора@т |
Марганцо@вистая кислота |
=МnО4 |
Мангана@т |
Марганцо@вая кислота |
—МnО4 |
Перманганат |
62
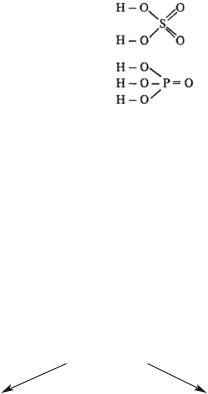
Графические формулы
В оксокислотах атомы водорода связаны с атомами кислорода, но не с атомами кислотообразующего элемента. Например:
|
О |
VII |
|
HClO4 |
H—O—Cl=O |
|
|
|
О |
VI |
|
H2SO4 |
|
|
|
V |
|
H3PO4 |
|
|
|
В оксокислотах, молекулы которых содержат 2 и более атомов кислотообразующего элемента, эти атомы соединяются через атомы кислорода. Например:
|
О |
О |
H2Cr2O7 |
|
|
Н—О—Сr—О—Сr—О—Н |
||
|
|
|
|
О |
О |
АМФОТЕРНЫЕ ГИДРОКСИДЫ
Молекулярная формула любого амфотерного гидроксида может быть записана в форме основания и в форме кислоты:
|
H—O—Zn—O—H |
|
Zn(OH)2 |
|
H2ZnO2 |
|
||
форма основания |
форма кислоты |
|
Каждому амфотерному гидроксиду можно дать название как основанию и как кислоте:
63

Графические |
Амфотерный |
Амфотерный |
Кислотный |
формулы |
гидроксид как |
гидроксид как |
остаток |
|
основание |
кислота |
|
|
Zn(OH)2 |
H2ZnO2 |
=ZnO2 |
|
Гидроксид |
Цинковая |
Цинкат |
|
цинка |
кислота |
|
|
|
H3AlO3 |
=АlО3 |
|
Аl(ОН)3 |
Ортоалюми- |
Орто- |
|
Гидроксид |
ниевая кислота |
алюминат |
|
алюминия |
НАlО2 |
—АlО2 |
|
|
Метаалюми- |
Мета- |
|
|
ниевая кислота* |
алюминат |
|
|
Н3СrO3 |
СrO3 |
|
Сr(ОН)3 |
Ортохромистая |
Ортохромит |
|
Гидроксид |
кислота |
|
|
хрома (III) |
НСrО2 |
—СrО2 |
|
|
Метахромис- |
Метахромит |
|
|
тая кислота* |
|
Выполнение типового упражнения
Классифицируйте следующие кислоты по основности и по содержанию атомов кислорода: Н3РО4, HNO2, H2S, HCN, HClO3, H2CO3, HF,
H3AsO4.
Модель решения
Одноосновные кислоты: HNO2, HCN, HF, HClO3 Двухосновные кислоты: H2S, H2CO3 Трехосновные кислоты: Н3РО4, Н3АsO4 Бескислородные кислоты: H2S, HCN, HF
Кислородсодержащие кислоты: Н3РО4, HNO2, HClO3, Н2СО3, Н3AsО4
Вопросы для контроля
1.Что такое кислоты?
2.Чем определяется валентность кислотного остатка?
3.Что такое основность кислоты?
4.Что такое одноосновные, многоосновные кислоты? Приведите примеры.
5.Что такое бескислородные кислоты? Приведите примеры.
6.Что такое кислородсодержащие кислоты (оксокислоты)? Приведите примеры.
7.Гидратами каких оксидов являются оксокислоты?
* Метаформы кислот образуются в результате отщепления воды от ортоформ кислот.
64
8.Что называется кислотообразующим элементом?
9.Чему равна валентность кислотообразующего элемента?
10.Приведите примеры формул и названий бескислородных кислот и их кислотных остатков.
11.Приведите примеры формул и названий оксокислот и их кислотных остатков.
12.Что такое амфотерные гидроксиды? Приведите примеры.
13.Напишите формулы известных вам амфотерных гидроксидов.
Упражнения для самостоятельной работы
1.Определите валентность кислотных остатков в следующих кислотах: H3BO3, НСlO4, H3SiO3, HCN, H3SbO4, Н2Cr2О7.
2.Классифицируйте следующие кислоты по основности и по содержанию атомов кислорода:
HI, Н3АsО4, H2S, HNO2, HMnO4, Н2СО3.
3.Определите валентность кислотообразующих элементов в следующих кислотах и напишите графические формулы этих кислот: НСlO, H4Р2О7, H2Cr2O7, H3AsO4.
4.Напишите формулы и названия кислот, которые соответствуют следующим кислотным оксидам:
SO2, SO3, СО2, Р2О5, N2O5, Mn2O7, CrO3, SiO2, P2O3, Cl2O.
5.Напишите формулы и названия оксидов, гидратами которых являются следующие кислоты:
H2SiO3, HNO2, Н2CrO4, НСlО3, Н3РО4, Н2Cr2О7, Н2МnО4, НСlO2.
6.Каким из следующих оксидов соответствуют кислоты: MgO, Mn2O7, CO, P2O3, N2O, Cl2O7, SiO, FeO, Na2O, NO, SO2, CrO3?
Напишите формулы и названия этих кислот.
7.Напишите формулы следующих амфотерных гидроксидов в форме кислот и определите валентность кислотных остатков в этих кислотах: Cr(OH)3, Sn(OH)2, Sb(OH)3, Pb(OH)2.
§2.5. Классификация, номенклатура
играфические формулы солей
Соли делятся на три типа (см. табл. 5): нормальные (средние), кислые, осно@вные.
Существуют и другие типы солей, которые рассматриваются в других разделах настоящего пособия.
НОРМАЛЬНЫЕ (СРЕДНИЕ) СОЛИ
• Нормальные (средние) соли —это продукты полного замещения атомов водорода в молекуле кислоты атомами метал-
65
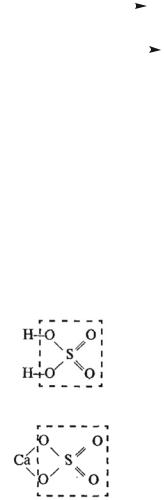
ла, или продукты полного замещения гидроксидных групп в молекуле основания кислотными остатками. Например:
|
|
|
|
|
|
Полное замещение атомов |
|
|
|
|
||||
|
|
H2 |
SO4 |
|
K2 |
SO4 |
||||||||
|
водорода атомами металла |
|
||||||||||||
|
|
Кислота |
|
Нормальная соль |
||||||||||
|
|
|
|
Полное замещение гидроксидных |
|
|
|
|
||||||
Fe |
(OH)4 |
|
Fe |
(NO3)3 |
|
|||||||||
|
|
|
||||||||||||
|
|
|
|
|
групп кислотными остатками |
|
|
|
|
|
||||
|
Основание |
|
|
|
Нормальная соль |
|||||||||
|
|
|
|
|
|
|
Номенклатура |
|
|
|
|
|
||
Название |
|
|
|
Название |
Название |
|
|
Валентность |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
нормальной |
= кислотного + |
металла |
|
+ металла |
||||||||||
соли |
|
|
остатка |
(в род. пад.) |
|
|
|
|
|
|||||
Например: NaCl — хлорид натрия, Fe(NO3)2 — нитрат железа (II), Fe2(SO4)3 — сульфат железа (III), Ca3(PO4)2 — фосфат кальция.
Графические формулы
При составлении графических формул нормальных солей следует в графических формулах соответствующих кислот замещать атомы водорода атомами металла с учетом валентности металла.
Составим графическую формулу сульфата кальция CaSO4. Эта соль содержит кислотный остаток серной кислоты H2SO4:
Валентность Са равна двум, поэтому один атом кальция замещает два атома водорода:
Составим графическую формулу сульфата железа (III) Fe2(SO4)3. Одна молекула этой соли содержит 3 кислотных остатка серной кислоты; один атом трехвалентного железа замещает 3 атома водорода:
66
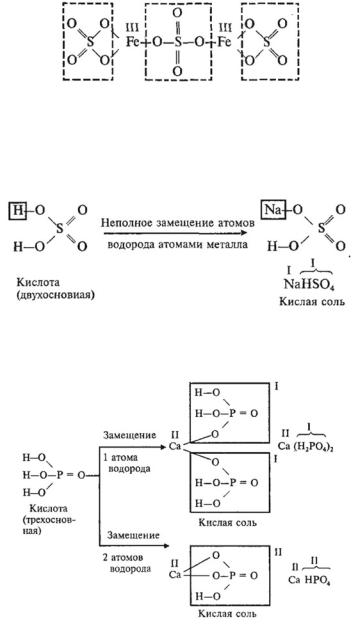
В молекуле нормальной соли сумма валентностей атомов металла равна сумме валентностей кислотных остатков.
КИСЛЫЕ СОЛИ
• Кислые соли — это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например:
Двухосновная кислота с любым металлом образует одну нормальную и одну кислую соль.
Трехосновная кислота с любым металлом образует одну нормальную и две кислые соли.
67
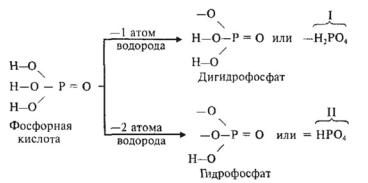
Номенклатура
Молекулы кислых солей содержат атомы водорода, латинское название которого «гидрогениум» (сокращенно: «гидро»).
Название |
«Гидро» |
Название |
Название |
Валент- |
кислой = |
или |
+ кислотного + |
металла |
+ ность |
соли |
«дигидро» |
остатка |
(в род. пад.) |
металла |
Например: NaHCO3 — гидрокарбонат натрия, К2НРО4 — гидрофосфат калия, FeHPO4 — гидрофосфат железа (II).
Приставка ди- используется, если в молекуле кислой соли с одним кислотным остатком связаны два атома водорода. Например: КН2РО4 — дигидрофосфат калия, Ca(H2PO4)2 — дигидрофосфат кальция.
Еще раз обратите внимание на то, что при отщеплении атомов водорода от молекулы фосфорной кислоты образуется или одновалентный дигидрофосфат, или двухвалентный дигидрофосфат:
ОСНОВНЫЕ СОЛИ
• Основные соли — это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками. Например:
68
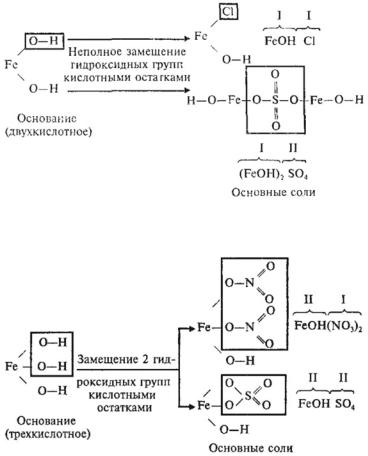
Двухкислотное основание образует одну нормальную и одну основную соль с данным кислотным остатком.
Трехкислотное основание образует одну нормальную и две основные соли с данным кислотным остатком. (Самостоятельно напишите формулы двух нормальных и двух однозамещенных основных солей, образуемых Fe(OH)3 и азотной и серной кислотами).
Номенклатура
Молекулы основных солей содержат гидроксидные группы (сокращенное название гидроксидной группы: «гидроксо»).
69
